INTRODUÇÃO
Bactérias do gênero Salmonella são bacilos Gram negativos que compõem um dos grupos mais complexos das Enterobacteriaceae, com mais de 2.500 sorotipos descritos. Essas bactérias estão amplamente dispersas na natureza e podem ser encontradas no trato gastrointestinal de mamíferos, répteis, aves e insetos (KONEMAN, 1997). É também uma das bactérias mais extensivamente estudadas em termos de fisiologia, genética e estrutura celular, sendo uma das bactérias patogênicas melhor caracterizadas em termos de virulência (DARWIN & MILLER), 1999).
A virulência das salmonelas é multifatorial e complexa, incluindo presença de fímbrias, de flagelos, mobilidade, habilidade de penetrar e replicar nas células epiteliais, resistência à ação do complemento, produção de entero, cito e endotoxinas (RODRIGUES, 2005). Alguns desses fatores são chamados de "clássicos" (VAN ASTEN & DIJK, 2005) e podem estar localizados em elementos genéticos transmissíveis, como transposons, plasmídeos ou bacteriófagos, assim como fazer parte de regiões específicas do cromossomo da bactéria, as chamadas Ilhas de Patogenicidade (IP), locais que agrupam a maioria dos genes de virulência (VAN ASTEN & VAN DIJK, 2005).
As IPs constituem-se por um grupo de genes envolvidos em codificar fatores específicos de virulência. Até o presente momento, cinco IPs foram descritas em Salmonella (HANSEN-WESTER; HENSEL, 2001). A IP-1 encontra-se presente em Salmonella bongori e todas as variedades de Salmonella enterica. Os operons Inv (invasibility) e Hil (hiper invasibility) estão presentes nesta ilha, em meio a outros genes e proteínas. O gene invA é o primeiro no operon, onde os genes invA, B e C estão arranjados na mesma unidade transcricional e o gene invD está localizado em uma unidade transcricional diferente (GALAN et al., 1992). Estudos demonstraram que a Salmonella Typhimurium tem como célula alvo, para entrada no epitélio intestinal de camundongos, a célula M, e que é necessária a presença do gene invA para uma eficiente invasão dessas células (CLARK et al., 1998). As células M da mucosa intestinal são ligadas aos folículos linfóides, que fazem a mediação da resposta inflamatória, recrutamento de granulócitos, macrófagos, monócitos e linfócitos (CALDWELL et al. 2004).
Outro importante influenciador da invasibilidade das Salmonella são os sistemas de secreção tipo III (SSTT) (WALLIS & GALYOV, 2000). O SSTT -1, é codificado por alguns genes, inclusive o invA, localizado na IP -1 e estes sistemas são responsáveis pela secreção de proteínas bacterianas que promovem a entrada da bactéria para o interior das células alvo.
Assim como outras bactérias patogênicas, as Salmonellas produzem apêndices de membrana chamados de fímbrias, mais curtos que os flagelos. São compostas por apenas uma proteína estrutura l, a pilina,e são dispostas de maneira helicoidal na superfície das bactérias gram-negativas (TORTORA, et al. 2000). As fímbrias têm um papel fundamental na adesão às superfícies sendo importantes na interação bactériahospedeiro, persistência ambiental, formação de biofilmes, colonização e invasão de células (GIBSON et al., 2007).
Em salmonelas já foram identificados 20 operons fimbriais. Fazendo parte dos operons fimbrias Salmonella-específicos, está o agf (aggregative fimbriae), que codifica a fímbria SEF17 ou Tafi (thin aggregative fimbriae), a qual permite estabilidadade à salmonela e autoagregação bacteriana. Tafi foi identificada em S. Enteritidis por White et al. (2003) que denominaram seu operon de agf em 1991. Este gene está envolvido com o aumento da aderência e invasão às células eucarióticas (revisão de GIBSON et al. 2007).
Na prevalência dos operons fimbriais Salmonella - específicos, está incluído o lpf (long polar fimbriae), que regula a expressão de fímbria polar. Esta fímbria é mais longa do que as outras fímbrias elaboradas e polarmente localizada na célula bacteriana. O gene lpfA codifica a maior subunidade da fímbria, sendo que os genes fimbriais lpf completos parecem estar presentes somente em algumas sorovares de Salmonella subespécie entéricas e S. bongori. Provavelmente a fímbria polar esteja envolvida no tropismo pelas placas de Peyer's em intestinos de ratos (BAÜMLER et al., 1998).
Apesar de estarem envolvidas na colonização das células alvo, as fímbrias não têm seu papel completamente compreendido na patogenicidade da Salmonella (VAN ASTEN & DIJK, 2005).
O presente trabalho teve o objetivo de avaliar a presença dos genes de virulência, invA, agfA e lpfA, em 45 amostras de Salmonella Hadar, isoladas a partir de materiais de origem avícola , pelo Centro de Diagnóstico e Pesquisa em Patologia Aviária – CDPA/UFRGS.
MATERIAL E MÉTODO
O trabalho em questão foi realizado no Centro de Diagnóstico e Pesquisa em Patologia Aviária (CDPA) da Universidade Federal do Rio Grande do Sul (UFRGS), em Porto Alegre. Foram analisadas 45 amostras de Salmonella Hadar, isoladas a partir de mecônio, carcaças e cortes de frango no Rio Grande do Sul, previamente identificadas no Instituto Oswaldo Cruz e que estavam estocadas na bacterioteca do CDPA-UFRGS. As amostras estavam acondicionadas em Agar Estoque e após reativação em caldo BHI, foram passadas para o caldo Rappaport-Vassiliadis que foi colocado em banhomaria a 42ºC por 24h. Após, as amostras foram estriadas em Agar Verde Brilhante (BGN) e incubadas novamente a 37ºC por 24h, para isolamento das colônias. Então foram selecionadas de 3 a 5 colônias com características compatíveis com as de Salmonella e inoculadas em microtubos tipo eppendorf contendo 1 ml de caldo BHI, sendo estes então incubados por 24h a 37ºC. A extração do DNA foi realizada a partir desta alíquota de BHI contida nos eppendorfs, e seguiu a técnica adaptada de Xuan Guo (2000), a qual é realizada a partir de centrifugações das alíquotas, seguidas de lavagem das mesmas e obtenção do DNA por lise das células bacterianas em banho– maria a 100ºC. Os mixes utilizados nas três reações eram semelhantes e continham um volume total de 25 μL, compostos de 2,5 μL de solução tampão (10 X), 2 μL de dinucleotídios (2,5 mM), 1 μL de cada primer (20pmol), 0,2 μL de Taq polimerase (1 U), 1,25 μL MgCl2 (2,5 mM), (para o gene lpfA a quantidade de MgCl2 foi de 2 μL) e 2 μL do DNA previamente extraído.
Os protocolos para o termociclador também eram muito parecidos, neles as amostras eram submetidas à desnaturação inicial de 5 minutos a 94 °C, seguida de 35 ciclos de desnaturação a 94 °C por 1 segundo, anelamento à 55°C (para o gene agfA a temperatura de anelamento foi de 58°C) por 1 segundo e extensão à 74°C por 21 segundos realizando-se uma extensão final à 72°C por 7 minutos. Os primers para cada gene utilizado nas reações estão descritos na tabela abaixo.
Tabela 1: Primers para os genes invA, agfA e lpfA.
Após a amplificação as amostras foram aplicadas em gel de agarose (1,2 %) com 20 % de brometo de etídeo, juntamente com um marcador de peso molecular. O gel foi submetido a eletroforese e posterior leitura em luz ultra violeta.
RESULTADOS E DISCUSSÃO
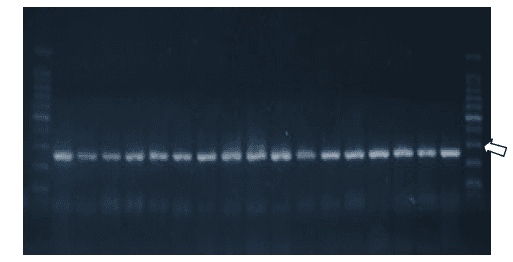
Os resultados obtidos nos testes mostram a presença dos três genes investigados em todas as amostras de Salmonella Hadar testadas, como pode ser verificado nas Figuras 1 a 3.
Figura 1: Imagem do gel de agarose. Bandas compatíveis com gene invA dos isolados de S. Hadar (284 pares de bases). Seta indicando banda de 300pb do marcador de peso molecular.
Figura 2: Imagem do gel de agarose. Bandas compatíveis com gene agfA dos isolados de S. Hadar (350 pares de bases). Seta indicando banda de 400pb do marccador de peso
Figura 3: Imagem do gel de agarose. Bandas compatíveis com gene lpfA dos isolados de S. Hadar (250 pares de bases). Seta indicando banda de 300pb do marcador de peso molecular.
A Salmonella Hadar pertence ao grupo das salmonelas partíficas ou zoonóticas, porém, diferente destas, S. Hadar, não é considerada, até o momento, pelo European Union Zoonosis Council Directive 92/117/EEC, um soro var invasivo. No entanto, este sorovar já foi isolado de órgãos de aves (DESMIT et al., 1998) e, associando este fato aos resultados desse trabalho, pode-se sugerir que a mesma possui um potencial invasivo. É neste contexto que estudos do genótipo da S. Hadar, como o realizado neste trabalho, vêem a contribuir para a sua caracterização e maior entendimento da interação da mesma com o hospedeiro.
REFERÊNCIAS BIBLIOGRÁFICAS
CLARK,M.A.; HIRST,B.H.; JEPSON,M.A. Inoculum composition and Salmonella pathogenicity island 1 regulate M- cell invasion and epithelial destruction by Salmonella typhimurium. Infection and Immunity , v.66, n.2, p.724-731, 1998.
DESMIDT,M.; DUCATELLE,R.; HAESEBROUCK,F. Serological and bacteriological observations on experimental infection with Salmonella hadar in chickens. Veterinary Microbiology, v.60, n.2-4, p.259-269, 1998.
DARWIN, K.H.; MILLER, V.L. Molecular Basis of the Interation of Salmonella withthe Intestinal Mucosa. Clin. Microbiol. Rev., 12: 405-428, 1999.
ECHEITA, M. A.; HERRERA, S.; GARANIZAR, J. et al. Multiplex- PCR based detection and identification of most common Samonella second-phase flagellar antigens. Research in Microbiology, v.153, p.107-113, 2002.
EUROSURVEILLANCE e- Alert. Over 2000 cases so far in Samonella Hadar outbreak in Spain associated with consuption of pre-coocked chicken. Disponível em <URL: http:// www.Samonellablog.com/Archives/002275.html >Acesso: mar. 2006.
GALAN,J.E.; GINOCCHIO,C.; COSTEAS,P. Molecular and functional characterization of the Salmonella invasion gene invA: Homology of InvA to members of a new protein family. Journal of Bacteriology, v.174, n.13, p.4338-4349, 1992.
GIBSON,D.L., et al. AgfC and AgfE facilitate extracellular thin aggregative fimbriae synthesis in Salmonella Enteritidis. Microbiology-Sgm, v.153, p.1131-1140, 2007.
GUO, X.; CHEN, J.; BEUCHAT, L.R.; et al. PCR detection of Samonella enterica serotype Montevideo in and on raw tomatoes using primers derived from hilA. Applied and Environmental Microbiology, p. 5248-5252, 2000.
HERISKTAD, H.; MOTARJEMI, Y.; TAUXE, R.V. Salmonella surveillance: a global survey of public health serotyping. Epidemiol. Infect., 129:1-8, 2002.
KONEMAN, E.W. Color atlas and textbook of diagnostic microbiology. 5 ed. Philadelphia: Lippincott,1997.p. 500-530.
RODRIGUES, D. P. Ecologia e prevalência de Salmonella spp. em aves e material avícola no Brasil. In: CONFERÊNCIA APINCO DE CIÊNCIA E TECNOLOGIA AVÍCOLAS, 2005. Santos, SP. Anais. Campinas: FACTA, 2005. v. 2, p. 223-228.
TORTORA, G. J; FUNKE, B. R.; CASE, C. L. Microbiologia. 6 ed. Porto Alegre, Artmed, 2000. p.83.
VAN ASTEN,A.J.A.M. & VAN DIJK,J.E. Distribution of "classic" virulence factors among Salmonella spp. Fems Immunology and Medical Microbiology, v.44, n.3, p.251-259, 2005.
WALLIS,T.S. & GALYOV,E.E. Molecular basis of Salmonella-induced enteritis. Molecular Microbiology, v.36, n.5, p.997-1005, 2000.










.jpg&w=3840&q=75)