1 INTRODUÇÃO
A avicultura industrial exige a cada dia maior acurácia na preparação de rações que resultem em melhoras no desempenho das aves, na redução de custos e na qualidade do produto final para o consumidor. Uma gama de produtos é utilizada na atividade avícola em substituição a ingredientes brutos ou que foram banidos pela legislação atual. Por exemplo, os aditivos promotores de crescimento possuem restrições em seu uso e uma desconfiança presente na comunidade consumidora, o que levou a indústria a buscar ingredientes substitutos como óleos essenciais, prebióticos e probióticos, mantendo o desempenho competitivo da atividade. Nesta mesma linha surgem outros ingredientes industriais contendo fatores específicos melhoradores de ações digestivas ou mesmo fornecedores de nutrientes diretos que englobam características de alimentos funcionais. Propriedade funcional é o termo empregado ao papel metabólico que o nutriente ou não nutriente tem no crescimento, desenvolvimento, manutenção e outras funções normais do organismo além de disponibilizar ao animal a quantidade de nutrientes que lhe é necessária fornecendo, também, a possibilidade de melhorar outra característica à parte (Souza et al., 2003). Dentre estes ingredientes, podemos citar o farelo de soja fermentado (PepSoyGen® - Nutraferma), que é um ingrediente resultante da fermentação do farelo de soja utilizando como organismos fermentadores o Bacillus subtilis e o Aspergillus oryzae, e que já é utilizado para suínos. Este produto, segundo Rojas et al. (2013), contém 91,3% de Matéria Seca (MS), 53,7% de Proteína Bruta (PB), 3,11% de lisina, 0,76% de metionina, 0,8% de extrato etéreo, 3,3% de fibra bruta (FB), 0,29% de cálcio e 0,82% de fósforo. O produto resultante é rico em peptídeos, livre de fatores antinutricionais comuns no farelo de soja, e possui a presença de organismos ainda vivos que poderiam exercer ação probiótica quando consumidos pelas aves. Portanto, foi proposto este trabalho, com o intuito de avaliar o uso farelo de soja fermentado (FSF) em pequena concentração no desempenho produtivo, nas características da carcaça, no peso relativo dos órgãos auxiliares do processo digestivo, na metabolizabilidade e na morfometria intestinal de frangos de corte considerando, adicionalmente, o valor nutritivo (peptídeos livres) e o efeito remanescente do Bacillus subtilis e do Aspergillus oryzae como probiótico mantenedor da estrutura intestinal.
2 METODOLOGIA
Foram utilizados 960 pintos de 1 dia de idade, machos e fêmeas, pertencentes à linhagem Cobb 500, com peso médio de 38±0,12g, vacinados no incubatório contra as doenças de Marek e Gumboro. As aves foram pesadas e categorizadas segundo metodologia proposta por Sakomura & Rostagno (2007), distribuídas num delineamento inteiramente casualizado composto por cinco diferentes concentrações de farelo de soja fermentado (FSF) - PepSoyGen® (Nutraferma) e oito repetições, sendo a unidade experimental composta por 24 aves, totalizando 40 unidades experimentais. Os tratamentos consistiram em: Tratamento 1 (T1) - sem adição de FSF; Tratamento 2 (T2) - adição de 0,5% de FSF; Tratamento 3 (T3) - adição de 1,0% de FSF; Tratamento 4 (T4) - adição de 1,5% de FSF e Tratamento 5 (T5) - adição de 2,0% de FSF. O produto foi adicionado à ração basal sem o recálculo dos níveis nutricionais.
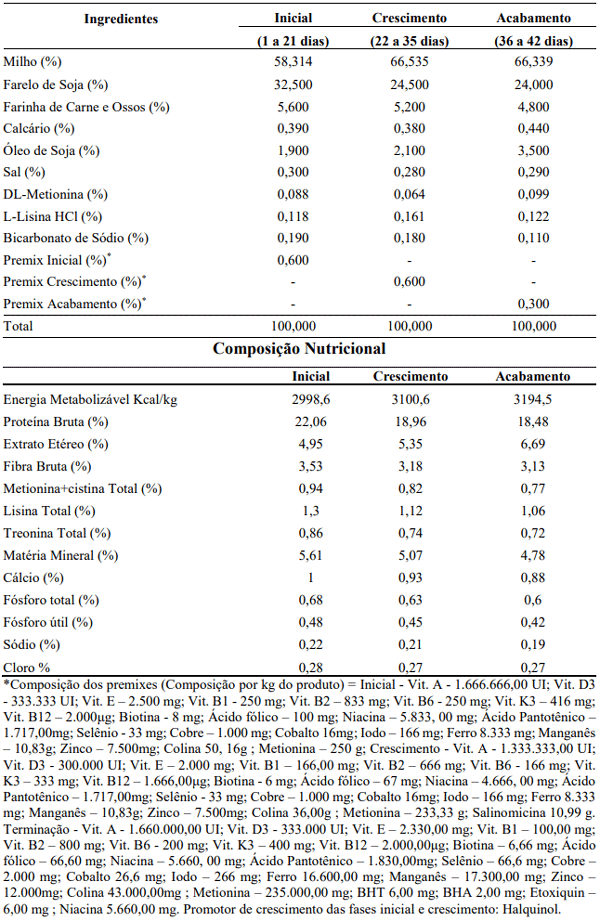
As rações (tabela 1) foram constituídas de: milho, farelo de soja, farinha de carne e ossos, calcário, óleo de soja, aminoácidos industriais, premix mineral e vitamínico e atenderam às exigências nutricionais de cada fase, de acordo com as Tabelas Brasileiras de Exigências Nutricionais para Suínos e Aves (Rostagno et al., 2011). Não foi retirado o antibiótico promotor de crescimento das rações.
Foram coletados dados das variáveis ambientais (temperatura e umidade relativa do ar) através de Data Logger instalado no centro do galpão, a cada 10 minutos, durante todo o período experimental. A partir dos dados coletados foi efetuado o cálculo de Índice de Temperatura e Umidade (ITU) segundo Buffington et al (1981) onde, ITU = 0,72 x (Tbs + Tbu) + 40,6 (Tbs: temperatura de bulbo seco (ºC ), Tbu: temperatura de bulbo úmido (ºC)). Durante o período experimental a temperatura média foi de 28,03ºC e a umidade relativa de 86,55%, assim como 79,21 de ITU.
Tabela 1. Composição centesimal (%) calculada das rações destinadas à alimentação de frangos de corte, conforme fases de crescimento
Semanalmente foram coletados, através de pesagem e cálculo por diferença, dados para a avaliação do desempenho produtivo como o peso dos animais, o consumo de ração e a mortalidade, para a determinação do ganho de peso total (g), do ganho de peso diário (g/dia), do índice de mortalidade (%), consumo de ração (g) e conversão alimentar.
Foi calculado o Fator de Eficiência Produtiva (FEP), para avaliação do desempenho, levando em consideração o peso vivo, a viabilidade, a idade e a conversão alimentar, conforme equação postulada por Olmos (2009) onde, FEP = (PESO VIVO (kg) X VIABILIDADE) / (IDADE (dias) X CA) X 10, sendo a CA = Conversão Alimentar (kg ração consumida / kg peso animal) e VIABILIDADE = 100 – (%Mortalidade).
Ao final do experimento foi retirada uma ave por unidade experimental representando a média de peso do grupo, totalizando oito aves por tratamento. As aves foram pesadas, identificadas com anilhas que continham seu devido tratamento e repetição e submetidas a jejum de 8 horas. Após o jejum, foram pesadas novamente e abatidas por deslocamento cervical, conforme o protocolo aprovado pela Comissão de Ética no Uso de Animais (CEUA/UFRA nº 009/2013).
Foram pesados o coração, os intestinos, o fígado, a moela, o pró‐ventrículo e o pâncreas, para posterior cálculo da relação entre peso corporal da ave viva (em jejum) e o peso individual de cada órgão. Neste momento, amostras de duodeno, de jejuno e de íleo de cada ave foram retiradas para análise posterior das vilosidades do enterócito. Foi utilizado o micrótomo ZEISS (Hyrax M 25) a 5 µ de espessura para a confecção de lâminas coradas por Hematoxilina-Eosina (HE). Em seguida, foi realizada mensuração das vilosidades intestinais em microscópio para que fossem determinados tamanho de vilosidades e profundidade de cripta.
As carcaças depenadas, sem pés, pescoço, cabeça e vísceras, foram pesadas para obtenção da relação do rendimento de carcaça com o peso vivo antes do abate.
Concomitante ao experimento de desempenho, foi conduzido um estudo para determinar a metabolizabilidade das rações contendo FSF (PepSoyGen® - Nutraferma), onde foram utilizados 400 pintos machos de corte da linhagem Cobb com 14 dias de idade, distribuídos num delineamento inteiramente casualizado em 40 gaiolas metabólicas distribuídas com cinco tratamentos, oito repetições e 10 aves/repetição (gaiola). O método utilizado foi o de coleta total adotando o procedimento sugerido por Sakomura & Rostagno (2007). Após as coletas, as excretas foram submetidas à prévia retirada de penas e fragmentos de ração, posteriormente pesadas frescas e acondicionadas em sacos plásticos, identificados por unidade experimental e mantidos em freezer a - 20°C.
Para a análise, as excretas foram descongeladas à temperatura ambiente, pesadas e homogeneizadas para retirada de uma amostra de 300 g de cada unidade experimental, e seguiu-se os procedimentos laboratoriais do Laboratório de Nutrição Animal do Instituto da Saúde e Produção Animal da UFRA (LABNUTAN/ISPA/UFRA – Belém). Foram determinados: a secagem definitiva (Matéria Seca - MS) (VAN SOEST, 1967), a matéria mineral ou cinzas (VAN SOEST, 1967), o nitrogênio total (N) (KJELDAHL, 1883), a gordura bruta ou extrato etéreo (VAN SOEST, 1967), fibra insolúvel em detergente neutro e em detergente ácido (VAN SOEST, 1963) e, com a utilização de Bomba Calorimétrica, o teor de energia bruta (EB), seguindo os procedimentos descritos pela AOAC (1997).
Com base nos dados de consumo, produção de excretas, análises de MS, N e EB das rações e excretas foi determinada a energia metabolizável aparente (EMA) e aparente corrigida (EMAn), utilizando-se as equações propostas por Matterson et al. (1965).
Os coeficientes de metabolizabilidade aparente (CM) foram determinados de acordo com a fórmula indicada por Schneider e Flatt (1975): (CM% = Nutriente consumido (g) – Nutriente excretado (g) x 100/Nutriente consumido (g)).
As análises estatísticas foram realizadas por meio do programa SAS University Edition (SAS Institute Inc. 2014) e a melhor concentração de FSF, foi estabelecida por modelos de regressão, considerando o melhor ajuste para p< 0,05 e o R²> 0,50.
3 RESULTADOS E DISCUSSÃO
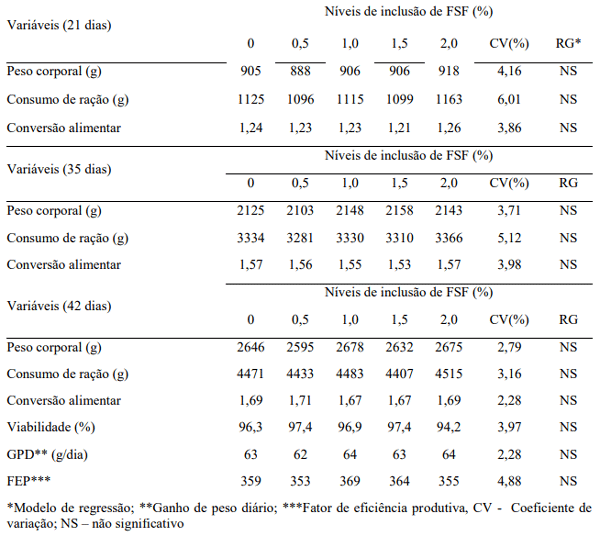
Ao término das três fases de criação não foi constatado efeito dos níveis de inclusão de FSF para os parâmetros de desempenho aferidos (p> 0,05), conforme disposto na tabela 2. Isto evidencia que os valores adicionais possíveis, de aminoácidos, do produto não melhoraram os dados de desempenho, assim como a presença dos microorganismos Bacillus subtillis e Aspergillus oryzea não alteraram as variáveis analisadas nos frangos alimentados com concentrações crescentes. Tais resultados se encontram dissonantes dos encontrados por Molnár et al. (2011), em experimento testando o efeito de diferentes concentrações de probiótico a base de Bacillus subtillis sobre o desempenho de frangos de corte. Já Nunes et al. (2012), trabalhando com a utilização de Bacillus subtillis combinado ou não com antibiótico promotor de crescimento (halquinol) não encontraram diferenças para o uso do probiótico, no entanto houve melhora na conversão alimentar dos animais no tratamento do microrganismo combinado com o antibiótico.
Tabela 2. Desempenho de frangos de corte alimentados com Farelo de Soja Fermentado (FSF) aos 21 (fase inicial), 35 (fase de crescimento) e 42 (terminação) dias de criação.
O Aspergillus oryzea, assim como o Bacillus subtillis, foi inicialmente estudado como agente probiótico em rações para frango de corte e resultados de melhora na digestibilidade dos nutrientes e no desempenho dos animais foram encontrados (Kyungwoo Lee et al., 2010), no entanto, de forma bem superficial sem muito benefício. Esperava-se que o uso conjunto com o Bacillus subtillis pudesse ocasionar melhora no desempenho das aves, o que não ocorreu.
Com a concepção de que os microrganismos oriundos do FSF, atuam na colonização da flora intestinal benéfica, além de ser uma fonte nutricional prontamente digestível, esperava-se uma diminuição dos valores de conversão alimentar em relação ao tratamento controle, fato este que não foi observado. Estudo anterior usando farelo de soja fermentado (0, 0.5, 1.0, 1.5% de inclusão) na alimentação de frangos, mas com outro microrganismo (Aspergillus niger), também não foram observadas diferenças entre as médias das variáveis de desempenho analisadas (Mathivanan et al., 2006). Essa tendência está de acordo com os resultados encontrados por Chen et al (2009) e Mutuş et al (2006) em estudos envolvendo utilização de aditivos probióticos sobre desempenho de frangos de corte. Em experimento mais recente, Barnes et al (2012) testaram o uso de farelo de soja fermentado (PepSoyGen®) para juvenis de truta arco-íris como eventual substituto à farinha de peixe (0, 10, 20, 30 e 40% da farinha de peixe) e não encontraram diferenças entre as concentrações fornecidas, ou seja, o PepSoyGen® pode substituir até 40% do alimento padrão. É possível que as concentrações reduzidas propostas neste experimento não tragam nenhum benefício no desempenho de frangos de corte, quer seja pelo efeito nutricional, quer seja pelo efeito como probiótico. Já Rojas et al (2013), testando diferentes concentrações (2,5 – 9 e 11%) de farelo de soja fermentado (PepSoyGen®) juntamente com a inclusão ou não de farinha de peixe, destacaram que o PepSoyGen® pode efetivamente substituir fontes de proteína de origem animal em leitões desmamados. No entanto, o nível de inclusão foi superior ao proposto neste trabalho.
Não houve efeito da adição do FSF sobre o fator de eficiência produtiva (FEP) das aves alojadas. Por se tratar de um fator dependente da correlação entre o peso vivo, a viabilidade e a conversão alimentar, variáveis estas que não apresentaram tendência de aumento pela utilização do aditivo, a não significância constatada se encontra de acordo com o padrão demonstrado pelo experimento.
Os resultados obtidos para rendimento de carcaça ao final do experimento podem ser observados na tabela 3.
Tabela 3. Rendimento de carcaça de frangos de corte alimentados com Farelo de Soja Fermentado (FSF) aos 42 dias de idade.
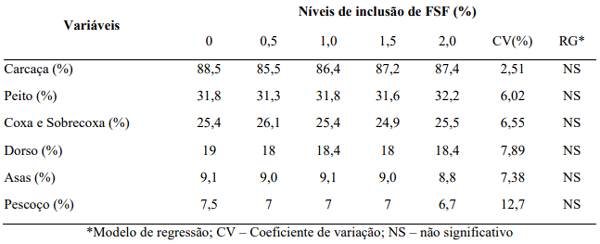
Os diferentes níveis de inclusão administrados não influenciaram no rendimento de carcaça e cortes comerciais pesados (p> 0,05). Por se tratar de um aditivo rico em peptídeos de soja prontamente absorvíveis, esperava-se um padrão diferente do apresentado, justamente pelo possível aumento do fornecimento nutritivo, especificamente, proteico. De acordo com Leeson (1995), à medida que há incremento da absorção protéica, há aumento do rendimento de peito das aves, por se tratar de uma característica geneticamente aprimorada nas linhagens de frangos de corte. O que se esperava era o aumento gradual do rendimento de cortes seguindo o aumento dos níveis de inclusão do FSF, já que uma das ações do produto visa um aproveitamento nutritivo mais eficiente, com uma menor excreção nitrogenada, maior disponibilidade de porções peptídicas e menor incremento calórico ao animal, podendo destinar a energia sobressalente para síntese de proteína muscular.
Quanto ao efeito indireto como probiótico, os resultados obtidos são consonantes aos encontrados por Heloisa et al (2014), em experimento avaliando o desempenho e rendimento de carcaça de frangos de corte alimentados com dietas contendo probiótico nas diferentes fases de criação, e também estão de acordo com os resultados encontrados por Molnár et al (2011).
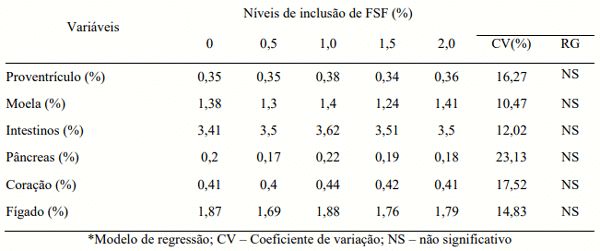
Não foi observado efeito dos níveis de inclusão do FSF sobre os pesos relativos de órgãos de frangos de corte, como demonstrado na tabela 4.
Tabela 4. Peso relativo de órgãos de frangos de corte alimentados com diferentes concentrações de Farelo de Soja Fermentado (FSF).
Em poucos estudos foram observados efeitos significativos sobre o peso ou o desenvolvimento dos órgãos internos seguindo a utilização de probióticos. Chen et al (2009), em estudo envolvendo a utilização de um composto fermentado (Bacillus subtillis e Saccharomyces cerevisiae) sobre o desempenho relativo de órgãos de frangos, observaram diminuição do tamanho do fígado dos animais tratados em comparação com o controle negativo. Há de se confirmar em estudos futuros o efeito de probiótico no fígado, pois segundo os autores, não há como definir se a diminuição foi gerada pela mistura probiótica ou por uma das cepas especificamente, porém é uma variável a ser tratada com mais minúcia em experimentos envolvendo o FSF contendo associação entre Apergillus oryzae e Bacillus subtilis.
A metabolizabilidade da dieta não foi influenciada pela adição do Farelo de Soja Fermentado (FSF) em nenhum de seus níveis de inclusão, como demonstrado na tabela 5.
Tabela 5. Coeficientes de metabolizabilidade das rações, energia metabolizável aparente e corrigida dos frangos de corte alimentados com Farelo de Soja Fermentado (FSF).
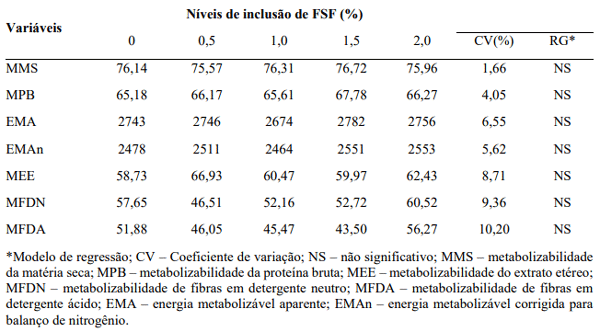
Os resultados de coeficientes de metabolizabilidade dos nutrientes e a energia metabolizável das rações foram semelhantes entre os tratamentos suplementados ou não com diferentes concentrações de FSF. Desta forma, embora o aditivo proponha favorecer a saúde intestinal das aves e ainda adicione uma carga nutritiva extra à dieta, neste estudo não proporcionou uma melhora na absorção dos nutrientes. Esses resultados discordam daqueles observados por Tournut (1998), que demonstrou que probiótico, administrado através da dieta, elevou os valores da energia metabolizável da ração. A ineficiência do uso do Farelo de Soja Fermentado utilizado no presente estudo pode estar ligada ao fato de que o efeito sobre a metabolizabilidade não se dá de forma direta, e sim um possível efeito indireto associado às atividades promovidas junto à comunidade microbiana presente no trato digestório. Segundo Santos (2012), este efeito pode ser afetado por uma série de fatores, tais como picos de temperatura e um possível desafio sanitário, o que não foi medido neste trabalho em questão.
Além da metabolizabilidade aparente, o produto tem por objetivo a melhora estrutural e, por consequência, fisiológica alcançada na região intestinal. Com isso, foram avaliadas variáveis ligadas à morfometria intestinal das aves abatidas. A tabela 6 apresenta os resultados obtidos.
Levando-se em consideração que parâmetros de desempenho das aves (tabela 3) e de morfometria das porções intestinais (tabela 6) não sofreram interferência com a adição do produto, a resposta em relação à metabolizabilidade é coerente. Porém, pelo que o produto se propõe e a sua forma de inclusão (com uma carga nutritiva adicionada sem recálculo de valores nutritivos da dieta), era de se esperar um resultado seguindo um padrão de melhora, principalmente em relação às porções nutricionais nitrogenadas. No entanto, a semelhança nos resultados para metabolizabilidade da proteína permite deduzir que não houve excesso ou perda na disponibilidade dos aminoácidos.
Tabela 6. Altura de vilos, profundidade de cripta e relação vilo/cripta das porções intestinais do trato de frangos de corte alimentados com diferentes concentrações de FSF.
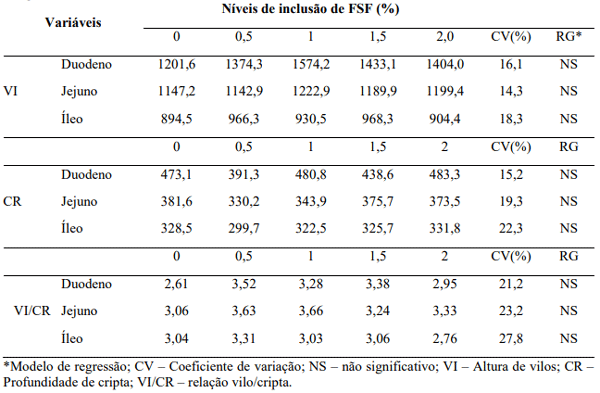
Não houve efeito dos níveis de inclusão de FSF sobre os parâmetros de morfometria intestinal avaliados. As três porções responsáveis pela digestão e absorção corroboram com os demais resultados avaliados neste trabalho e não interferiram nas variáveis estudadas. A literatura é variável quanto aos padrões morfométricos e sobre a metodologia utilizada para medição dos valores, assim como as características (Tomasi, 2006; Sem et al, 2012), porém, tendo os dados do presente estudo seguido o mesmo padrão, estatisticamente, a resposta alcançada pode ser considerada verdadeira ao que o experimento se predispôs. A importância em medir este parâmetro está em razão do número de vilosidades e seu tamanho, bem como o de microvilos, em cada segmento do intestino delgado, que conferem a eles características próprias, sendo que na presença de nutrientes a capacidade absortiva do segmento será diretamente proporcional ao número de vilosidades ali presentes, tamanho dos vilos e área de superfície disponível para a absorção (Macari, 1999).
O ambiente controlado e, supostamente, livre de patógenos pode ter garantido uma boa integridade das células de absorção. Relatos de Cook & Bird (1973) indicam que aves criadas em ambientes livres de patógenos apresentam uma redução na altura de vilos, bem como na profundidade de cripta, sugerindo que o crescimento normal do epitélio intestinal dependa também do equilíbrio da microbiota ali residente. Assim, a integridade da mucosa do trato intestinal conferiria ao frango de corte condições adequadas para a digestão e absorção dos nutrientes, fator este que não foi alterado pela inclusão em diferentes concentrações do FSF.
O uso de FSF (Pepsoygen® - Nutraferma) nestes níveis de inclusão como possível fornecedor de microrganismos com funções probióticas e melhoradoras de desempenho pode estar aquém das concentrações necessárias que seriam suficientes para alterar o equilíbrio da microbiota intestinal, indicando que seriam necessários outros estudos com maior concentração do produto para verificar um possível efeito benéfico à morfometria intestinal, peso relativo de órgãos, rendimento de carcaça e desempenho de frangos de corte.
4 CONCLUSÃO
O farelo de soja fermentado nas diferentes concentrações propostas neste trabalho não interferiu no desempenho produtivo, rendimento da carcaça e suas características, no peso relativo dos órgãos, na metabolizabilidade nutritiva e na morfometria do trato intestinal em frangos de corte.
Publicado originalmente na revista eletrônica Brazilian Journal of Development, Curitiba, v.8, n.2, p.14888-14903, feb., 2022. Acesso disponível em: https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/view/44579










.jpg&w=3840&q=75)