Xilanase: impacto no crescimento e saúde intestinal de frangos de corte
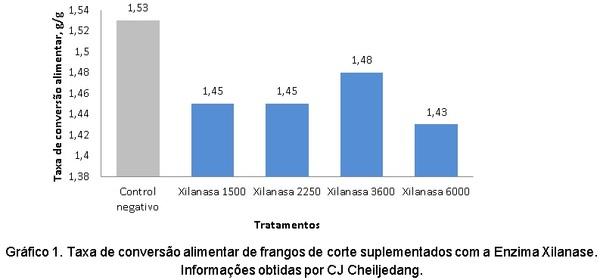
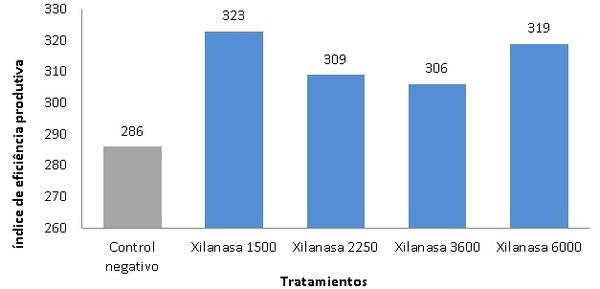
Alqaisi, O.; Ndambi, O.A.; Hemme, T. Global view on feed cost and feed efficiency on dairy farms. All About Feed. 2:4. 2011.
Bedford, M.R. Exogenous enzymes in monogastric nutrition-their current value and future benefits. Anim Feed Sci Technol.;86:1–13, 2000.
Bedford, M.R.; Schulze, H. Exogenous enzymes for pigs and poultry. Nutr. Res. Rev. 11, 91–114, 1998.
Choct, M. Feed Non-Starch Polysaccharides: Chemical Structures and Nutritional Significance. Feed Milling International, 6:13-26, 1997.
Choct, M.; Annison, G. Anti-Nutritive Effect of Wheat Pentosans in Broiler Chickens: Roles of Viscosity and Gut Microflora. British Poultry Science, 33: 821-834. 1992.
Choct, M.; Hughes, R. J.; Wang, J.; Bedford, M. R.; Morgan, A. J.; Annison, G. Feed enzymes eliminate the anti-nutritive effect of non-starch polysaccharides and modify the fermentation in broilers. Proc. 7th Austr. Poult. Sci. Symp., p. 121-125, 1995.
Choct, M.; Kocher, A.; Water, D.L.E.; Pettersson, D.; Ross, G. A comparison of three xylanases on the nutritive value of two wheats for broiler chickens. Br J Nutr, 92:53–61, 2004.
Choct, M.; Hughes, R.J.; Bedford, M.R. Effects of a xylanase on individual bird variation, starch digestion throughout the intestine, and ileal and caecal volatile fatty acid production in chickens fed wheat. Br Poult Sci. 40:419–422, 1999.
Choct, M.; Kocher, A.; Waters, D.L.E.; Pettersson, D.; Ross, G. A comparison of three xylanases on the nutritive value of two wheats for broiler chickens. Br J Nutr. 92:53–61. 2004.
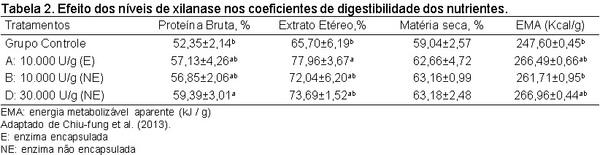
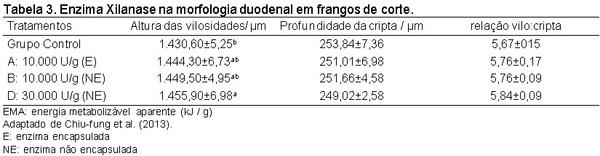
Chiu-fung, L.; Xue, M.C.; Chung, W.; Man, C.; Hang, C.; Wah, L. K. Effect of different levels of xylanase on the growth performance and development of the immune and digestive organs in chicken. Chin. J. Clin. Nutr, 11:018.1006-267x, 2013.
Christensen, H.R.; Frokiaer, H.; Pestka, J.J. Lactobacilli differentially modulate expression of cytokines and maturation surface markers in murine dendritic cells. J Immunol, 168: 171–178, 2002.
Collins, T.; Gerday, C.; Feller, G. Xylanases, xylanase families and extremophilic xylanases. FEMS Microbiol. Rev. 29: 3–23, 2005.
Cowieson, A.J.; Bedford, M.R. The effect of phytase and carbohydrase on ileal amino acid digestibility in monogastric diets: complementary mode of action? World’s Poult. Sci. J., 65:609-624., 2009.
Cowieson, A.J.; Bedford, M.R.; Ravindran, V. Interactions between xylanase and glucanase in maize-soy-based diets for broilers. Br Poult Sci, 51:246–57, 2010.
Dai, D.; Wu, S.; Zhang, H.; Qi, G.; Wang, J. Dynamic alterations in early intestinal development, microbiota and metabolome induced by in ovo feeding of L-arginine in a layer chick model. J. Anim. Sci. Biotechnol, 11:19. 2020.
Esmaeilipour, O.; Moravej, H.; Shivazad, M.; Rezaian, M.; Aminzadeh, S.; Van Krimpen, M.M. Effects of diet acidification and xylanase supplementation on performance, nutrient digestibility, duodenal histology and gut microflora of broilers fed wheat based diet. Br Poult Sci, 53:235–24, 2012.
Gao, F.; Jiang, Y.; Zhou, G.H.; Han, Z.K. The effects of xylanase supplementation on performance, characteristics of the gastrointestinal tract, blood parameters and gut microflora in broilers fed on wheat-based diets. Anim Feed Sci Technol, 142:173–184, 2008.
Gao, P.; Ma, C.; Sun, Z.; Wang, L.; Huang, S.; Su, X.; XU., J.; Zhang, L. Feed-additive probiotics accelerate yet antibiotics delay intestinal microbiota maturation in broiler chicken. Microbiome, 5:91, 2017.
Gomide Junior, M.H.; Sterzo, E. V.; Macari, M.; Boleli, I.C. Use of scanning electron microscopy for the evaluation of intestinal epithelium integrity. R. Bras. Zootec. 33:6, 2004.
Hoeck, V.V.; Wu, D.; Somers, I.; Wealleans, A.; Vasanthakumara, B.L.; Sanchez, A.L.G.; Morisset, D. Xylanase impact beyond performance: A prebiotic approach in broiler chickens. J Appl Poult Res, 30:4, 2021.
Hu, H; Dai, S.; Wen, A, Bai, X. Efficient Expression of Xylanase by Codon Optimization and Its Effects on the Growth Performance and Carcass Characteristics of Broiler. Animal, 9:65, 2019.
Hübener, K., Vahjen, W., and Simon, O. Bacterial responses to different dietary cereal types and xylanase supplementation in the intestine of broiler chicken. Arch. Anim. Nutr, 56: 167–187, 2002.
Lee, S.H.; Hosseindoust, A.; Laxman Ingale, S.; Rathi, P. C.; Yoon, S. Y.; Choi, J.W. Thermostable xylanase derived from Trichoderma citrinoviride increases growth performance and non-starch polysaccharide degradation in broiler chickens. Br. Poult. Sci. 6: 57–62, 2020.
Lji, P. A.; Saki, A.; Tivey, D.R. Body and intestinal growth of broiler chicks on a commercial starter diet. 1. Intestinal weight and mucosal development. Br. Poult. Sci. 42: 505–513. 2001.
Masey-O Neill, H.V.; Singh, M.; Cowieson, A.J. Effects of exogenous xylanase on performance, nutrient digestibility, volatile fatty acid production and digestive tract thermal profiles of broilers fed on wheat-or maize-based diet. Br. Poult. Sci., 55:351-359, 2014.
Moftakharzadeh, S.A.; Janmohammadi, H.; Taghizadeh, A. Kianfar R, Olyayee, M. Effect of enzyme addition on energy utilization and performance of broiler chickens fed wheat-based diet with different metabolizable energy levels. Acta Scientiarum. Animal Sciences, 41: e44585, 2019.
Mohammed, A.A.; Habib, A.B.; Eltrefi, A.M.; Shulukh, E.S.A.; Abubaker, A.A. Effect of different levels of multi-enzymes (Natuzyme Plus®) on growth performance, carcass traits and meat quality of broiler chicken. Asian J. Anim. Vet. Adv. 13: 61–66. 2017.
Olgun, O.; Altay, Y.; Yildiz, A.O. Effects of carbohydrase enzyme supplementation on performance, eggshell quality, and bone parameters of laying hens fed on maize-and wheat-based diets. Br. Poult. Sci. 59: 211–217, 2018.
Petry, A,L.; Patience, J.F.; Koester, L.R.; Huntley, N.F.; Bedford, M.R.; Schmitz-Esser, Stephan. Xylanase modulates the microbiota of ileal mucosa and digesta of pigs fed corn-based arabinoxylans likely through both a stimbiotic and prebiotic mechanism. PLOS ONE, 16: e0246144, 2021.
Ravindran. V. Feed enzymes: the science, practice, and metabolic realities. J. Appl. Poult. Res., 22: 628-636, 2013.
Raza, A.; Bashir, S.; Tabassum, R. An update on carbohydrases: growth performance and intestinal health of poultry. Heliyon 5:e1437. 2019.
Roberts, T.; Wilson, J.; Guthrie, A.; Cookson, K; Vancraenest, K.; Schaeffer, J.; Moody, R.; Clark, S. New issues and science in broiler chicken intestinal health: Emerging technology and alternative interventions. J. Appl. Poult. Es, 24: 257-266, 2015.
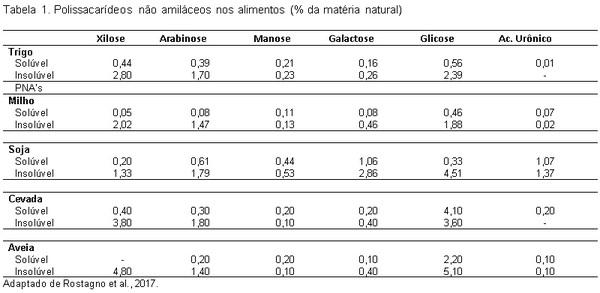
Rostagno, H.S.; Albino, L.F.T.; Donzele, J.L.; Gomes, P.C.; Oliveira, R.F.; Lopes, D. C.; Ferreira, A.S.; Barreto, S.L.; Euclides, R.F. Tabelas brasileiras para aves e suínos: composição de alimentos e exigências nutricionais. 3.ed. Viçosa, MG: Universidade Federal de Viçosa, 2011. 254p.
Rostagno, H.S.; Albino, L.F.T.; Hannas, M.I.; Donzele, J.L.; Sakomura, N.K.; Peazzo, F.G. Saraiva, A.; Texeira, M.L.; Rodrigues, P.B.; Oliveira, R.F.; Barreto, S.L.T.; Brito, C.O. Tabelas brasileiras para aves e suínos. 4.ed. Viçosa, MG: Universidade Federal de Viçosa, 2017. 488p.
Saki, A.A.; Hematti Matin, H.R.; Zamani, P., Tabatabai, M.M.; Vatanchian, M. Various ratios of pectin to cellulose affect intestinal morphology, DNA quantitation, and performance of broiler chickens. Journal of Livestock Science, 139:237-244, 2011.
Stefanello, C.; Vieira, S.L.; Rios, H.V.; Simões, C.T.; Sorbara O.B. Energy and nutrient utilization of broilers fed soybean meal from two different Brazilian production areas with an exogenous protease. Animal Feed Science and Technology, 221:267-273, 2016.
Singh, A.K.; Kim, W.K. Effects of dietary fiber on nutrients utilization and gut health of poultry: a review of challenges and opportunities. Animals, 11:181, 2021.
Slominski, B.A.; Guenter, W.; L.D. Campbell. New approach to water-soluble carbohydrate evaluation of plant cell wall degrading enzymes. J. Agric. Food Chem. 41:2304–2308, 1993.
Sklan, D. Development of the digestive tract of poultry. Worlds Poult Sci J ., 57: 415-428, 2001.
Spector, M.D. Small intestinal mass of the rat is partially determined by indirect effects of intraluminal nutrition, 52:3-5, 1976.
Tanabe, H.; Ito, H.; Sugiyama, K.; Kiriyama, S.; Morita, T. Dietary indigestible components exert different regional effects on luminal mucin secretion through their bulk-forming property and fermentability. Biosci. Biotechnol. Biochem, 70: 1188-1194, 2006.
Van Der Wielen, P.W.J.J.; Biesterveld, S.; Notermans, S.; Hofstra, H.; Urlings, F. van Knapen, B.A.P.; Role of volatile fatty acids in development of the cecal microflora in broiler chickens during growth. Appl. Environ. Microbiol. 2536- 2540, 2000.
Van Der Klis, J.D.; Voorst, A. V. The Effect of Carboxy Methyl Cellulose (A Soluble Polysaccharide) on the Rate of Marker Excretion from the Gastrointestinal Tract of Broilers. Spelderhol Centre for Poultry Research and Information Services, Agricultural. Research Department (DLO-NL), 7360 AA, 1993.
Vandeplas, S.; Dauphin, R.D.; Thonart, P.; Théwis, A.; Beckers, Y. Effect of the bacterial or fungal origin of exogenous xylanases supplemented to a wheat-based diet on performance of broiler chickens and nutrient digestibility of the diet. Can J Anim Sci 90:221–228, 2010.
Valdivia, L.A.; Matos, M.M.; Rodriguez, Z.; Perez, Y.; Rubio, Y.; Vega, J. Enzymatic additives and their use on animal rearing. Cuba. J. Agric. Sci., 53:4, 2019.
Wang, J.; Sujie Liu, S.; Ma, J. Piao, X. Changes in Growth Performance and Ileal Microbiota Composition by Xylanase Supplementation in Broilers Fed Wheat-Based Diets. Front. Microbiol, 15, 2021.
Wealleans, A.L.; Walsh, M.C.; Romero, L.F.; Ravindran, V. Comparative effects of two multi-enzyme combinations and a Bacillus probiotic on growth performance, digestibility of energy and nutrients, disappearance of non-starch polysaccharides, and gut microflora in broiler chickens. Poult. Sci., 96:4287-4297, 2017.
Wyatt, C.L.; Bedford, M.R. Uso de enzimas nutricionais para maximizar a utilização de nutrientes pelo frango de corte em dietas à base de milho: recentes progressos no desenvolvimento e aplicação prática. In: SEMINÁRIO TÉCNICO FINNFEEDS, 1998, Curitiba. Anais... Curitiba: Finnfeeds, 1998. p.2-12.
Ward, N.E. Debranching enzymes in corn/soybean meal–based poultry feeds: a review. Poult. Sci. pp. 1-11, 2021.
Yang, K.; Pinker, R.T.; Ma, Y.; Koike, T.; Wonsick, M.M.; Cox, S.J.; Zhang, Y.C.; Stackhouse, P. Evaluation of satellite estimates of downward shortwave radiation over the Tibetan Plateau. J. Geophys. Res., 113: D17204, 2008.
Yaghobfar, A.I.; Kalantar, M.I.I. Effect of Non–Starch Polysaccharide (NSP) of Wheat and Barley Supplemented with Exogenous Enzyme Blend on Growth Performance, Gut Microbial, Pancreatic Enzyme Activities, Expression of Glucose Transporter (SGLT1) and Mucin Producer (MUC2) Genes of Broiler Chickens. Revista Brasileira de Ciência Avícola, 19: 629-638, 2017.
Zhang, L.; Xu, J.; Lei, L.; Jiang, Y.; Gao, F.; Zhou, G.H. Effects of xylanase supplementation on growth performance, nutrient digestibility and non-starch polysaccharide degradation in different sections of the gastrointestinal tract of broilers fed wheat-based diets. Asian Australas. J. Anim. Sci. 27:855–861, 2014.










.jpg&w=3840&q=75)