INTRODUÇÃO
A avicultura de corte brasileira tem se destacado a cada ano, com resultados promissores ao agronegócio. Concomitante ao seu desenvolvimento, a avicultura de corte trouxe novos empregos e rendas ao país, contando em 2018, com um total de 48.526.181 matrizes de corte alojadas, notificando-se no ano seguinte, um aumento de 6,2%. O que destaca o grande progresso anual no setor (ABPA, 2020). A produção brasileira de carne de frango, em 2019, foi de 13,245 milhões de toneladas, mantendo o pódio de segundo maior produtor mundial de carne de frango, onde 68% da produção nacional é destinada ao mercado interno, contando com um consumo per Capta de 42,84 kg (ABPA, 2020).
A cadeia produtiva de frangos de corte apresenta vantagens competitivas devido ao seu rápido ciclo produtivo no período caracterizado como pós 1990, com a abertura do mercado latino-americano que impulsionou o setor e admitindo o Brasil a condições favoráveis para competir a nível mundial (RODRIGUES et al., 2014), de forma próspera, segura e rentável (WIERSBITZKI, 2017).
Em estudos realizados pela Embrapa, observou-se que nos últimos 50 anos o volume produzido de carne de frangos foi multiplicado em 16 vezes, enquanto para suínos e bovinos, no mesmo período, isso ocorreu em cinco e duas vezes, respectivamente (TALAMINI et al., 2018). Como parte dos negócios em avicultura de corte tem-se o aumento na densidade populacional das aves e a reutilização da cama, como medidas adotadas a fim de maximizar os lucros.
Em decorrência da intensificação avícola, a alta umidade da cama gerada pelas excretas das aves promove um ambiente propício para o desenvolvimento do Alphitobius diaperinus PANZER (Coleóptera: Tenebrionidae), o principal inseto praga da avicultura mundial e veiculador de patógenos. Este inseto é popularmente conhecido como “cascudinho” e sua presença compele a programas de vacinação visando estimular o sistema imunológico das aves com o objetivo de proporcionar desempenho produtivo e evitar o surgimento de doenças no plantel (MORGULIS, 2002).
Para o controle da alta infestação deste inseto praga, sucessivas aplicações de inseticidas químicos industriais a base de piretróides, por exemplo, são realizadas. Essas substâncias são moduladores dos canais de sódio e causam a hiperpolarização da membrana, interferindo nas bombas de sódio e potássio, isto é, o pesticida é tóxico para o inseto assim como para os seres humanos e animais. Dessa maneira, a utilização deve ser feita com muita cautela, pois pode trazer prejuízos à saúde dos envolvidos, e mesmo assim o inseto vem apresentando resistência (GALLO et al., 2002; SOARES et al., 2020).
Sendo assim e, em relação a sua presença, as análises sanguíneas servem como recurso para o monitoramento da saúde das aves no diagnóstico de doenças (VOIGT, 2003; REBAR, 2003; GONZÁLEZ; SANTOS, 2005). Contudo, para que seja empregada corretamente é necessário a compreensão da fisiologia do animal avaliado em suas condições de criação. Também deve ser considerado que o constante surgimento de tecnologias voltadas para a avaliação hematológica em mamíferos não segue a mesma frequência quando comparadas as outras espécies, incluindo as aviárias. Por exemplo, as células sanguíneas aviárias são resistentes, e morfologicamente sua diferenciação se torna difícil, visto que os eritrócitos e trombócitos se apresentam nucleados. Desse modo, a hematologia das aves se delimita às técnicas microscópicas cautelosas (CORDEIRO, 2003).
Outra ferramenta de diagnóstico está na bioquímica. Os componentes bioquímicos do plasma refletem fielmente o metabolismo dos tecidos animais, de modo que as alterações na função do órgão, a adaptação do animal aos desafios nutricionais, fisiológicos e desequilíbrios metabólicos específicos ou fontes nutricionais podem ser avaliados. No entanto, para uma interpretação correta, valores de referência apropriados para as espécies precisam ser analisados (REZENDE, 2017). Assim, o objetivo deste estudo foi o de avaliar a interferência do Alphitobius diaperinus sobre os parâmetros hematológicos e bioquímicos de frangos de corte mantidos em sistema intensivo, como na avicultura tradicional em galpões telados.
MATERIAL E MÉTODOS
Este experimento foi aprovado pela Comissão de Ética no Uso de Animais - protocolo 0013-2021-CEUA-UNIR e realizado em uma propriedade familiar no município de Rolim de Moura – RO, no período de maio a julho de 2021. Sendo as coordenadas geográficas do município: Latitude 11o 43’ 48” S, Longitude 61o 46’ 47” O e 232 m de altitude (CIDADES-BRASIL, 2021) e clima tipo Am (tropical de monção) se caracterizando com temperatura média entre 28,5 ºC e 30 ºC, precipitação média anual de 2.250 mm, umidade relativa em torno de 85% e apresentando um período de seca bem definido, compreendido entre os meses de maio a agosto, podendo se estender até setembro (ALVARES et al., 2014).
A realização deste estudo se deu com a construção de dois galpões de madeira, com 3m2 apresentando 2 m de pé direito, coberto com telha de cimento amianto, suspendido do chão cerca de 0,30 m e com um rodapé de 0,30 m, sendo três lados cercados com tela galvanizada e um de alvenaria. Estas estruturas contavam com lâmpadas led ourolux a fim de permitir 12 horas de iluminação por dia. Foram adotados bebedouros de pressão e comedouros pendulares para o fornecimento "ad libitum", do concentrado e água tratada.
Para a cama dos frangos foi empregada a maravalha com camada de 10 cm espessura. Esse material foi obtido de uma serralheira e se encontrava recentemente cortado, limpo, sem a presença de qualquer inseto ou sujidades. Com o propósito de que um dos galpões inicialmente contassem com a presença do cascudinho, foi necessário adquirir cama infestada (coletou-se 7 kg) com o inseto de avicultura local, com a presença de adultos e larvas. Após 24 horas fez-se amostragem, com recipientes plásticos de 40 mL, em 10 pontos do galpão e foi obtido 8,3 ± 3,01 de insetos adultos e 1,20 ± 1,01 de larvas. Esses dados são intermediários a levantamento realizado em condições de galpão industrial, também com amostragens em 40 mL de volume, onde fora obtido 7,4 ± 2,83 insetos adultos, 1,80 ± 1,13 larvas fora da linha de arraçoamento, 14,0 ± 3,59 insetos adultos e 10,3 ± 3,49 larvas na linha de arraçoamento.
Para permitir a comparação entre os tratamentos, o galpão com cascudinho foi forrado com uma lona plástica a qual ocupou 50 cm das lateias no intuito de impedir a contaminação do galpão sem cascudinhos (controle).
No comércio local e de firma idônea foram adquiridos 30 pintainhos de corte, da linhagem comercial RO 95, machos e fêmeas, com 41 ± 1,20 g de peso vivo. Essas aves foram identificadas com cores artificiais (esmalte de unha), em determinada região da asa a fim de ser possível o acompanhamento individual em relação ao seu desenvolvimento. Após a identificação, foram aleatoriamente separados, 15 pintainhos em cada galpão.
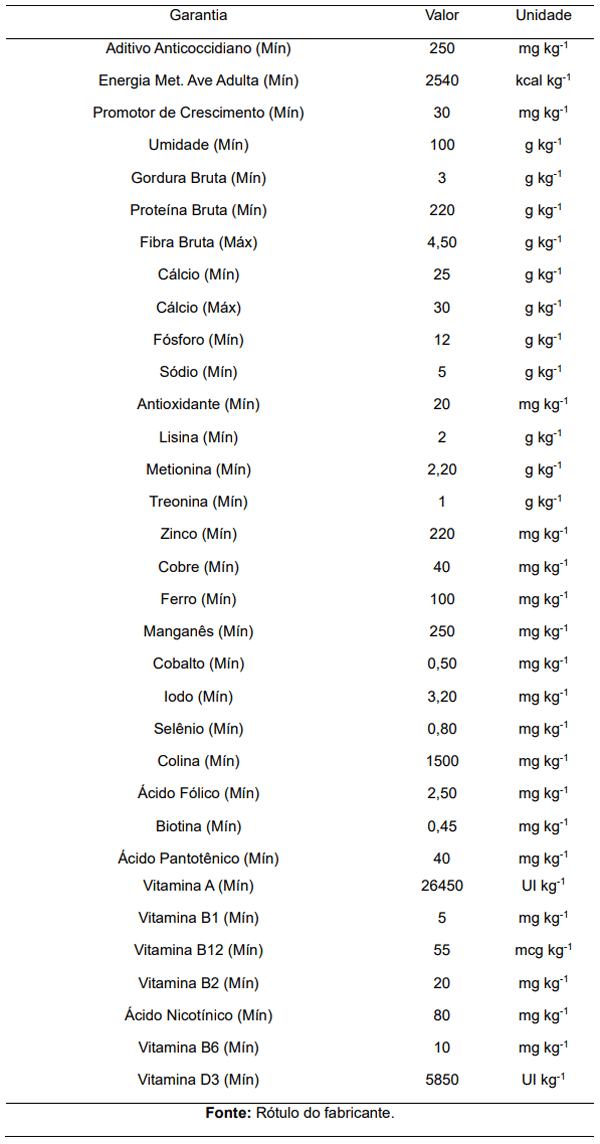
O manejo alimentar se deu com a oferta da mesma ração (Tabela 1) e da mesma fonte de água durante todo período experimental, que para o caso foi de 56 dias.
Tabela 1: Níveis de garantia da dieta ofertada para aves durante o período experimental.
Ao final de 56 dias de experimento foi realizada a coleta sanguínea de 6 aves de cada tratamento, a fim de verificar alterações hematológicas e bioquímicas. Procedeu-se a coleta de 1,0 mL de sangue, por punção da veia braquial (localizada na face medial da asa), ao qual eles foram posicionados dorsalmente e contidos pelos pés e pescoço.
Posteriormente a contenção das aves foi realizada a punção da veia suavemente para que não houvesse colabamento do vaso (a veia encontra-se muito superficial). Em seguida certificou-se de que a agulha estava dentro da veia e então realizou-se a tração do êmbolo lentamente, respeitando a vazão da veia. Para o procedimento foram utilizadas seringas plásticas descartáveis com volume de 3,0 mL e armazenadas em tubos com anticoagulante. Com este material foram realizadas as contagens totais de leucócitos e trombócitos, contagem diferencial de leucócitos e avaliação dos índices hematimétricos. Todas as análises hematológicas foram realizadas no Laboratório de Anatomia Animal da Universidade Federal de Rondônia Campus Rolim de Moura.
Para a contagem de leucócitos totais, trombócitos totais e diferencial, foi padronizado o volume de 5,0 µL de sangue previamente homogeneizado e realizada extensão sanguínea em lâmina microscópica, seguida da fixação com álcool metílico e exposta ao ar livre para a secagem. Depois de secas, as amostras foram coradas com a solução Rosenfeld, prévia padronização. Por meio de conta-gotas a extensão sanguínea foi coberta delicadamente com a solução Rosenfeld e posteriormente aguardado 3 minutos. Em seguida foi coberta toda a extensão gota a gota com solução tampão pH 7,0 até preencher toda a lâmina sem transbordar o corante. Por fim utilizou-se uma pipeta de vidro (assoprando) para homogeneizar e acentuar a reação, pondo-a para descansar por dez minutos, e em seguida foi realizada cuidadosamente a lavagem das extensões em água corrente, deixando-as secar ao ar livre e posteriormente feita a leitura em microscópio de luz em imersão.
Para avaliar a quantidade de hemoglobina, utilizou-se o método da cianometahemoglobina (BLAXHALL; DAISLEY, 1973), onde 5,0 μL de sangue foram diluídos em 1,0 mL do reagente Drabkin; após 10 minutos (completa conversão da hemoglobina em cianometa-hemoglobina) a amostra foi centrifugada a 3000 xg por 5 minutos para sedimentação do núcleo dos eritrócitos, o sobrenadante foi lido em espectrofotômetro Biochemistry Analyzer SX-3000M, no comprimento de onda 540 nm e os resultados foram expressos em g 100 mL-1. Com o mesmo preparo foi lido o nível de proteínas plasmáticas por meio da avaliação do plasma mediante o uso de um Refratômetro portátil modelo RHC 200ATC.
Amostras sanguíneas homogeneizadas foram introduzidas em capilares para microhematócrito e uma das extremidades do capilar foi selada. Os capilares foram centrifugados por 5 min. 10.000 xg em centrífuga para microhematócrito e a avaliação foi realizada com a tabela de microhematócrito expressa em porcentagem.
Para a contagem de eritrócitos, alíquotas de sangue foram diluídas em tubo de ensaio na proporção 0,05 mL de sangue para 1,0 mL do diluente Natt e Herrick (NATT; HERRICK, 1952). Após homogeneizar suavemente a solução, foi realizada a contagem em câmara de Neubauer em 5 áreas de 0,04 mm2 de ambos os lados da câmara, feito a média e aplicada a fórmula:
O resultado foi expresso em números eritrócitos 106 µL-1 de sangue.
Seguiu-se a metodologia de Corteze (2019). Posteriormente a contagem eritrocitária (RBC) na câmara de Neubauer, realizou-se a contagem de leucócitos nos campos denominados L, seguida da substituição do valor dessas células na fórmula a seguir.
Leucócitos (µL) = No leucócitos x 1.1 x 200
A leitura para contagem diferencial de leucócitos foi realizada em microscópio óptico de luz em imersão onde foram contados 200 leucócitos em cada lâmina, e o resultado expresso em % de cada tipo celular (linfócito, heterófilo, monócito e eosinófilo). Em seguida foi calculado o número absoluto de cada um com relação ao número total de leucócitos observados na câmara de Neubauer (MARTINS et al., 2004).
Para a contagem de trombócitos por estimativa empregou-se a metodologia descrita por Corteze (2019). Com o auxílio da extensão sanguínea realizou-se a contagem de trombócitos em relação a 2000 eritrócitos, seguida da substituição do valor obtido na fórmula a seguir.
Trombócitos (µL) = No de trombócitos x 1.000
Para avaliar os índices hematimétricos seguiu-se a metodologia descrita por Wintrobe (1934). Sendo, para o volume corpuscular médio (VCM) dividiu-se o valor do hematócrito (Ht) pela contagem total de eritrócitos (RBC) e multiplicando-se por 10. Este valor representa o tamanho médio dos eritrócitos.
Para hemoglobina corpuscular média (HCM) dividiu-se o valor da hemoglobina (Hb) pela contagem total de eritrócitos (RBC) e multiplicou-se por 10.
Para concentração de hemoglobina corpuscular média (CHCM) foi calculada pela razão entre a hemoglobina (Hb) e hematócrito (Ht).
O experimento foi desenhado em delineamento inteiramente casualizados e os dados submetidos à análise de variância a 5% de probabilidade utilizando do software SISVAR (FERREIRA, 2019).
RESULTADOS E DISCUSSÃO
Em relação aos tratamentos estudados, presença do inseto não foi verificada em todo período experimental. O odor da madeira recém cortada provavelmente gerou um ambiente de baixa hospedabilidade para este inseto.
Para a análise bioquímica a referência foi de < 5 para ureia, 0,1 – 0,4 para creatinina, ambos em unidade mg dL-1 e referência < 275 para AST /TGO (Transaminase Oxalacética/Aspartato Aminotransferase) em unidade UI L-1 (Tabela 2).
Tabela 2 - Análise bioquímica de frangos de corte em relação a presença (C) ou não (S) de cascudinho.
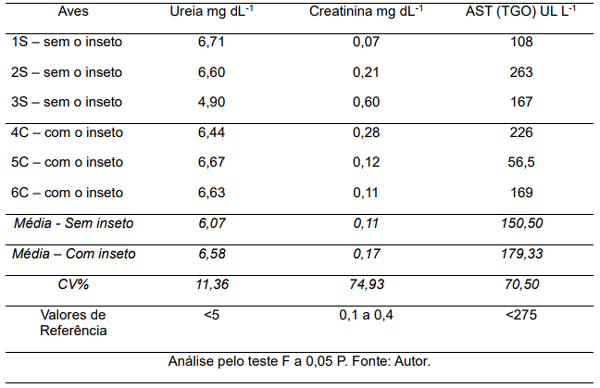
Em relação a ureia, os exames das aves foram realizados baseando-se em mg dL-1, considerando que o parâmetro para este exame menor do que 5, observou-se que apenas a ave 3S apresentou conformidade para os níveis de ureia. Schmidt et al. (2007) “destacam que o ácido úrico e a ureia são as provas bioquímicas utilizadas para avaliar a função renal das aves”. Contudo, visto que todas as aves foram alimentadas com dieta balanceada para a fase de crescimento durante todo o período experimental, e sabendo-se que a dieta voltada para a fase de crescimento compreende uma porcentagem alta de proteína, leva-se acreditar que os níveis superiores de ureia sejam em função da rica concentração de proteína na dieta, ao qual o organismo metaboliza a proteína em ureia e estabelece uma alternativa para a eliminação do excedente. Por exemplo, em função do programa nutricional adotado para frangos de corte tem-se que o nível de proteína bruta (PB) mudará conforme a fase de criação, de 21,2% PB de 1 a 7 dias, de 20,8% PB entre 8 a 21 dias, 19,5%PB de 22 a 35 dias e 18,3% PB de 36 a 45 dias (BERTECHINI, 2012).
Os valores de referência para os níveis de creatinina variam de 0,1 –0,4 para aves. Dentre a avaliação dos exames nota-se que a ave 3S obteve resultado elevado de creatinina e a ave 1S apresentou resultado inferior aos parâmetros de referência em sua amostra. Vila (2013) ressalta que “os valores de creatina são mais adequados para o diagnóstico de problemas renais em aves”. Tendo em vista que apenas uma das aves analisadas obteve o resultado dos níveis de creatinina superior ao estabelecido, afirma-se que a elevação de creatinina em apenas uma ave não pode ser diretamente ligada a presença ou ausência do inseto praga Alphitobius diaperinus.
O parâmetro estabelecido para a enzima AST (TGO) é < 275 UL L-1, ou seja, menor que 275 UL L-1 nos organismos das aves (Tabela 2) são indicativos de que as amostras possuem regularidade entre todas as seis aves pesquisadas independente do tratamento. Como Bahiense (2010) afirma que elevações na AST (Transaminase Oxalacética/Aspartato Aminotransferase) são geralmente indicativas de desordens hepáticas ou musculares, afirma-se que as aves analisadas não possuem deficiência em qualquer destes aspectos, sendo denominas de acordo com os resultados dos exames em aves sadias.
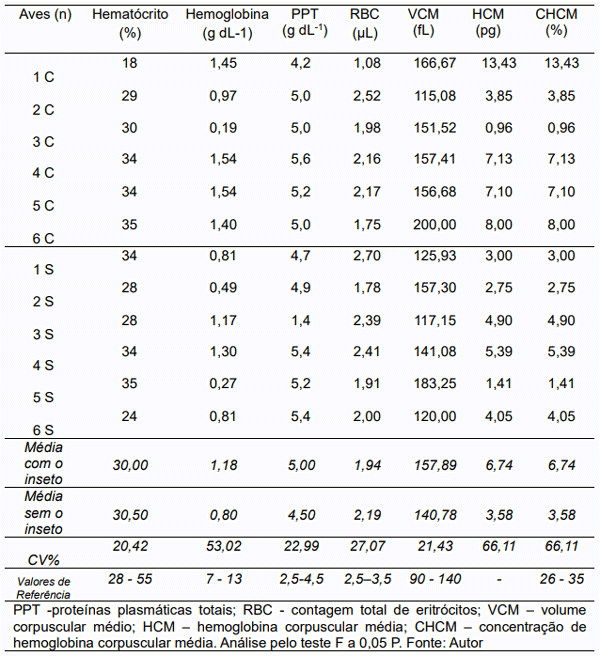
O parâmetro para hematócrito é de 28– 55 (%), o que demonstra que todas as aves estão em conformidade e não apresentando efeito significativo quanto ao tratamento (Tabela 3). Como caso pontual há a exceção das aves 1C e 6S, que se encontram com 18% e 24% de hematócrito respectivamente, resultados estes inferiores aos parâmetros estabelecidos. Para o hematócrito, observaram-se valores semelhantes aos obtidos por Bournous e Stedman (2000), que encontraram resultados de 22 a 35%, contudo, foram menores aos de Samour (2006), com percentuais de 30 a 49%. Segundo Bernardini (2016), “Quando o hematócrito está baixo, é indicativo de que há diminuição da quantidade de hemácias, ou mais frequentemente, de hemoglobina no sangue, como ocorre na anemia ferropriva por exemplo”.
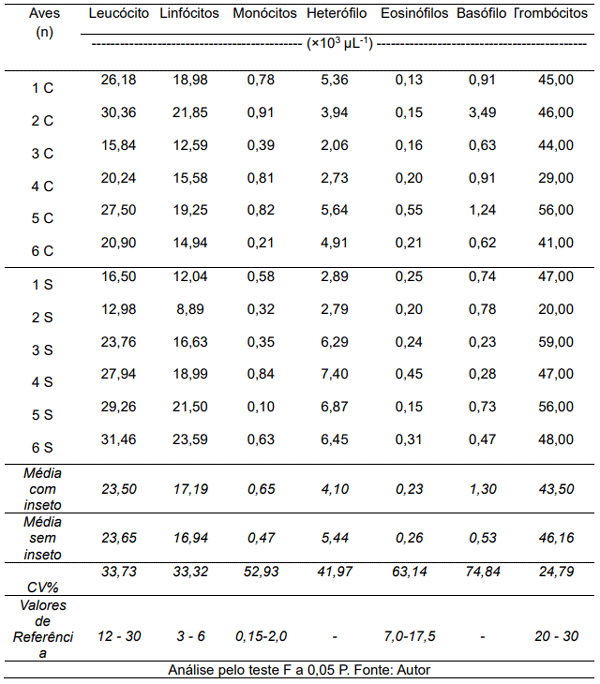
Tabela 3 – Análise hematológica de frangos de corte em relação a presença (C) ou não (S) de cascudinho.
Para hemoglobina não ocorreu diferença significativa. O intervalo utilizado para hemoglobina é de 7 – 13 (g dL-1), mas desta forma, observou-se que todas as aves, até mesmo as que não apresentaram cascudinho, estão com hemoglobina abaixo do intervalo padrão, podendo estar relacionada a metodologia empregada. Segundo Maranhão (2017), essa proteína, que tem como função o transporte de oxigênio pelo organismo, pode apresentar-se de diferentes formas.
O intervalo padrão é de 90 – 140 (fL) para VCM, também sem diferença estatística. O índice deste resultado encontra-se normal apenas para a ave 2C na categoria de aves que foram desafiadas pela presença do cascudinho, enquanto as que não possuem o inseto apenas as aves 1S, 3S e 6S estão em conformidade. Para o CHCM o intervalo é de 26 - 35%, o que mostra que todas as aves, tanto para o tratamento com cascudinho ou sem a presença do inseto estão apresentando CHCM abaixo do normal.
A Hemoglobina Corpuscular Média (HCM) refere-se ao conteúdo médio de hemoglobina em cada glóbulo vermelho. Vale ressaltar que houve disparidade nos valores de HCM dentro e entre os tratamentos.
Sobre a contagem de eritrócitos totais (RBC), também sem significância estatística, tem-se que os valores de referência estabelecidos variam de 2,5 - 3,5 10³ µL em frangos de corte. Os estudos de Gebert et al. (2018) mostraram que em comparação com o grupo controle, a dieta suplementada com óleo de tomilho (onde o timol é o composto principal) aumentou a contagem de glóbulos vermelhos e o conteúdo de hemoglobina dos frangos de corte. Nesta pesquisa, evidenciou-se que apenas a ave 2C obteve conformidade com os valores de referência estabelecidos.
As proteínas plasmáticas totais (PPT) estão agrupadas em duas grandes categorias, albumina e globulinas, as quais têm muitas funções. Segundo os valores de referência considerados por Thrall et al. (2012) as proteínas plasmáticas totais estão entre 2,5 e 4,5 g dL-1 de sangue. Neste sentido, cinco das aves que compõem o grupo C (com cascudinho) estão apresentando seus resultados superiores ao estabelecido para proteína plasmática total (PPT), sendo apenas um integrante do tratamento apresentando conformidade com os valores estabelecidos por Thrall et al. (2012). Oliveira (2015) ressalta que “a concentração das proteínas está na dependência dos equilíbrios hídrico e hormonal, estado nutricional e outros fatores envolvidos em condições de saúde”. No tratamento sem cascudinho, nenhuma das aves analisadas apresentou-se em conformidade com os valores de referência estabelecidos por Thrall et. al. (2012). Cinco aves apresentaram-se com resultados acima dos valores de referência e uma ave apresentou resultado inferior ao estabelecido.
Para o leucograma também não se observou diferença estatística para os parâmetros analisados, mas, pontualmente pode-se considerar que: os leucócitos têm intervalo padrão de 12 – 30 (10³µL), o que mostra que todas as aves analisas (Tabela 4) apresentaram-se em conformidade com os parâmetros estabelecidos, com exceção apenas da ave 6S que apresentou-se com resultado acima do padrão desejado. Bernardini (2016) afirma que “Os leucócitos das aves possuem funções semelhantes à dos mamíferos, onde os heterófilos são o tipo mais abundante para a maioria das espécies, seguido dos linfócitos”. Neste sentido, as aves podem apresentar alterações drásticas em relação aos processos infecciosos, o que evidencia a importância de se realizar as avaliações de resposta imunológica das aves.
Tabela 4 – Análise hematológica referente ao leucograma de frangos de corte em relação a presença (C) ou não (S) de cascudinho.
Os linfócitos têm seu intervalo padrão entre 3 – 6 (10³ µL-1), demonstrando assim que nenhuma das aves estão em conformidade, todas apresentam aumento no número de linfócitos. Bernardini (2016) destaca que “o aumento do número de linfócitos geralmente ocorre como um resultado da estimulação antigênica”, o que ocasiona a produção de anticorpos.
Para Oliveira (2015) o “aumento do número de monócitos circulantes ocorre em resposta a uma doença infecciosa ou inflamatória”. Os monócitos analisados têm intervalo padrão de 0,15 – 2,0 (103 µL-1), evidenciando assim que todas as aves analisadas estão em conformidade com os valores de referência estabelecidos.
O intervalo para eosinófilos é de 7,0-17,5 (103 µL-1), o que mostra que as aves analisadas, tanto no tratamento com os insetos quanto em sua ausência estão com baixo número desta célula. Considerando que segundo Bernardini (2016) a “eosinofilia é geralmente desenvolvida em processos inflamatórios enquanto os antígenos parasitários geralmente não induzem eosinofilia em ave”.
Cardoso e Tessari (2003) apontam que a eosinofilia pode ocorrer em casos de infecções bacterianas agudas, como pneumonia ou meningite, por serem infecções bacterianas graves que tendem a aumentar outros tipos de células de defesa, como os heterófilos, o que reduz eosinófilos Contagem absoluta ou relativa de células. De acordo com Cirule et al. (2012), nas respostas ao estresse observa-se uma diminuição dos eosinófilos.
Os basófilos estão envolvidos na hipersensibilidade do tipo IV e na inflamação aguda. Além disso, as propriedades basofílicas são observadas em doenças respiratórias e danos graves aos tecidos (SILVA, 2010). Apenas a ave denominada 2C teve aumento significativo de basófilos em comparação as demais.
Os valores normais de trombócitos variam entre 20.000 e 30.000 µL-1, demostrando assim que apenas a ave 2S apresenta-se em conformidade com os valores estabelecidos e as demais aves apresentam-se com seus resultados superior ao empregado.
Segundo Borsa (2009), vale ressaltar que são diversos os fatores que podem influenciar nos valores hematológicos, como raça e linhagem das aves, alimentação empregada, temperatura ambiental, local anatômico da punção venosa e técnica seguida, dentre outros, expondo assim as variações entre os valores encontrados no presente trabalho e de outros autores.
CONSIDERAÇÕES FINAIS
A presença do cascudinho (Alphitobius diaperinus PANZER.) não influenciou de forma significativa os parâmetros hematimétricos: hematócrito (Ht), hemoglobina (Hb), proteína plasmática total (PPT), a contagem total de eritrócitos (RBC), o volume corpuscular médio (VCM), a hemoglobina corpuscular média (HCM) e a concentração da hemoglobina corpuscular média (CHCM), apesar de serem observados valores discrepantes (HCM), valores abaixo (Hb, RBC, CHCM) e acima (PPT) do normal de referência.
Para parâmetros bioquímicos de ureia, creatinina e transaminase oxalacética/ aspartato aminotransferase, não se observou diferença estatística.
A presença (parcial) do inseto também não influenciou de forma significativa os parâmetros leucocitários. Para ambos os tratamentos foi observado níveis inferiores para linfócitos, eosinófilos e superiores para trombócitos, em relação aos valores de referência.
AGRADECIMENTOS
Na oportunidade se externa os agradecimentos ao Grupo de Estudos em Produção Animal e Aproveitamento de Resíduos (GEPAAR – UNIR/CNPq) e ao Programa Institucional de Bolsas de Iniciação Científica (PIBIC) e Programa Institucional de Bolsas de Iniciação em Desenvolvimento Tecnológico e Inovação (PIBITI), ciclo PIBIC/PIDIT 2021-2022 – UNIR/CNPq.
Esse artigo foi originalmente publicado em RECIMA21 -CiênciasExatas e da Terra, Sociais, da Saúde, Humanas e Engenharia/Tecnologia v.3, n.6, 2022 | https://www.recima21.com.br/index.php/recima21/article/view/1507/1203.

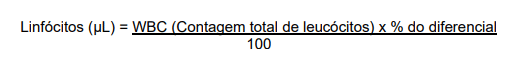











.jpg&w=3840&q=75)