Fitase dieta poedeiras
A Fitase: Produção e uso na dieta de poedeiras
Publicado: 14 de dezembro de 2009
Por: Matheus Ramalho de Lima (Aluno Programa de Doutorado, Zootecnia UFPB/UFC/UFRPE - Bolsista CNPq), Fernando Guilherme Perazzo
Introdução
As poedeiras, assim como outras aves, não têm a capacidade de síntese de fitase de origem endógena na velocidade necessária para degradar o fitato e evitar que minerais como fósforo, cálcio, zinco, magnésio e outros nutrientes como aminoácidos tenham o aproveitamento perturbado pela presença excessiva de fitato no trato gastrointestinal dessas aves. Assim, o aproveitamento do fósforo do milho e do farelo de soja de respectivamente 33 e 38% em condições normais deve ser estimulado numa relação dependente da presença e do nível de fitase na dieta (Silva et al., 2008).
As matérias-primas de origem vegetal usadas na fabricação de rações sejam grãos, legumes e até sementes de oleaginosas, boa parte do fósforo contido nesses ingredientes está em uma forma indisponível para as aves, ou seja, na forma de ácido fítico ou fitato, que segundo Pandey et al., 2001 e Socol et al., 2002, não são degradados pelos animais monogástricos, como as aves. Além do fósforo, o fitato gera outros prejuízos à disponibilidade de outros nutrientes como cálcio, cobre, magnésio, ferro, manganês e zinco, pois esses cátions bivalentes se ligam ao fitato tornando-os indisponíveis (Lehninger et al., 1994).
Vários autores relatam que métodos químicos e físicos, tais como: extração, precipitação, tostagem e autoclavagem podem ser utilizados para reduzir o ácido fítico presente em alguns produtos, porém a aplicação destes métodos provoca perda parcial de alguns nutrientes, como as proteínas e minerais (Alasheh, 1995).
A fitase ou mioinositol hexaquifosfato fosfohidrolase é uma enzima pertencente ao grupo das fosfatases de histidina ácida que hidrolisam o fitato para mioinositol e ácido ortofosfato necessário ao processo metabólico na biossíntese celular (PANDEY, et al., 2001). A hidrólise do fitato desagrega o complexo liberando o que ali estavam ligados, disponibilizando aos animais. Sendo assim, as fitases além de contribuírem para uma melhor digestão de certos componentes nos animais monogástricos, também contribuem para a diminuição nos níveis de fósforo excretado pelo animal, com conseqüente diminuição da poluição provocada pelo excesso de fósforo no meio ambiente, assim como dos níveis de inclusão na dieta.
A síntese de fitase efetuada pela membrana celular de microrganismos é comercialmente a forma mais promissora de produção da enzima, e apesar da habilidade de produção das bactérias e leveduras, os fungos são mais utilizados (PANDEY et al. 2001). A atividade da fitase é expressa como sendo a quantidade de enzima que hidrolisa 1 micromol de fosfato inorgânico por minuto proveniente de 1,5mM de fitato em pH 5,5 e à temperatura de 37°C, expresso em unidades de fitase, PU ou FTU (YI et al., 1996)
Inicialmente, os processos de produção utilizavam o método de fermentação submersa, mas, atualmente, a fermentação no estado sólido (FES) tem despertado maior interesse, em função dos bons rendimentos apresentados.
O objetivo do presente artigo é oferecer uma revisão sobre as características, funções e métodos de produção da enzima fitase na utilização em dietas de poedeiras.
Métodos de produção e principais microrganismos
Existem dois tipos de fitase segundo a União Internacional de Biologia Molecular. Esses variam em função da hidrolise do éster, de tal maneira que uma causa a hidrolise na posição 3, a mioinositol hexaquifosfato-3-fosforohidrolase e a outra na posição 6, a mioinositol hexaquifosfato-6-fosforohidrolase. Ambos os tipos de fitase hidrolisam o fitato em mioinositol e ácido ortofosfato, esse último segundo Pandey et al (2001) é fundamental no processo metabólico na biossíntese celular.

Basicamente existem dois processos de obtenção de fitase mais usados atualmente, o método de fermentação em estado sólido (SSF) (Figura 1) e a fermentação submersa (SmF). As condições da cultura, concentração, natureza do substrato e a disponibilidade dos nutrientes são fatores que devem ser considerados na escolha da técnica a ser utilizada na produção de fitase, segundo Vats et al (2004). A produção de enzimas utilizadas na nutrição animal como amilases, celulases e fitases são amplamente realizadas pelo método de fermentação em estado sólido (Bogar et al., 2003).
A produção de fitase pelo Aspergillus ficumm (AF) NRRL 3135 tem sido bem estudada nos diferentes métodos de produção, seja nas fermentações no estado sólido por Ebune et al (1995), semi-sólido por Han et al (1987) e pelo método da submersão por Howson et al (1983) e por Ullah et al (1987). Ebune et al (1995) estudaram a fitase produzida pelo A. ficumm usando óleo de canola e verificaram que o tempo de inoculação teve profundo impacto na síntese enzimática. Segundo Bogar et al (2003) existe no mercado fitases produzidas pelo A. niger e pelo A. ficumm pelo método de fermentação submersa, contudo segundo os autores é uma técnica que, com esses microrganismos, torna-se pouco interessante economicamente e, segundo Pandey et al (1999) uma alternativa à produção de fitase por esses seria pelo método da fermentação em estado sólido.
A fitase pode ser produzida diretamente pelo método de fermentação em estado sólido (SSF) por fungos filamentosos em ingredientes bem selecionados e o produto cru dessa fermentação pode ser utilizado nas rações de aves atuando como um suplemento enriquecedor da dieta (Bogar et al., 2003). O produto da fermentação pelo fungo não contém apenas fitase, mas outras várias enzimas acessórias e, a proteína e os ácidos orgânicos produzidos podem também melhorar a digestibilidade pois podem atuar sobre as células dos vegetais que contém o fitato (Papagiani et al., 1999; Mandviwala et al.,2000; Pandey et al., 2001).
Kleist et al (2003) estudaram a produção de fitase pela E. coli com glicose como substrato e um nível médio de oxigênio geralmente utilizado nesses testes. Os autores verificaram que o rápido consumo da glicose fez baixar o nível de oxigênio, entre 5 e 10%, resultando em um aumento da atividade enzimática (120 U/ml) em um pequeno espaço de tempo. Kim et al (1999) estudaram a produção de fitase pelo Aspergillus sp. 5990 usando o método SmF (fermentação submersa) a 37°C, pH neutro, e verificaram que houve uma alta atividade enzimática no liquido da cultura, enquanto Papagianni et al (2000) estudaram a qualidade na relação entre a composição média, morfologia e produção de fitase pelo Aspergillus niger (Figura 2) nos dois métodos de fermentação.
Bogar et al (2003) avaliando a produção de fitase pelo Mucor racemosus pelo método se fermentação do estado solido, verificaram que os melhores resultados dessa produção foi vista em uma umidade de 71%, pH de 5,5 e uma temperatura de incubação de 25°C. A produção quase dobrou com a suplementação de fontes de carbono e nitrogênio, passando de 14,5 IU/g MS para 26 IU/g MS, mostrando que a qualidade das fontes de carbono e de nitrogênio utilizadas na produção de fitase são pontos críticos e de extrema importância econômica. Os autores concluíram que a fermentação em estado solido é um processo mais eficiente que o da fermentação submersa e menos oneroso e ainda é mais aplicável à suplementação de fitase nas dietas de aves.
A presença de enzimas acessórios no produto da SSF proporciona um realce no que concerne à digestibilidade do alimento e ainda sobre o acesso a molécula do fitato, que se torna mais facilitada à sua hidrólise. Portanto o método de fermentação em estado sólido torna a produção de fitase mais competitiva economicamente, pois torna a fitase mais eficiente na degradação do fitato, melhorando assim o benefício gerado pela adição dessa enzima nas rações de aves.
Todos os processos de produção da fitase são amplamente controlados e não apresentam qualquer risco para as aves e aos humanos que consumirem carne e ovos. O número de pesquisas nesse contexto proporciona confiabilidade nos dados e garantem a utilização de enzimas na dieta de aves.
Fitase na dieta de poedeiras
Grande parte do fósforo presente nos vegetais utilizados na ração das poedeiras está indisponível às aves, por estarem complexados na forma de fitato e que segundo Silva et al (2008) o fitato pode afetar a digestibilidade de minerais e aminoácidos.
Em aves de postura, as necessidades de fósforo aumentam na fase de produção, em virtude da alta demanda de cálcio para sintetizar a casca dos ovos onde o fósforo também é mobilizado. (RUSH et al., 2005). Segundo Wu et al (2006) a deficiência de fósforo reduz o consumo de ração, produção, peso e massa dos ovos em poedeiras. A adequação dos níveis ideais de fósforo nas dietas é deve ser extremamente cuidadosa, pois facilmente é atingido o excesso ou a sua deficiência. Como as aves não sintetizam em suficiência a fitase para degradar o fitato, os produtores são obrigados a suplementarem com P inorgânico, e a inclusão em níveis elevados torna-se um problema ainda maior, pois todo o excesso é excretado tornando um poluente de rios, lagos e córregos, além de piorar a resistência da casca dos ovos, pois segundo Wu et al (2006) a gravidade específica é reduzida.
Uma das maneiras mais eficientes em se prevenir os efeitos provocados pelo excesso ou falta de P nas dietas de aves é a suplementação com fitase microbiana. Segundo Fireman et al (1998) desde 1968 a fitase tem atraído a atenção dos nutricionistas, e alguns artigos foram publicados, indicando que a disponibilidade de P fítico pode ser significativamente melhorada com a adição de fitase nas dietas de aves. Entretanto nem todo o P é liberado pela fitase e sua eficiência é reduzida quando se eleva a sua atividade na ração.
Recentemente Lima et al (2008) avaliaram a redução nutricional de dietas para poedeiras associadas ou não com fitase. Os autores reduziram de forma progressiva os níveis de proteína bruta, energia metabolizável, cálcio e fósforo disponível dos níveis recomendados por Rostagno et al (2005) (17% de PB; 2900 kcal de EM; 4,2% de Ca e 0,375% de fósforo disponível) até os níveis de 13% de PB; 2700 kcal de EM; 3,0% de Ca e 0,18% de fósforo disponível. Cada dieta com redução nutricional era suplementada com 0,03% de fitase microbiana, de forma que cada dieta tivesse ou não a enzima. Após tabulação e análise dos dados, os autores verificaram que a redução dos níveis nutricionais da dieta para 15% de PB, 2800 kcal/kg de EM, 3,8% de Ca e 0,28% de Pd não influenciaram negativamente o desempenho das aves, em relação à produção diária de ovos, entretanto as maiores reduções proporcionaram prejuízos às aves. Contudo a adição de 0,03% de fitase nas dietas promoveu uma melhor produção e massa de ovos das poedeiras. (Figura 3).
Recentemente Lima et al (2008) avaliaram a redução nutricional de dietas para poedeiras associadas ou não com fitase. Os autores reduziram de forma progressiva os níveis de proteína bruta, energia metabolizável, cálcio e fósforo disponível dos níveis recomendados por Rostagno et al (2005) (17% de PB; 2900 kcal de EM; 4,2% de Ca e 0,375% de fósforo disponível) até os níveis de 13% de PB; 2700 kcal de EM; 3,0% de Ca e 0,18% de fósforo disponível. Cada dieta com redução nutricional era suplementada com 0,03% de fitase microbiana, de forma que cada dieta tivesse ou não a enzima. Após tabulação e análise dos dados, os autores verificaram que a redução dos níveis nutricionais da dieta para 15% de PB, 2800 kcal/kg de EM, 3,8% de Ca e 0,28% de Pd não influenciaram negativamente o desempenho das aves, em relação à produção diária de ovos, entretanto as maiores reduções proporcionaram prejuízos às aves. Contudo a adição de 0,03% de fitase nas dietas promoveu uma melhor produção e massa de ovos das poedeiras. (Figura 3).
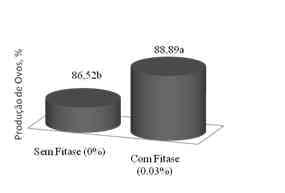
Adaptado de Lima et al (2008) - Figura 3. Efeito da fitase sobre a produção de ovos das poedeiras
Rações à base de milho e farelo de soja contendo 0,15% de fósforo disponível ou 0,10% de Pd suplementada com 300 UI de fitase proporcionam uma ótima produção de ovos em poedeiras com idade entre 20 e 70 semanas de vida, segundo Bolin et al (2000). Costa et al (2004) avaliando níveis de fósforo disponível e de fitase na dieta de poedeiras de ovos de casca marrons, verificaram que a medida que se aumentava a inclusão da enzima, a conversão alimentar por massa de ovos era reduzida (Y= 2,11172 -4,13333X; r²=0,88), passando de 2,10 para 2,02, para a dieta sem fitase e a dieta com 0,02% de fitase na dieta, respectivamente. Os autores concluíram que o nível recomendado de fitase nas rações das poedeiras de ovos marrons é de 0,02% e 0,235% de fósforo disponível. Comparando os resultados obtidos por Costa et al (2004) com as recomendações de Rostagno et al (2005) podemos notar que a recomendação pode ser reduzida quando a adição de fitase na dieta de poedeiras é realizada, de maneira que essa redução representa cerca de 37% no nível de fósforo disponível.
Portanto a produção de poedeiras pode ser amplamente melhorada com a adição de fitase nas dietas dessas aves, que por natureza própria tem fezes mais aquosas facilitando uma maior poluição ambiental e, como vimos à excreção pode ser atenuada, pois a digestibilidade aumenta e a necessidade de inclusão de P inorgânico é reduzida conseqüentemente.
Resultados experimentais
Recentemente vários estudos têm demonstrado a aplicação convencional da fitase na melhora na digestão da energia e dos aminoácidos em frangos de corte (Rutherfurd, et al., 2004; Cowieson et al., 2006). Entretanto são ainda escassos os dados referentes às galinhas de postura, onde é comum ocorrer discrepância em alguns resultados.
A eficácia da fitase na digestibilidade de cálcio de fósforo para poedeiras alimentadas com dietas à base de milho e farelo de soja tem sido bem estabelecido por Van der Klis et al (1997), Lim et al (2003), Panda et al (2005) e Wu et al (2006). Outro fator interessante à respeito da digestibilidade foi relatado por Jalal et al (1999) quando comentaram que a fitase melhora significativamente a digestibilidade de metionina, cistina, alanina e glutamina, contudo Snow et al (2003) não encontraram diferenças na digestibilidade dos aminoácidos em poedeiras de 78 a 81 semanas de idade.
Avaliando as interações entre Pd e da fitase sobre o desempenho, P no plasma e os parâmetros ósseos de poedeiras, Silva et al (2008) concluíram que as poedeiras exigem 0,31 a 0,34% de fósforo disponível dietético e associado à 300 unidades de fitase, os efeitos positivos surgem sobre a conversão alimentar por massa de ovos, sobre o P plasmático, cinzas na tíbia e ainda na resistência óssea. Esses resultados encontrados são semelhantes aos encontrados por Wu et al (2006) quando constataram que a fitase na dieta de poedeiras com 21 a 33 semanas de idade tiveram uma conversão por massa de ovos melhorada.
Em estudo semelhante Silva et al (2008) avaliaram as relações de cálcio:fósforo disponível sobre níveis de fitase na dieta de poedeiras no primeiro e segundo ciclos de postura, concluíram que a melhor relação Ca:Pd encontrada no primeiro ciclo de postura sem a inclusão de fitase foi de 14: 1 (4,2%Ca : 0,3% Pd), contudo com a fitase essa relação teve um decréscimo para 12:1 (3,5%Ca: 0,3%Pd). Já para as poedeiras no segundo ciclo de produção, os autores recomendaram 4,2% de Ca e 0,38% de Pd nas rações e que a suplementação de fitase (600 UI) nos níveis mais baixos de Pd, melhorou a conversão por massa e por dúzia e o peso dos ovos. Os resultados encontrados por Silva et al (2008) foram verificados também por Wu et al (2006), quando verificaram a redução do P nas excretas.
Esses resultados encontrados pelos autores acima demonstram a capacidade de melhora na digestibilidade dos nutrientes, principalmente de minerais, que a fitase proporciona às aves que se alimentam com rações que a contém em sua formulação. Atualmente a grande procura por melhoria nos lucros com conseqüente redução dos custos, vem aliada a tendência de redução dos impactos ao ambiente que a avicultura de postura gera. Estudos realizados por instituições idôneas de extremo respeito pelos pesquisadores e produtores vêm obtendo resultados que promovem a fitase como grande aliada da cadeia produtiva da produção de ovos e amiga do meio ambiente. A redução nos níveis de inclusão de minerais como o fósforo são possíveis, possibilitando uma atenuação dos impactos ambientais já que a extração do minério e a excreção pelas aves pelos excessos usados nas dietas são amplamente reduzidas.
Considerações Finais
O desenvolvimento da biologia molecular pode aumentar ainda mais a eficácia da enzima fitase, como reduzir a acumulação de fitato nas plantas, assim como possibilitar que plantas e animais tenham uma síntese endógena de fitase acentuada.
Pesquisas com aves comprovam a eficiência da fitase na melhoria da digestibilidade dos aminoácidos e de uma melhor utilização da proteína de forma a melhorar à qualidade dos produtos e subprodutos oriundos da atividade avícola.
Referências
AL-ASHEH, S., DUVNJAK, Z. Phytase production and decrease of phytic acid content in canola-meal by Aspergillus-Carbonarius in solid-state fermentation. World Journal of Microbiology and Biotechnology 11 (2), 228±231. ., 1995
BOGAR, B.; SZAKACS, G.; PANDEY, A.; ABDULHAMEED, S.; LINDEN, J. C.; TENGERDY, R. P. Production of Phytase by Mucor racemosus in Solid-State Fermentation. Biotechnol. Prog.v.19, 312319,2003.
BOLING, S.D.; DOUGLAS, M.W.; JONSON, M.L. et al. The effects of dietary available phosphorus levels and phytase on performance of young and older laying hens. Poultry Science, v. 79, n. 2, p. 224- 230, 2000
COSTA, F. G. P.; JACOME, I. M. T. D.; SILVA, J. H. V.; CAMPOS, K. M. F. et al. Níveis de fósforo disponível e de fitase na dieta de poedeiras de ovos de casca marrom. Ciência Animal Brasileira v. 5, n. 2, p. 73-81, abr./jun. 2004.
COWIESON, A. J., T. ACAMOVIC, AND M. R. BEDFORD. Supplementation of corn-soy-based diets with an Escherichia coliderived phytase: Effects on broiler chick performance and the digestibility of amino acids and metabolizability of minerals and energy. Poultry Science. 85:1389-1397, 2006.
EBUNE, A.; AL-ASHEH, S.; DUVNJAK, Z. Production of phytase during solid-state fermentation using Aspergillus ficuum NRRL 3135 in canola meal. Bioresource. Technology.53, 7-12, 1995.
FIREMAN, A. K. B. A. T.; FIREMAN, F. A . T. Fitase na alimentação de poedeiras. Ciência Rural, Santa Maria, v.28, n.3, p.529-534, 1998.
HAN, Y.W., GALLAGHER, D.J., WILFRED, A.G. Phytase production by Aspergillus-®cuum on semisolid substrate. Journal of Industrial Microbiology 2 (4), 195±200, 1987.
HOWSON SJ, DAVIS RP. Production of phytate-hydrolyzing enzyme by some fungi. Enzyme Microbiology Technology 5:377-82, 1983.
JALAL, M. A., S. E. SCHEIDELER, AND C. WYATT. Effects of phytase supplementation on egg production parameters and amino acid digestibilities. Poultry Science. 78(Suppl.1):74. (Abstr.), 1999.
KIM YO, LEE JK, OH BC, OH TK. High-level expression of a recombinant thermostable phytase in Bacillus subtilis. Bioscience Biotechnology Biochemical;63:2205-7, 1999.
KLEIST S, MIKSCH G, HITZMANN B, ARNDT M, FRIEHS K, FLASCHEL E. Optimization of the extracellular production of a bacterial phytase with Escherichia coli by using different fed-batch fermentation strategies. Applied Microbilogy Biotechnology. 61:456-62, 2003.
LEHNINGER, A.L. Princípios da Bioquímica. São Paulo: Sarvie, 1994.
LIM, H. S., H. NAMKUNG, AND I. K. PAIK. Effects of phytase supplementation on the performance, egg quality, and phosphorous excretion of laying hens fed different levels of dietary calcium and nonphytate phosphorous. Poultry Science. 82:92-99, 2003.
MANDVIWALA, T. N.; KHIRE, J. M. Production of high activity thermostable phytase from thermotolerant Aspergillus niger in solid-state fermentation. Journal Industry Microbiology Biotechnology.24, 237-243, 2000.
PANDA, A. K., S. V. R. RAO, M. V. L. N. RAJU, AND S. K. BHANJA. Effect of microbial phytase on production performance of White Leghorn layers fed on a diet low in non-phytate phosphorus. Bristh Poultry Science. 46:464-469, 2005.
PANDEY, A.; SELVAKUMAR, P.; SOCCOL, C. R.; NIGAM, P. Solidstate fermentation for the production of industrial enzymes. Curr. Sci.77, 149-162, 1999.
PANDEY, A.; SZAKACS, G.; SOCCOL, C. R.; RODRIGUEZ-LEON, J. A.; SOCCOL, V. T. Production, purification and properties of microbial phytases. Bioresource Technology. 77(3), 203-214, 2001.
PAPAGIANNI M, NOKES SE, FILER K. Production of phytase by Aspergillus niger in submerged and solid state fermentation. Proc Biochem.35:397-402, 2000.
ROSTAGNO, H.S.; ALBINO, L.F.T.; DONZELE, J.L. et al. Tabelas brasileiras de exigências nutricionais para aves e suínos (Composição de alimentos e exigências nutricionais). UFV. 2005. 141p.
RUSH, J. K., et al. Effect of dietary calcium and vitamin d3 on calcium and phosphorus retention in white pekin ducklings, in Poultry Science Association, Inc, 2005
RUTHERFURD, S. M., T. K. CHUNG, P. C. MOREL, AND P. J. MOUGHAN. Effect of microbial phytase on ileal digestibility of phytate phosphorus, total phosphorus, and amino acids in a lowphosphorus diet for broilers. Poultry Science. 83:61-68, 2004.
SNOW, J. L., M. W. DOUGLAS, AND C. M. PARSONS. Phytase effects on amino acid digestibility in molted laying hens. Poultry Science. 82:474-477, 2003.
ULLAH, A.H.J., CUMMINS, B.J. Immobilization of Aspergillus- ®cuum extra-cellular phytase on fractogel. Biotechnology And Applied Biochemistry 9 (5), 380±388, 1987.
VAN DER KLIS, J. D., H. A. VERSTEEGH, P. C. SIMONS, AND A. K. KIES. The efficacy of phytase in corn-soybean meal based diets for laying hens. Poultry Science. 76:1535-1542, 1997.
VATS, P.; BANERJEE, U. C.; Production studies and catalytic properties of phytases (myo-inositolhexakisphosphate phosphohydrolases): an overview. Enzyme and Microbial Technology 35 (2004) 3-14.
WU, G., Z. LIU, M. M. BRYANT, AND D. A. ROLAND, SR. Comparison of Natuphos and Phyzyme as phytase sources for commercial layers fed corn-soy diet. Poultry Science. 85:64-69, 2006.
YI, Z.; KONERGAY, E. T.; RAVINDRAN, V.; DENBOW, D. M. Improving phytase phosphorus availability in corn and soybean meal for broilers using microbial phytase and calculating of phosphorus equivalency values for phytase. Poultry Science, v.75, p.240-249, 1996.
Tópicos relacionados:
Autores:
UFERSA
Recomendar
Comentário
Compartilhar
21 de junio de 2011
sou veterinario e trato de varios lote de poedeiras.
o nivel de ca-Pd e 3,8-0,5 com fitase e sertos lotes de poedeiras sofrem de falta de calcio - ossos quebraveis e com acrescimos de ca-Pd 4,5-0.65 e Hy D por periodo de 30 duas resolve o problema com a condoção de que a poedeira come 115-120 gramas de ração diaria ao contrario do que escreveste
Henrique Marcos Borochovitz
Recomendar
Responder

Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.







.jpg&w=3840&q=75)