A modernização da indústria avícola durante os últimos anos tem conduzido a produção de aves, que são cada vez mais eficientes em converter ração em carne. O progresso das linhagens modernas de frangos de corte é o resultado de anos de desenvolvimento e pesquisa no campo genético, melhor manejo nutricional e melhorias das condições ambientais e sanitárias.
A composição da microbiota das aves é influenciada desde o incubatório. Na produção comercial, os pintinhos eclodem em um ambiente controlado, com baixa carga microbiana e longe de suas mães, o que faz com que não tenham um contato natural com sua microbiota de origem. Por outro lado, as aves criadas em condição não comercial e ou selvagens são expostas desde cedo à microbiota naturalmente vinda de seus progenitores e do ambiente deles. Nesta situação, as bactérias benéficas conseguem colonizar o intestino imediatamente após a eclosão. Uma vez que os pintinhos produzidos comercialmente não têm este contato, são mais susceptíveis a todos os tipos de colonização microbiana o que pode levar a contaminação do trato digestivo com bactérias potencialmente patogênicas. Uma vez que as bactérias patogênicas colonizam o intestino, a digestão e o crescimento podem ser prejudicados. Nesta situação, sem o uso de aditivos que previnam a colonização do intestino por estes patógenos, temos um maior desafio em produzir de forma economicamente eficiente.
A prática comum sempre foi o uso de antibióticos melhoradores de desempenho, continuamente usados em doses sub terapêuticas. Sua aplicação na produção animal acontece desde a década de 50, quando pesquisadores na época constataram que os mesmos promoviam um melhor crescimento e eficiência produtiva (Castanon, 2007). O efeito positivo dos antibióticos melhoradores de desempenho na ração está relacionado principalmente ao fato de atuarem sobre a prevenção da colonização de patógenos no intestino, o que permite uma maior disponibilidade de nutrientes para o crescimento e a deposição muscular, ao invés de serem utilizados para ativação do sistema imune.
Diante dos achados feitos pela comunidade científica que certas cepas bacterianas podem se tornar resistentes aos antibióticos e que o uso contínuo destas moléculas pode conduzir ao desenvolvimento e disseminação de bactérias patogênicas resistentes, razão pela qual diversos países tem restringido e/ou banido o uso de antibióticos como promotores de crescimento nas dietas dos animais, mitigando assim riscos para à saúde animal e humana.
Desde o banimento feito pela União Europeia em 2006, vários produtos alternativos aos antibióticos vêm sendo estudados no intuito de promoverem uma boa microbiota. Os probióticos em ração e/ou água tem sido uma opção altamente popular na substituição dos antibióticos melhoradores de desempenho. São definidos como produtos que contém cepas vivas que atuam sobre o animal de forma benéfica melhorando o balanço intestinal, o que promoverá uma melhoria no desempenho e a prevenção de patógenos entéricos. Como consequência disto vemos uma enorme lista de opções no mercado, compostos por uma única ou múltiplas cepas e com uma variedade de benefícios e mecanismos de ação para o hospedeiro, incluindo o controle de patógenos.
A definição de probiótico amplamente aceita e usada pela comunidade científica foi dada pela FAO (Organização de Alimentos e Agricultura das Nações Unidas) em 2001, definindo os probióticos como microrganismos vivos que quando administrado em quantidades adequadas confere benefícios à saúde do hospedeiro (Hill et al., 2014). As bactérias são os microrganismos mais comumente usados como probióticos, entretanto leveduras e fungos também podem ser utilizados para esse fim.
Um bom probiótico inclui sua capacidade de exercer um efeito benéfico sobre o animal e, claro, a cepa não pode exercer um efeito patogênico ou produzir toxinas que prejudiquem seu hospedeiro. Um sistemático e bastante restritivo processo de seleção deve ser feito para que a cepa ideal seja selecionada e assim atenda às necessidades do mercado, bem como seus requerimentos e especificações regulatórias. Os parâmetros que são fundamentalmente importantes de serem avaliados no processo de seleção da cepa são:
- Estabilidade ao calor
- Resistência a pH baixo, como o da moela
- Tolerância à bile
- Crescimento na presença de ácidos graxos de cadeia curta
- Produção de enzimas
- Inibição de patógenos
- Expressão de metabólitos secundários
- Sensibilidade aos antibióticos
- Ausência de genes de resistência aos antibióticos e de produção de toxinas.
Como exemplo deste processo investigativo temos neste estudo a avalição do mecanismo de Quorum quenching (QQ) da cepa CECT 5940 do Bacillus amyloliquefaciens, a qual tem capacidade inerente de produzir uma ampla gama de metabólitos secundários que comprovadamente interagem com diferentes populações bacterianas.
Quorum sensing (QS) é um sistema de comunicação entre células bacterianas baseado na produção e na secreção de moléculas sinalizadoras chamadas autoindutores, que se acumulam no ambiente extracelular quando é atingida alta densidade de células bacterianas (Fuqua et al., 1994). Ao atingir um limiar de concentração intracelular de autoindutores, a molécula sinalizadora desencadeia a expressão sincronizada de múltiplos genes na população, regulando assim funções biológicas importantes, como a transferência de plasmídeos, motilidade, agregação, luminescência, biossíntese de antibióticos e virulência (Swift et al., 2001; Waters e Bassler, 2005; Williams et al, 2007). Os autoindutores tipo 1 melhor caracterizados são as N-acil-homoserina lactonas (AHLs), uma família de moléculas formadas por um anel de homoserina lactona (HSL) N-acilado com um grupamento graxo acil na posição alfa. Os mecanismos que levam à inativação do sistema de comunicação QS são geralmente chamados de Quorum Quenching (QQ) (Dong et al., 2001, 2007), embora alguns autores prefiram restringir o termo à degradação enzimática dos sinais da AHL (Kjelleberg et al., 2008). Um dos possíveis mecanismos de ação dos probióticos é o QQ, bloqueando a comunicação (isto é, o quorum sensing) entre bactérias patogênicas, evitando assim o seu crescimento, a formação de biofilmes e a expressão de virulência.
Materiais e Métodos
Cepas utilizadas
Probiótico: Bacillus amyloliquefaciens CECT 5940
Biossensor: Chromobacterium violaceum CECT 5999 (CV026) (McClean et al., 1997)
A cepa selvagem da espécie Chromobacterium violaceum produz um pigmento violeta (violaceína) e sua produção é regulada via QS. A cepa utilizada no estudo foi um mutante desta espécie que perdeu sua capacidade inerente de produzir o pigmento violeta e, por isso, é chamado de mutante branco (CV026). Entretanto, este mutante pode ser induzido a produzir violaceína através da aplicação de AHLs no meio de cultura.
Homoserinas lactonas sintéticas (compostos comerciais análogos às AHLs):
- C6-HSL: N-hexanoil-L-homoserina lactona (Sigma-Aldrich 09926)
- C8-HSL: N-octanoil-L-homoserina lactona (Sigma-Aldrich 10940)
Estes compostos (indutores) foram preparados como soluções-mãe em água destilada estéril a uma concentração de 1 mg/ml para C6-HSL e a 0,7 mg/ml para C8-HSL.
Triagem de Quorum Quenching (Florez et al., 2014):
Crescimento de Bacillus amyloliquefaciens CECT 5940 com análogos:
O Bacillus amyloliquefaciens CECT 5940 foi incubado por 24 h a 30°C em meio LB (Luria Bertani) em frascos de 250 mL com 50 mL de meio de cultura. Este pré-inóculo foi utilizado para inocular um novo frasco com 25 mL de LB a fim de manter uma OD600 de aproximadamente 1,1. Os análogos de AHLs (autoindutores), C6-HSL ou C8-HSL, foram adicionados ao meio de cultura a uma concentração final de 4 µg/mL e incubados a 30°C com agitação. Foram coletadas amostras em diferentes intervalos: 0 (imediatamente após a adição do indutor) e em 1, 2, 4, 6 e 24 horas. As amostras coletadas foram individualmente centrifugadas a 3000 rpm por 10 minutos para remover detritos celulares. O sobrenadante foi recuperado após centrifugação.
Ensaio de Detecção:
As placas de ágar LB foram recobertas com 4 mL de LB a 0,8% contendo 1 mL da cultura do indicador C. violaceum em LB com 25 μg/mL de Canamicina. As placas permaneceram em repouso até a solidificação do meio de cultura. Após a solidificação do meio foram preparados poços de 6 mm nas placas, para posterior inoculação com pipetador e ponteiras estéreis de 50 μL das diferentes amostras do sobrenadante da incubação do B. amyloliquefaciens CECT 5940 com os indutores, coletadas em intervalos crescentes de tempo (0, 1, 2, 4, 6, e, 24 horas). As placas foram então incubadas a 30°C por 24 h para permitir o crescimento do microrganismo indicador.
Controles e Interpretação de Resultados:
Poços com halos violeta indicaram que o QS foi bem-sucedido e não houve QQ. Onde houve atividade de QQ nas amostras adicionadas aos diferentes poços, os halos eram opacos e incolores, embora o indutor estivesse presente.
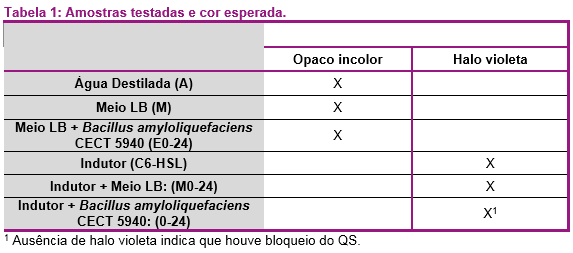
No ensaio de detecção, foram utilizados os controles descritos abaixo e a Tabela 1 detalha a cor esperada no teste e a nomenclatura utilizada nas placas (entre parênteses).
- Halo opaco incolor (ausência de indutor)
- Água destilada estéril (A). Halo opaco incolor porque o mutante é branco e não há molécula de indutor.
-Meio de cultura LB estéril (M). Halo opaco incolor, porque não há indução.
-Meio de Cultura LB + probiótico (sem indutor). As culturas de probiótico são incubadas pelo mesmo número de horas que o probiótico teste com as amostras de moléculas dos indutores C6-HSL ou C8-HSL e utilizadas como controle para verificar se o probiótico produz compostos que estimulam a produção de violaceína, causando resultado falso negativo. Espera-se esses controles tenham halo opaco incolor. São rotulados com um “E”, seguido do tempo de incubação em horas (Exhoras)
- Halo violeta (presença do indutor)
-Moléculas indutoras (C6-HSL ou C8-HSL). Espera-se que o halo seja violeta porque estes compostos são indutores de violaceína.
-Meio de cultura LB + C6-HSL ou C8-HSL. Essas culturas são incubadas pelo mesmo número de horas que o probiótico teste com C6-HSL ou C8-HSL a fim de verificar a degradação do indutor ao longo do tempo na ausência do microrganismo. Espera-se que esses controles tenham halos violetas. São rotulados com um “M” seguido do tempo de incubação em horas (Mxhoras)
As amostras de teste (molécula de indutor + probiótico) são rotuladas apenas com o número de horas de incubação: 0, 1, 2, 4, 6, 24. Como o indutor está presente, espera-se que o halo seja violeta e a ausência deste pigmento indica que o QS foi bloqueado por um mecanismo de QQ.
Resultados e Discussão
O ensaio realizado permitiu a clara visualização da capacidade de um composto bloquear a indução de QS pela inibição da produção de violaceína.
Foram analisados os efeitos dos sobrenadantes do cultivo do probiótico
B. amyloliquefaciens CECT 5940, na presença de indutores C6-HSL e C8-HSL
[TV1] em diferentes tempos de incubação.
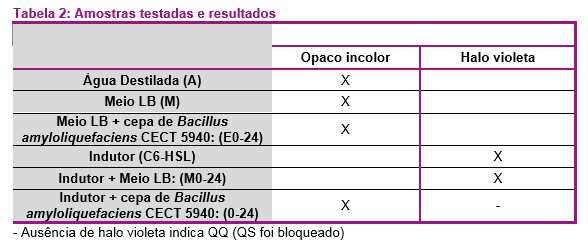
Os poços com água (A), meio de cultura (M) ou meio de cultura apenas com a cepa de B. amyloliquefaciens CECT 5940 (E0-24 horas) não produziram pigmento (Figura 1). Isto era esperado, uma vez que esses poços não continham o indutor C6-HSL ou C8-HSL, e a cepa mutante de C. violaceum, isoladamente, não produz qualquer composto que estimule a produção de violaceína.
Quando o inóculo com o indutor C6-HSL foi adicionado aos poços e incubado por 24 horas (M0-24), foi observado halo pigmentado em todos os poços (Figura 1). Isso sugere que o indutor C6-HSL não se degrada ao longo do tempo, porque o halo de violaceína foi observado mesmo após 24 horas de incubação.
Nos poços onde foi inoculado o meio de cultura com a cepa de B. amyloliquefaciens CECT 5940 e o indutor C6-HSL (0-24), o halo pigmentado foi observado nas amostras com tempo de incubação de até 6 horas, demonstrando que o C6-HSL estava presente e estimulou a produção de violaceína. No entanto, após 24 horas de incubação do indutor C6-HSL ou C8-HSL com o B. amyloliquefaciens CECT 5940, o pigmento já não foi observado, indicando que a cepa probiótica impediu a produção de violaceína e, portanto, teve a atividade de QQ.
O ensaio foi repetido usando C8-HSL como indutor e os mesmos resultados foram obtidos.
Os resultados deste estudo demonstram a atividade de QQ do B. amyloliquefaciens CECT 5940 sobre o C. violaceum CECT 5999(CV026), usando C6-HSL ou C8-HSL como substrato.