Fumonisinas Alimentos Implicações Saúde
Fumonisinas: presença em alimentos, implicações na saúde e aspectos legislativos
Publicado: 30 de julho de 2009
Por: Celeste M. Lino, Liliana J. G. Silva, Angelina S. Pena. Centro de Estudos Farmacêuticos - Grupo de Bromatologia, Faculdade de Farmácia, Universidade de Coimbra, 3000-295 Coimbra, Portugal
Introdução
As micotoxinas, metabolitos fúngicos secundários presentes numa grande parte de alimentos, além de provocarem grandes perdas económicas para os produtores de cereais e processadores de alimentos, representam um sério risco para a saúde humana e animal. A microflora está estimada entre 200.000 e 300.000 espécies, tendo sido identificadas mais de 400 micotoxinas.
A produção mundial anual de cereais excede os 160 kg per capita, com tendência para aumentar, mas estima- se que cerca de 10 a 30% dos grãos colhidos se percam por infecções promovidas pelo desenvolvimento de fungos. A FAO/WHO (Food and Agriculture Organization of the United Nations/World Health Organization) estima que, em todo o mundo, cerca de 25% das colheitas de alimentos estão afectadas por micotoxinas (Cirillo et al., 2003).
Cinco tipos de micotoxinas são considerados económica e toxicologicamente importantes: aflatoxinas (AFs), ocratoxina A (OTA), tricotecenos (desoxinivalenol (DON), nivalenol (NIV) e HT2-toxina (HT-2)), zearalenona (ZEA) e fumonisinas (FB1, FB2) (Charmley et al., 1994).
As fumonisinas são produzidas por espécies do género Fusarium (Charmely et al., 1994). Os membros pertencentes a este género são economicamente importantes uma vez que são fungos patogénicos para plantas, causando, todos os anos, vastos prejuízos, nomeadamente em culturas de milho e de sorgo (Jurgenson et al., 2002). O interesse sobre as fumonisinas tem aumentado e, a nível mundial, continuam a realizar-se investigações para melhor as conhecer, bem como aos prejuízos por elas provocados. Este grande interesse deve-se a duas razões fundamentais: ao facto das fumonisinas se encontrarem em concentrações mensuráveis no milho e ao facto de estudos epidemiológicos realizados as associarem ao cancro esofágico (EC) em humanos (Fumonisins Page).
A produção de fumonisinas está restringida a duas espécies da secção Liseola (uma secção separa espécies dum género grande em unidades mais pequenas com características semelhantes) (Thiel et al., 1991). As espécies de Fusarium produtoras de fumonisinas são o Fusarium verticillioides (Sacc.) Nirenberg (sinónimo de Fusarium moniliforme Sheldon, teleomorfo Giberella moniliformes, sinónimo Giberella fujikuroi) (Woloshuk e Shim, 2001) e o Fusarium proliferatum (T. Matsushima) Nirenberg. Ambas as espécies são isoladas no milho, sendo a primeira a mais prevalente (Scott e Lawrence, 1995).
1. Características fisico-químicas
As fumonisinas B1 (FB1) e B2 (FB2) foram isoladas de culturas de Fusarium moniliforme MRC 826 por Gelderblom et al., investigadores do South African Medical Research Council, em 1988 (Gelderblom et al., 1988; Shephard et al., 2000; Nelson et al., 1993; Fumonisins Page). Vinte anos de investigação na possível causa para a elevada incidência de EC na região de Transkei (África do Sul) culminaram com esta descoberta (Nelson et al., 1993).
Em 1998 Bezuidenhout et al. elucidaram a estrutura das FB1 e FB2 . No curto espaço de tempo entre a descoberta destas micotoxinas e a ocorrência de epidemias, como a leucoencefalomalacia (ELEM) e edema pulmonar (PPE) em cavalos e porcos, observou-se uma explosão no seu estudo, bem como no estudo de Fusarium spp. (Fumonisins Page).
Existem diferentes séries de fumonisinas, estruturalmente relacionadas: A (A1- A4), B (B1- B4), C (C1- C4, seguindo-se a FB2 e a FB3 (Labuda et al., 2003), sendo também considerada a mais tóxica.
A FB1, segundo Bezuidenhout et al. (1988), é um diéster de propano-1,2,3-ácido tricarboxílico e 2S-amino- 12S,16R-dimetilo-3S,5R,10R,14S,15R-pentahidroxieicoisano, em que os grupos hidroxilos em C14 e C15 estão esterificados com um grupo carboxilo terminal do ácido tricarboxílico (Sydenham et al., 1995; Kim et al., 2003). As FB2-B4 apresentam padrões diferentes de hidroxilação (Figura 1).
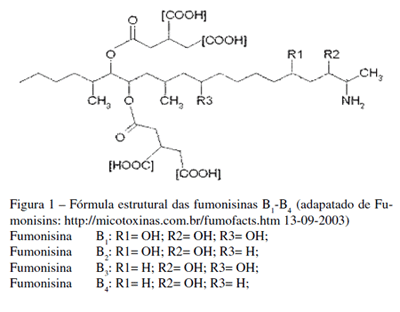
A FB2 não possui o grupo hidroxilo em C10, enquanto que a FB3 não apresenta o grupo hidroxilo em C5. Algumas amostras de milho também possuem FB4 verificando- se, neste caso, a ausência de grupos hidroxilos em ambos os carbonos (C5 e C10) (Seo e Lee, 1999).
As fumonisinas da série A são n-acetiladas e ocorrem apenas em pequenas concentrações (Nelson et al., 1993). A série C é quimicamente semelhante à série B, com a excepção de não possuir o grupo metilo terminal em C1 (Seo e Lee, 1999).
A ocorrência natural de FA1, FB4 e da série C nunca foi referida (Seo e Lee, 1999). Segundo Plattner et al., (1992) as fumonisinas da série A podem ser artefactos criados durante o isolamento inicial das fumonisinas. A quantidade de fumonisinas hidrolisadas (HFBs) e parcialmente hidrolisadas (PHFBs) em milho naturalmente contaminado é bastante inferior relativamente à quantidade de fumonisinas intactas. As fumonisinas hidrolisadas não apresentam os dois grupos de ácido tricarboxílico que nas fumonisinas intactas se encontram esterificados em C14 e C15; as fumonisinas parcialmente hidrolisadas apresentam apenas um grupo de ácido tricarboxílico. Os métodos utilizados nos processos de fabrico de produtos derivados do milho podem converter fumonisinas intactas em fumonisinas hidrolisadas e parcialmente hidrolisadas (Polling e Plattner, 1999).
As fumonisinas são moléculas fortemente polares, solúveis em água e acetonitrilo e insolúveis em solventes orgânicos (Pozzi et al., 2002).
2. Mecanismo de acção Em todas as espécies de animais estudadas verificouse que a absorção das fumonisinas no tubo digestivo é diminuta, sendo rapidamente eliminadas. O fígado e o rim são os órgãos que retêm a maior parte das fumonisinas absorvidas (FAO/WHO, 2001; Williams et al., 2003).
O modo de acção das fumonisinas relaciona-se com a sua interferência com o metabolismo da esfingosina - esfinganina (So - Sa) (Cirillo et al., 2003), perturbando o metabolismo dos esfingolípidos (Turner et al., 1999).
Os esfingolípidos estão presentes nas membranas celulares, desempenhando um papel fundamental na regulação celular e no controlo de proteínas membranares, mediando o crescimento celular, a diferenciação e a morte das células (Turner et al., 1999). Os esfingolípidos mais simples são as bases esfingóides. Nas células dos mamíferos as bases esfingóides mais comuns são a esfingosina e a esfinganina. Normalmente a concentração de esfingosina é 3 a 5 vezes mais elevada do que a de esfinganina (Riley et al., 1994).
Em estudos in vivo e in vitro foi demonstrado que as fumonisinas, com excepção da série A, são potentes inibidores competitivos da esfinganina N-aciltransferase e da esfingosina N-aciltransferase (ceramida sintetase) uma vez que, estruturalmente, são análogas de bases esfingóides. As enzimas anteriormente referidas são elementos chave para a via metabólica da biossíntese dos esfingolípidos de novo e turnover dos mesmos. Deste modo, as fumonisinas podem alterar a concentração e a proporção entre a esfinganina e a esfingosina, diminuindo a biossíntese de esfingosina e acumulando esfinganina (Riley et al., 1994; Turner et al., 1999; Desai et al., 2002, Carratù et al., 2003) (Figura 2).
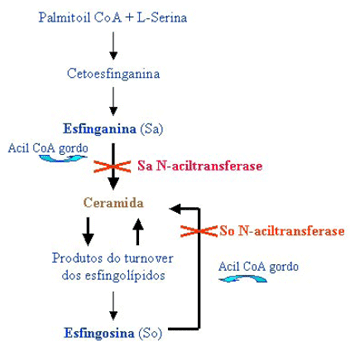
Figura 2 – Modo de acção das fumonisinas
Podem também bloquear a biossíntese de esfingolípidos complexos em células eucarióticas. Os esfingolípidos complexos desempenham funções muito importantes a nível membranar, estando também na base da formação de mensageiros secundários que controlam diferentes processos celulares, incluindo a expressão genética e a activação/desactivação de proteínas específicas (Riley et al., 1994). Assim, estas micotoxinas contribuem para uma variedade de consequências a nível celular, como sejam a indução da apoptose e efeitos carcinogénicos (Turner et al., 1999; Momany e Dombrink-Kurtzman, 2001; Desai et al., 2002, Meyer et al., 2003).
3. Efeitos biológicos
A contaminação de alimentos e alimentos compostos com fumonisinas tem sido associada a doenças várias, quer em animais quer em humanos. As manifestações clínicas que decorrem das toxicoses provocadas pelas fumonisinas, bem como os órgãos atingidos variam de espécie para espécie. Nos cavalos conduzem ao aparecimento de leucoencefalomalacia (ELEM), em suínos provocam edema pulmonar (PPE). Em ovelhas, ratos e coelhos induzem a toxicidade renal, sendo também hepatotóxicas para os segundos. Outras espécies também são atingidas por toxicoses provocadas por estas micotoxinas.
Alguns efeitos anti-nutricionais e alterações fisiopatológicas em ratos adultos estão descritos, nomeadamente a redução da toma de folatos (Carratù et al., 2003). Também têm sido epidemiologicamente relacionadas com o EC nos humanos (Meyer et al., 2003). Estas micotoxinas são citotóxicas e inibem a síntese proteica e do DNA, promovem stress oxidativo, induzem a fragmentação do DNA e interrompem o ciclo celular (Creppy et al., 2004).
3.1. Animais
Todos os problemas causados estão relacionados com a inibição da biossíntese de esfingolípidos, sendo os órgãos mais afectados o fígado e o rim. Lesões mais avançadas de ambos os órgãos em ratos são caracterizadas por morte celular simultânea (apoptose) e proliferação celular (Voss et al., 2001).
Em animais de experimentação, a FB1 mostrou possuir um efeito promotor e iniciador de cancro, bem como actividade hepatocarcinogénica e nefrototóxica em ratos (Hopmans e Murphy, 1993; Shephard et al., 1996; Westhuizen et al., 2004). São ainda citadas a citotoxicidade em culturas de células de mamíferos e fitotoxicidade (Marasas, 1996; Bacon et al., 1992; Bacon et al., 1996).
A toxicidade que provocam nos animais domésticos está sobejamente referenciada: a ELEM, um síndroma que atinge o sistema nervoso central dos cavalos e que leva à liquefacção da substância branca do cérebro; o PPE que aparece secundariamente devido a problemas cardiovasculares (Turner et al., 1999; FAO/WHO, 2001; Kim et al., 2003; Seefelder et al., 2003); a indução de diarreia e redução do peso corporal em perus e frangos jovens (Sydenham et al., 1993; Shephard et al., 2000); a toxicidade renal em ovelhas, coelhos e ratos (Meyer et al., 2003). Em macacos verificou-se a indução de apoptose em células hepáticas (Wang et al., 1996), renais e quaisquer outras em que ocorre acumulação de esfinganina (e esfingosina) (Desai et al., 2002), tendo sido também observadas alterações a nível renal e alterações em parâmetros bioquímicos do sangue e da urina (Gelderblom et al., 2001).
Em 1991, Ross et al. analisaram alimentos compostos para avaliar os níveis de FB1 e efectuaram a associação com a ELEM e o PPE. Os alimentos compostos associadas à ELEM apresentavam concentrações de FB1 que variavam entre 1 μg/g e 126 μg/g. O teor de FB1 em alimentos compostos associados à PPE variava entre 1 μg/g e 330 μg/g.
3.2. Homem
Com base nos dados actuais, a Agência Internacional de Pesquisa sobre o Cancro (IARC) classificou a FB1 como possivelmente carcinogénica para o homem, incluindo-a no grupo 2B (IARC, 2002). Os níveis de fumonisinas em milho com fungos estão epidemiologicamente correlacionados com alta incidência de EC em humanos. Esta patologia tem sido referenciada em regiões da África do Sul, Transkei, dos EUA, Carolina do Sul, dos cantões Linxian e Cixian na China (Rheeder et al., 1992; Sydenham et al., 1991; Chu e Li, 1994; Shepard et al., 2000), na região meridional do Brasil (Santa Catarina, Paraná e Rio Grande do Sul) (Westhuizen et al., 2003), na província de Mazandaran do Irão (Shepard et al., 2000) e no nordeste de Itália (Piñeiro et al., 1997; Solfrizzo et al., 1997). Esses níveis são superiores a 118 μg/g em Transkei e a 155 μg/g na China (Munkvold e Desjardins, 1997; Turner et al., 1999).
As populações da África do Sul e da China apresentam os números mais elevados de EC do mundo. Enquanto no Ocidente o aparecimento deste tumor é atribuído a factores como o tabaco e álcool, nas regiões referidas estes factores não são considerados significativos (Turner et al., 1999).
As fumonisinas têm sido consideradas como suspeitas no aumento da incidência de alterações no tubo neural (NTD) entre a população que vive ao longo da fronteira Texas-México (Stack, 1998).
4. Interacção com outras micotoxinas
Diferentes micotoxinas, produzidas pela mesma ou por diferentes espécies fúngicas, ocorrem simultaneamente em produtos derivados de plantas. No entanto, existe pouca informação no que diz respeito à interacção de micotoxinas concomitantes e às consequências que daí advêm em relação à toxicidade (Speijers e Speijers, 2004).
Estudos adequados para estabelecer efeitos antagónicos, aditivos ou sinérgicos na exposição a micotoxinas combinadas são raros. Neste campo, é essencial perceber o modo de acção de cada micotoxina a nível celular para se compreender a interacção com a toxicidade de outras micotoxinas. Seria de esperar que micotoxinas com modos de acção semelhantes apresentassem, pelo menos, efeitos aditivos. Pelo contrário, algumas interacções podem apresentar efeitos subtractivos (Speijers e Speijers, 2004).
Como exemplo dum efeito subtractivo pode citar-se a interacção entre as esfingofunginas (inibidoras da serina palmitoil transferase fúngica) e as fumonisinas. Esta interacção previne a acumulação de bases esfingóides livres (Speijers e Speijers, 2004).
Infelizmente as micotoxinas não podem ser classificadas com base no seu mecanismo de acção dada a diversidade de estruturas químicas. No entanto, o conhecimento do modo de acção in vitro pode fornecer a base racional para predizer interacções entre micotoxinas (Speijers e Speijers, 2004).
Estas considerações teóricas, baseadas no modo de acção a nível celular, podem não conduzir a uma resposta final esperada, pois o comportamento toxicocinético e os aspectos toxicodinâmicos de cada uma influenciam o resultado da exposição a um conjunto combinado de micotoxinas (Speijers e Speijers, 2004).
Em estudos realizados com suínos desmamados, a administração combinada de fumonisinas, DON, toxina T2 com OTA deu origem, em geral, a alterações semelhantes às observadas aquando da administração de OTA isoladamente. Apenas se observou que ocorreu supressão na formação de radicais e anticorpos quando a OTA foi combinada com FB1 ou DON, o que não se verificou na administração isolada de OTA. A amplificação sinérgica de alterações imunossupressivas devido ao consumo simultâneo destas micotoxinas em baixas concentrações é pouco provável (Müller et al., 1999).
Groten et al. (1998) e Tajima et al. (2002) estudaram a interacção entre 5 tipos de micotoxinas (NIV, DON, toxina T2, ZEA e FB1) através da inibição da síntese de DNA em fibroblastos. Os resultados mostraram que a exposição combinada a diferentes classes de micotoxinas geralmente conduzem a um efeito aditivo, havendo algumas excepções que indicam interacção sinérgica. No entanto, a magnitude da interacção foi relativamente pequena para NIV, DON, T2, ZEA e FB1. A interacção entre ZEA e FB1 foi interpretada como sinérgica no que diz respeito à inibição da síntese de DNA.
Creppy et al. (2004) estudaram a interacção entre OTA e FB1 em diferentes tipos de linhas celulares, in vitro, com o objectivo de prever a toxicidade in vivo. Os efeitos combinados de OTA e FB1 são claramente de natureza sinérgica in vitro, sendo as concentrações das micotoxinas testadas muito importantes para os resultados obtidos.
No entanto, Kubena et al. (1997) demonstraram, in vivo, efeitos aditivos entre FB1 e OTA através de estudos realizados com perus jovens.
O facto de se encontram interacções sinérgicas entre FB1 e OTA depende das doses usadas. O sinergismo na toxicidade de FB1 e OTA pode estar relacionado com a capacidade de ambas as toxinas produzirem espécies reactivas de oxigénio e à capacidade de comprometerem mais ou menos especificamente a síntese de proteínas e de macromoléculas celulares (Creppy et al., 2004).
5. Presença em alimentos
A incidência de fumonisinas verifica-se a nível mundial e é clara a sua presença em alimentos destinados a humanos e animais, dada a incidência destas micotoxinas no milho (Shepard et al., 1996), uma vez que cerca de 90% do F. moniliforme se encontra no referido cereal (Fumonisins Page).
A FB1 é a fumonisina predominante, encontrada no milho contaminado naturalmente, e constitui normalmente cerca de 70% da quantidade total de fumonisinas presentes (Polling e Plattner, 1999).
A primeira descrição da ocorrência natural de FB1 foi realizada por Sydenham et al. (1990) a partir de milho contaminado da região do Transkei, na África do Sul, que apresentava alta incidência de EC no Homem. Os níveis detectados nas amostras variavam entre 44 e 83 μg/g (Pozzi et al., 2002).
A relação entre o milho e o Fusarium moniliforme é uma relação endófita, trazendo benefícios para a planta. Assim, pode estimular o seu crescimento e desenvolvimento, uma vez que produz hormonas promotoras do seu crescimento, protege a planta contra outros agentes patogénicos ou insectos, reduz a infecção por Aspergillus flavus, reduzindo a produção de aflatoxinas e diminui a infecção por Fusarium graminearum (Munkvold e Desjardins, 1997).
Por outro lado, no milho, o Fusarium moniliforme pode provocar a decomposição do caule, da espiga e do grão. O vento, a chuva e os insectos podem conduzir à dispersão do fungo, podendo os insectos ser responsáveis por infecções entre culturas de anos diferentes. O fungo chega ao grão através das barbas, cresce através do pericarpo até ao seu interior. Ocasionalmente as hifas podem ser encontradas no embrião e endosperma. O pericarpo constitui, portanto, um meio de defesa, pelo que a sua danificação pode levar à contaminação do grão (Nelson, 1991).
5.1. Alimentos para animais
Em 1990 foi correlacionada a ocorrência de fumonisinas com o diagnóstico de ELEM na África do Sul, analisando amostras de milho contaminado com concentrações de FB1 que variavam de 37 a 122 μg/g (Pozzi et al., 2002). Nesse mesmo ano também se detectou a presença de FB1 e FB2 em amostras de milho destinados a cavalos e porcos nos Estados Unidos que apresentavam ELEM e PPE, respectivamente (Ross et al., 1990).
Na Tabela 1 mostram-se os níveis médios de fumonisinas associados a epidemias de ELEM.
Tabela 1 - Níveis médios de fumonisinas em alimentos compostos associados à ELEM (Thiel et al., 1992; Sydenham et al., 1992b)

Em 1997, Scudamore et al., analisaram a presença de micotoxinas em alimentos para animais domésticos. As fumonisinas foram encontradas em 30% das amostras testadas, com um máximo de 750 μg/g encontrado numa amostra de comida para gato. Os mesmos autores, em 1998, determinaram a quantidade de micotoxinas em alimentos compostos para animais. Relativamente às fumonisinas verificaram que estas ocorreram em todas as amostras, excepto em duas amostras de glúten, em concentrações que variavam entre 32 mg/kg e 8 mg/kg.
Em Portugal, entre 1996 e 1999, foi analisada a qualidade micológica de alimentos compostos para bovinos. No que respeita ao género Fusarium, este foi encontrado em 20% das amostras, o que corresponde a um ligeiro decréscimo da contaminação dos referidos alimentos relativamente a épocas anteriores, perspectivando, assim, uma evolução qualitativa positiva (Martins e Martins, 2001).
5.2. Alimentos destinados ao homem
Inúmeras publicações científicas traduzem as preocupações em avaliar os níveis de fumonisinas no milho e em alimentos contendo milho em diferentes países: nos EUA (Hopmans e Murphy, 1993), na fronteira Texas- México (Stack, 1998), na África do Sul (Sydenham et al., 1990; Sydenham et al., 1991; Sydenham et al., 1992a), no Brasil (Westhuizen, et al., 2003; Castro et al., 2004; Bittencourt et al., 2005), na Argentina (Sydenham et al., 1993), na Suíça (Pittet et al., 1992; Xie et al., 1997), no Irão (Shephard et al., 2000), no México (Dombrink-Kurtzman e Dvorak, 1999; Cortez-Rocha et al., 2003), na zona oeste do Quénia (Kedera et al., 1999), em Itália (Cirillo et al., 2003), em Espanha (Castellá et al., 1999), no Uruguai (Piñeiro et al., 1997), no Canadá (Lombaert et al., 2003), na Croácia (Domijan et al., 2003), em França (Molinié et al., 2005) e na Nigéria (Bankole e Mabekoje, 2004).
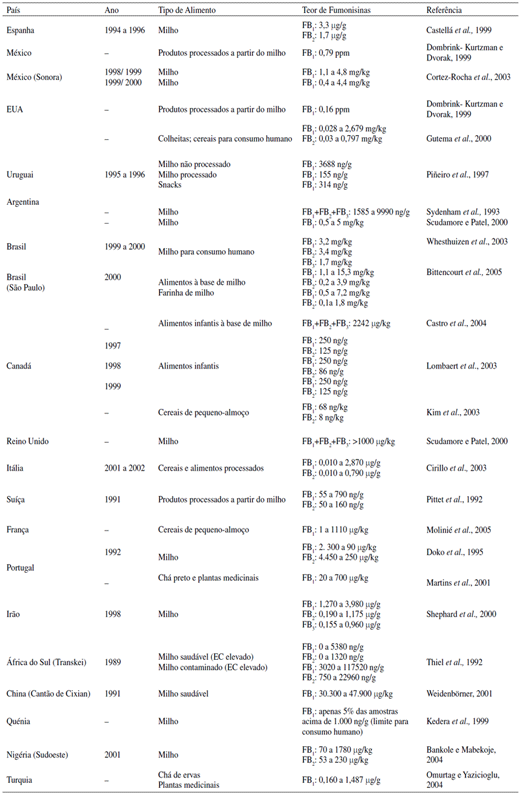
Na Tabela 2 podem observar-se os níveis de fumonisinas em alimentos de diferentes países.
Scudamore e Patel (2000) mostraram que a contaminação por FB1 decresce com o aumento da latitude. Em particular, amostras do sul de França e Espanha, apresentavam maior concentração de FB1 do que amostras do norte de França. Investigações realizadas na Europa do Sul revelaram que o Fusarium verticillioides é o fungo predominante do milho e que o Fusarium proliferatum é frequentemente encontrado com o primeiro. Por outro lado, na Europa Central e do Norte os fungos prevalecentes são: F. graminearum, F. culmorum e F. subglutinans. Sendo o Fusarium verticillioides e o Fusarium proliferatum os principais produtores de FB1, a sua presença no Sul da Europa explica a elevada concentração desta micotoxina nesta zona do planeta (Pietri et al., 2004).
Especial atenção deve ser dada à presença de fumonisinas na dieta de populações vulneráveis, como são as crianças, atendendo a que os alimentos à base de cereais são uma importante fonte nutritiva da sua dieta, que a quantidade que consomem é proporcionalmente mais elevada, em relação ao seu peso corporal, do que os adultos, que a sua dieta é mais limitada e que a sua fisiologia é algo diferente (Lombaert et al., 2003).
6. Processos de descontaminação
A extensão da contaminação do milho bruto com fumonisinas está dependente de diversos factores como a localização geográfica, as práticas agronómicas e de conservação, a vulnerabilidade das plantas à invasão por fungos durante todas as fases de crescimento, conservação e processamento. Os níveis de fumonisinas são também influenciados por factores ambientais como temperatura, humidade e chuva durante os períodos de pré-colheita e colheita e pela infestação com insectos (USFDA-CFSAN, 2001a).
Existem diferentes métodos de descontaminação: físicos, químicos e biológicos. Porém, de acordo com a European Mycotoxin Awareness Network (EMAN) (EMAN, 2000), o processo ideal de descontaminação deve ser fácil de usar, económico, não deve dar origem à formação de compostos que ainda apresentem toxicidade, ou alterar as propriedades nutricionais e a palatibilidade do grão e respectivos derivados.
O grau de descontaminação depende do método usado e da toxicidade que subsiste na amostra tratada (Soriano e Dragacci, 2004). Pode ocorrer redução do teor de fumonisinas, mas não se registar diminuição da toxicidade devido a alterações nas moléculas das fumonisinas (Munkvold e Desjardins, 1997).
6.1. Físicos
As fumonisinas são de difícil eliminação. Nos alimentos processados à base de milho, os níveis de fumonisinas estão dependentes dos processos de moagem e de manufactura a que o milho em bruto é submetido.
A eliminação do germe e ou do pericarpo pode dar duranorigem a teores inferiores de fumonisinas uma vez que estas se concentram no germe e no pericarpo (USFDACFSAN, 2001b). Este processo pode ser considerado um procedimento preliminar na descontaminação de fumonisinas, que pode reduzir o seu conteúdo entre 26,2% e 64,4% (Soriano e Dragacci, 2004).
A moagem seca ou húmida pode reduzir o teor de fumonisinas nos alimentos (Soriano e Dragacci, 2004). Na moagem seca verifica-se um aumento da concentração de fumonisinas no pericarpo. Na moagem húmida as fumonisinas migram para a solução aquosa, sendo reduzida a sua concentração (EMAN, 2000).
Apesar das fumonisinas serem termicamente estáveis, temperaturas superiores a 150ºC são eficazes na remoção destas micotoxinas das amostras (Soriano e Dragacci, 2004). Mas a sua eficácia depende da relação tempo - temperatura. No entanto, estes processos térmicos de descontaminação resultam na conversão de fumonisinas intactas em fumonisinas hidrolisadas (Polling e Plattner, 1999) que são mais citotóxicas que as FB1 (Seefelder et al., 2003). Na preparação dos flocos, o teor em fumonisinas pode ser reduzido durante a extrusão do milho meio moído, da farinha de milho, da conversão em flocos e do tostar do milho (Kim et al., 2003). Também nas pipocas pode ocorrer redução significativa de fumonisinas, que podem estar presentes no grão inteiro (USFDA-CFSAN, 2001b).
Outro método físico de descontaminação envolve a utilização de materiais adsorventes com capacidade para se ligarem eficazmente às micotoxinas e imobilizarem- nas no tracto gastrointestinal dos animais, reduzindo a biodisponibilidade da toxina. Exemplos destes materiais são o carvão activado, a colestiramina (Soriano e Dragacci, 2004), o aluminosilicato de cálcio e sódio hidratado e a montmorilonite egípcia (Aly et al., 2004). Estes dois últimos adsorventes manifestaram capacidades de adsorção entre 88,2% e 92,5% para a FB1 presente em extractos de malte usado na indústria alimentar e em bebidas.
Outro método físico consiste na utilização de radiação gamma, observando-se uma redução de cerca de 20% no conteúdo em FB1 e FB2 em amostras de milho, para intensidade de radiação da ordem de 15 kGy (Soriano e Dragacci, 2004).
6.2. Químicos
A lavagem com água ou com uma solução de bissulfito de sódio pode reduzir o teor de fumonisinas nos alimentos (Soriano e Dragacci, 2004). O recurso a solução saturada de cloreto de sódio pode originar perdas da ordem dos 86% em milho contaminado com FB1 (Shetty e Bhat, 1999).
O tratamento com hidróxido de amónio pode reduzir em 79% os níveis de FB1 em milho contaminado. A nixtamilização, que consiste no tratamento do milho com Ca(OH)2, pode reduzir a concentração de fumonisinas em cerca de 50% (Soriano e Dragacci, 2004). Este processo é usado na produção de masa usada na preparação de tortilla, substituto mexicano do pão e tiras de milho (Dombrink-Kurtzman et al., 2000 e Seefelder et al., 2003). Amra et al. (2003) encontraram perdas da ordem dos 66% aquando do processamento de tortilla. Porém, ambos os métodos conduzem ao aparecimento de fumonisinas hidrolisadas e parcialmente hidrolisadas - em que são removidos os dois ou apenas um grupo de ácido tricarboxílico da molécula de fumonisina, respectivamente - que continuam a exercer efeitos hepatotóxicos e nefrotóxicos (Polling e Plattner, 1999; Seefelder et al., 2003; Soriano e Dragacci, 2004). Uma combinação de métodos químicos - nixtamilização - e físicos - tratamento com temperaturas elevadas - pode reduzir a concentração de fumonisinas em 79% (Soriano e Dragacci, 2004).
O efeito tóxico da FB1 pode ser eliminado, em cerca de 95%, durante o processamento do milho por reacção entre a micotoxina e a frutose, já que a amina primária das fumonisinas pode reagir com o grupo carboxilo do açúcar redutor quando este é aquecido a 80ºC durante 48 horas, formando-se bases de Schiff que, posteriormente, se convertem em outros produtos de acastanhamento não enzimático destituídos de perigo (Seefelder et al., 2003; Soriano e Dragacci, 2004).
A ozonização foi tentada, mas a conversão da FB1 em 3-ceto FB1, composto dotado de toxicidade mais elevada, pôs de lado esta tentativa de oxidação (Soriano e Dragacci, 2004).
6.3. Biológicos
Os métodos físicos e químicos possuem grandes desvantagens, nomeadamente eficácia limitada, perda de nutrientes e alto custo, pelo que muitos investigadores são de opinião que a melhor solução para a descontaminação, no futuro, será a descontaminação por biodegradação.
A descontaminação de micotoxinas por processos biológicos tem enveredado pelo recurso a bactérias, iniciando-se esta nos anos sessenta, ou a processos fermentativos, em que o uso de leveduras se iniciou nos anos oitenta (Bata e Lásztity, 1999). Nos últimos tempos têm sido também referenciados o recurso a compostos presentes em extractos de plantas ou a modificações genéticas (Soriano e Dragacci, 2004).
Uma forma de controlar biologicamente o Fusarium moniliforme consiste na utilização de uma bactéria endófita, Bacillus subtilis, que reduz a acumulação de FB1 durante a fase do ciclo de vida do fungo em que não se observa infecção apesar deste estar presente. Tal facto observa-se uma vez que a bactéria compete com o fungo pelo mesmo nicho ecológico na planta (Bacon et al., 2001).
No caso das fumonisinas, foi tentado o uso da levedura Exophiala spinifer que promove a hidrólise da FB1 em aminopentol e ácido tricarboxílico, tendo também a capacidade de descontaminar o aminopentol com a libertação de CO2 (Soriano e Dragacci, 2004). A utilização de três variedades de Saccharomyces duranorigemte oito dias originou reduções de cerca de 28% para a FB1 e 17% para a FB2 (Bata e Lásztity, 1999).
Diversos compostos naturais de plantas podem ser usados. O majonósido-R2, saponina extraída de raízes e rizomas de Panax vietnamensis, diminui a actividade da FB1 como promotora de tumores em ratos. O eugenol, óleo presente no cravo da Índia, inibe o crescimento de Fusarium verticillioides e regula a produção de fumonisinas (Soriano e Dragacci, 2004). Diversos compostos fenólicos inibem o crescimento daquele fungo, reduzindo a produção de FB1 (Beekrum et al., 2003). O extracto de isoflavona de soja reduz a actividade hepatotóxica da FB1 em ratos devido à supressão da produção de prostaglandina que estimula a FB1 (Soriano e Dragacci, 2004).
O milho transgénico, milho Bt, expressa uma toxina de Bacillus thuringiensis (Bt) que aumenta a resistência da planta ao fungo uma vez que aumenta a resistência da mesma a insectos. A diminuição da infecção por Fusarium pode também dever-se ao aumento da expressão de proteínas anti-fúngicas específicas e metabolitos ou conseguir-se acentuando as próprias defesas da planta nos tecidos dos grãos. Outra estratégia de modificação genética consiste no uso de genes que codificam enzimas que degradam as fumonisinas. Estas enzimas foram identificadas em fungos isolados no milho, tendo os genes que as codificam sido clonados e colocados em milho transgénico (Duvick, 2001).
Não obstante a diversidade de métodos conducentes à descontaminação, os métodos de descontaminação in vitro não são necessariamente aplicáveis in vivo.
7. Avaliação do grau de exposição das populações
São preconizadas duas formas de avaliação da exposição de populações às fumonisinas. Uma consiste em calcular a respectiva ingestão diária tolerável (TDI), através dos níveis de fumonisinas ingeridos nos distintos itens alimentares. Um estudo de avaliação da contaminação do milho e de produtos à base de milho com fumonisinas, realizado a nível mundial sob orientação da “Commission on Food Chemistry of the International Union of Pure and Applied Chemistry”, concluiu que, na região de Transkei (África do Sul), o consumo diário de milho será de 460 g, enquanto na Alemanha e Reino Unido é apenas de 7 g e na Suíça de 4 g. Assim sendo, para indivíduos com um peso de 70 kg que ingerem milho com uma contaminação média de fumonisinas de 1,7 μg/g, na região de Transkei, e de 0,5 μg/g, na Europa, a ingestão diária provável (PDI) nessas populações é de 11,2 μg/kg peso corporal/dia, de 0,05 μg/kg peso corporal/dia e de 0,03 μg/kg peso corporal/dia em Transkei, na Alemanha e Reino Unido, e na Suíça, respectivamente (Shepard et al., 1996). De acordo com dados mais recentes, o consumo total de fumonisinas nas dietas europeias foi estimado em cerca de 1,4 μg/kg peso corporal/semana (EMAN, 2000).
Foi proposta uma TDI de 800 ng/kg p. c. para a FB1. O European Mycotoxin Awareness Network (EMAN, 2000) e a OMS (WHO, 2002) consideram que a ingestão diária máxima tolerável provisória (PMTDI) para humanos é de 2 μg/kg peso corporal/ dia para a FB1.
O Joint FAO/WHO Expert Committee on Food Additives fixou uma PMTDI de 2 μg/kg peso corporal para as FB1 e FB2 isoladas ou combinadas em alimentos para humanos (FAO/WHO, 2001) De acordo com esta recomendação, uma criança de 20 kg não deverá exceder uma dose diária de 40 μg (Molinié et al., 2005). Tendo em conta este valor e considerando que a TDI é de 0,8 μg/kg peso corporal/dia, esta ingestão nas populações dos países do norte da Europa é claramente inferior, enquanto que as populações do Brasil, China e África do Sul podem estar em risco (Shephard et al., 1996; Soriano e Dragacci, 2004).
Outra forma de avaliar a exposição das populações às fumonisinas consiste em avaliar os níveis de FB1 ou de biomarcadores adequados, como a proporção esfinganina/ esfingosina (Sa/So), nos fluidos biológicos, como urina e soro, e tecidos, que traduzem uma medida mais correcta da exposição às referidas micotoxinas (Shetty e Bhat, 1998; Solfrizzo et al., 1997; Turner et al., 1999). A urina é um indicador para monitorizar a exposição das populações às fumonisinas, tendo sido já demonstrada a sua excreção através da urina, por estudos toxicocinéticos (Shetty e Bhat, 1998). A determinação da proporção Sa/So, em fluidos biológicos, também permite avaliar a exposição à FB1, uma vez que esta provoca uma acumulação de Sa livre e um aumento da proporção Sa livre/So livre, por inibição das enzimas esfingosina e esfinganina N-aciltransferase (Solfrizzo et al., 1997; Castegnaro et al., 1998; Turner et al., 1999) (Figura 2). Como já foi anteriormente referenciado, nos mamíferos a quantidade de esfingosina é cerca de 3 a 5 vezes a de esfinganina livre e a manutenção de baixas concentrações de esfinganina livre e esfingosina livre é importante porque esses compostos têm actividade biológica intrínseca considerável (Riley et al., 1994).
Esta é uma área em que o nosso país não tem investido, apesar das preocupações subjacentes em países do continente europeu (Piñeiro et al., 1997; Solfrizzo et al., 1997), americano (Westhuizen et al., 2003; Rheeder et al., 1992), africano (Sydenham et al., 1991; Shepard et al., 2000) e asiático (Chu e Li, 1994; Shepard et al., 2000) em consequência da correlação encontrada entre a presença de elevados teores das referidas fumonisinas nos alimentos e o seu aparecimento na urina (Shetty e Bhat, 1998) e uma proporção elevada de Sa/ So, bem como com o aparecimento de EC (Kim et al., 2003; Solfrizzo et al., 1997; Turner et al., 1999).
8. Legislação
Não existe uma legislação global para regular os níveis permitidos de fumonisinas no milho e em produtos processados a partir do mesmo. Mais de 90 países apresentam regulamentação própria ou níveis máximos para algumas micotoxinas, dependendo do tipo de matriz.
Na Suíça foi estabelecido um limite máximo de 1 mg/kg para a soma da FB1 e FB2 em milho para consumo humano (Shephard et al., 2000) e, em 1997, o “Swiss Federal Office of Public Health” estabeleceu um valor de tolerância de 1,0 μg/kg para as FB1 e FB2 em produtos processados a partir do milho seco (Cirillo et al., 2003; Soriano e Dragacci, 2004).
O “French Council of Public Hygiene” recomendou um valor máximo de 3,0 mg/kg para as FB1 e FB2 em cereais. A US-FDA, em 2000, aconselhou níveis de 2-4 μg/g, que foram considerados em Itália como limites de referência (Cirillo et al., 2003).
A Eslováquia estabeleceu limites no milho contaminado, não devendo exceder 100-200 μg/kg (Labuda et al., 2003).
A Food and Drug Administration (FDA) recomenda níveis máximos de fumonisinas de 1, 10, 30, 50 e 15 mg/kg na ração total de cavalos, suínos, ruminantes, aves e vacas leiteiras, respectivamente (USFDA-CFSAN, 2001c).
A legislação portuguesa não contempla limites para os níveis de fumonisinas em alimentos destinados a humanos e animais.
A FDA considera que os níveis recomendados para as fumonisinas no milho e derivados para consumo humano são uma medida prudente para a Saúde Pública (USFDA-CFSAN, 2001b).
Segundo dados do Jornal Oficial da União Europeia, a recomendação da Comissão de 17 de Fevereiro de 2004 refere que, embora já exista uma directiva que regula os teores máximos de aflatoxina B1 nos alimentos para animais, não existe regulamentação comunitária para as demais micotoxinas, como é o caso das fumonisinas. Assim a Comissão recomendou que os estados membros realizassem durante o ano de 2004 um programa coordenado de controlo destinado a verificar a concentração de micotoxinas em alimentos para animais indicando a metodologia de análise (Jornal Oficial da União Europeia, 2004).
Até à data a Comissão Europeia recomendou, mas não legislou, níveis máximos de FB1+FB2 que variam entre 2000 μg/kg em milho não processado e 100 μg/kg em alimentos infantis (Soriano e Dragacci, 2004).
O relatório do “Council for Agricultural Science and Technology” estabelece que um dos objectivos para o século XXI é o desenvolvimento de uma legislação uniforme, a nível mundial, para a contaminação dos alimentos por micotoxinas. Os objectivos serão a identificação das nações que seriam sujeitas a um maior impacto, caso se estabelecesse legislação mais rígida, e a avaliação dos benefícios para a saúde humana, bem como os prejuízos a nível económico, caso se optasse por tal. Estes padrões legislativos levariam a que, entre as nações industrializadas, fossem os Estados Unidos a experimentar maiores perdas económicas. As condições ambientais dos países em desenvolvimento são, no entanto, mais favoráveis à acumulação de micotoxinas. Contrariamente às preocupações expressas pelos legisladores, não seriam os países menos desenvolvidos, como as nações africanas sub-sarianas, a experimentar as maiores perdas económicas, mas antes a China e a Argentina. Se fosse implementado a nível mundial um limite de 0,5 mg/kg para as fumonisinas, o prejuízo total nas exportações, devido à contaminação do milho por fumonisinas, excederia os 300 milhões de dólares/ano. Caso se adoptassem os limites menos restritivos dos Estados Unidos, 2 mg/kg, os prejuízos seriam 3 vezes inferiores (Wu, 2004).
9. Conclusões
Conhecidas por poderem exercer efeitos sinérgicos in vivo, o controlo de fumonisinas em alimentos e em fluídos biológicos das populações é útil para uma melhor avaliação do risco para a saúde humana e animal.
As avaliações da exposição das populações às fumonisinas, através dos alimentos ingeridos e da respectiva presença nos líquidos biológicos são imprescindíveis para a investigação epidemiológica e monitorização da Saúde Pública.
Os processos de descontaminação a utilizar nos itens alimentares apresentam eficácias muito diversificadas.
Apesar de em algumas sociedades a exposição ser baixa, a investigação e a implementação de medidas legislativas são necessárias para se diminuir a exposição das comunidades urbanas e rurais, especialmente as de tenra idade, e daquelas em que se verifica uma dieta excessivamente rica em milho.
Agradecimentos
Os autores agradecem à FCT e FEDER (POCTI) a bolsa de doutoramento concedida a Liliana J. G. Silva.
Bibliografia
Aly, S.E., Abdel-Galil, M. e Abdel-Wahhab, M.A. (2004). Application of adsorbent agents technology in the removal of aflatoxin B1 and fumonisin B1 from malt extract. Food Chem. Toxicol., 42, 1825-1831.
Amra, H.A., Enein, A.A., Ragab, A.A., Ayesh, A.M. e Mohamed, M.I. (2003). Effect of tortilla processing on fumonisin B1 destruction. Toxicology Letters, 144, Supplement 1, s62.
Bacon, C.W., Bennett, R.M., Hinton, D.M. e Voss, K.A. (1992). Scanning electron microscopy of Fusarium moniliforme within asymptomic corn kernels and kernels associated with equine leukoencephalomalacia. Plant Disease, 76(2), 144-148.
Bacon, C.W. e Hinton, D.M. (1996). Fusaric acid and pathogenic interactions of corn and non-corn isolates of Fusarium moniliforme, a nonobligate pathogene of corn. In: Fumonisins in food; Advances in experimental medicine and biology v. 392, Jackson, L. S. De Vries, J. W., Bullerman, L. B., Eds; Plenum Press; New York, N.Y.; pp. 1-18.
Bacon, C.W., Yates, I.E., Hinton, D.M. e Meredith, F. (2001). Biological control of Fusarium moniliforme in maize. Environ. Health Perspectives, 109 (suppl. 2), 325-332.
Bankole, S.A e Mabekoje, O.O. (2004). Occurrence of aflatoxins and fumonisins in preharvest maize from south-western Nigeria. Food Add. Contam., 21, 251-255.
Bata, Á. e Lásztity, R. (1999). Detoxification of mycotoxin-contaminated food and feed by microorganisms. Trends in Food Science & Technol. 10, 223-228.
Beekrum, S., Govinden, R., Padayachee e Odhav, B. (2003). Naturally occurring phenols: a detoxification strategy for fumonisin B1. Food Add. Contam., 20(5), 490-493.
Bezuidenhout, G.C., Gelderblom, W.C.A., Gorst-Allman, C.P., Horak, R.M., Marasas, W.F.O., Spiteller, G. e Vleggaar, R. F (1988). Structure elucidation of the fumonisins, mycotoxins from Fusarium moniliforme. J. Chem. Soc., Chem. Commun., 11, 743-745.
Bittencourt, A.B.F., Oliveira, C.A.F., Dilkin, P. e Corrêa, B. (2005). Mycotoxin occurrence in corn meal and flour traded in São Paulo, Brazil. Food Control, 16, 117-120.
Carratù, M.R., Cassano, T., Coluccia, A., Borracci P. e Cuomo, V. (2003). Antinutritional effects of fumonisin B1 and pathophysiological consequences. Toxicology Letters, 140-141, 459-463.
Castegnaro, M., Garren, L., Galendo, D., Gelderblom, W.C.A., Chelule, P., Dutton, M.F., Wild, C.P. (1998). Analytical method for the determination of sphinganine and sphingosine in serum as a potential biomarker for fumonisin exposure. J. Chromatography. B, 720, 15-24.
Castellá, G., Bragulat, M.R. e Cabañes, F.J. (1999). Surveillance of fumonisins in maize-based feeds and cereals from Spain. J. Agric. Food Chem. , 47, 4707-4710.
Castro, M.F.P.M., Shephard, G.S., Sewram, V., Vicente, E., Mendonça, T.A. e Jordan, A.C. (2004). Fumonisins in Brazilian corn-based foods for human consumption. Food Add. Contam., 21(7), 693-699(7).
Charmley, L.L., Rosenberg, A. e Trenholm, H.L. (1994). Factors responsible for economic losses due to Fusarium mycotoxin contamination of grain, foods and feedstuffs. in: Mycotoxins in Grains. Miller J.D. e Trenholm H. L. (eds). St. Paul, MN: Eagan Press. p471.
Chu, F.S. e Li, G.Y. (1994). Simultaneous occurrence of fumonisin B1 and other mycotoxins in moldy corn collected from the People’s Republic of China in regions with high incidences of esophageal cancer. Appl. Environ. Microbiol., 60(3), 847-852.
Cirillo, T., Ritieni, A., Galvano, F. e Cocchieri, R.A. (2003). Natural co-occurrence of deoxynivalenol and fumonisins B1 and B2 in Italian marketed foodstuffs. Food Add. Contam., 20(6), 566-571.
Cortez-Rocha, M.O., Ramírez-Astudillo, W.R., Sánchez-Mariñez, R.I., Rosas-Burgos, E.C., Wong-Corral, F.J., Borboa- Flores, J., Castillón-Campaña, L.G- e Tequida-Meneses, M. (2003). Fumonisins and fungal species in corn from Sonora, Mexico. Bull. Environ. Contam. Toxicol., 70: 668-673.
Creppy, E.E., Chiarappa, P., Baudrimont, I., Borracci, P., Moukha, S. e Carratú, M.R. (2004). Synergistic effects of fumonisin B1 and ochratoxin A: are in vitro cytotoxicity data predictive of in vivo acute toxicity? Toxicology, 201(1-3), 115-123.
Desai, K., Sullards, M.C., Allegood, J., Wang, E., Schmelz, E.M., Hartl, M., Humpf, H-U., Liotta, D.C., Peng, Q. e Merrill, Jr, A.H. (2002) Fumonisins and fumonisin analogs as inhibitors of ceramide synthase and inducers of apoptosis. Biochimica et Biophysica Acta 1585, 188-192.
Doko, M.B., Rapior, S., Visconti, A. e Schjøth, J.E. (1995). Incidence and levels of fumonisin contamination in maize genotypes grown in Europe and Africa. J. Agric. Chem., 43, 429-434.
Dombrink-Kurtzman, M.A. e Dvorak, T.J. (1999). Fumonisin content in masa and tortillas from Mexico. J. Agric. Food Chem., 47, 622-627.
Dombrink-Kurtzman, M.A., Dvorak, T.J., Barron, M.E. e Rooney, L.Y. (2000). Effect of nixtamilization (alkaline cooking) on fumonisin-contaminated corn for production of masa and tortillas. J. Agric. Food. Chem., 48, 5781-
5786.
Domijan, A.-M., Peraica, M., Fuchs, R., Luci??, A., Radi??, B., Jurjevi??, Ž. e Cvjetkovi??, B. (2003). Screening for fumonisins B1 and B2 in corn collected in Republic of Croatia.
Toxicology Letters, 144, Supplement 1, s64.
Duvick, J. (2001). Prospects for reducing fumonisin contamination of maize through genetic modification. Environ. Health Perspectives, 109 (suppl. 2), 337-342.
EMAN (2000). European Mycotoxin Awareness Network (http:// www.mycotoxins.org). 7-04-2004 FAO/WHO (2001). Fifty-sixth meeting, Geneva, Summary and conclusions (http://www.who.int/pcs/jecfa/summary56.
pdf) 14-09-2003.
Fumonisins Page: (http://www.ansci.cornell.edu/courses/as625/ 1997term/Park) 12-09-2003. Fumonisins: (http://micotoxinas.com.br/fumofacts.htm) 13-09- 2003
Gelderblom, W.C.A., Jaskiewicz, K., Marasas, W.F.O., Thiel, P.G., Horak, R.M., Vleggaar, R., e Kriek, P.J. (1988). Fumonisins– novel mycotoxins with cancer promoting activity produced by Fusarium moniliforme. Appl. Environ. Microbiol., 54(7), 1806-1811.
Gelderblom, W.C.A., Seier, J.V., Snijman, P.W., Schalkwyk, D.J., Shephard, G.S. e Marasas, W.F.O. (2001). Toxicity of culture material of Fusarium verticillioides strain MRC 826 to nonhuman primates. Environ. Health. Perspectives, 109 (suppl. 2), 267-276.
Groten, J.P., Tajima, O., Feron, V.J. e Schoen, E.D. (1998). Statistically designed experiments to screen mixtures chemical mixtures for possible interactions. Environ. Health. Perspectives, 106 (suppl. 6), 1361-1365.
Gutema, T., Munimbazi, C. e Bllerman, L.B. (2000). Occurrence of fumonisins and moniliformin in corn and corn based food products of U.S. origin. J. Food Prot., 63(12), 1732- 1737.
Hopmans, E.C. e Murphy, P.A. (1993). Detection of fumonisins B1, B2, and B3 and hydrolysed fumonisin B1 in corn-containing foods. J. Agric. Food Chem., 41, 1655-1658.
IARC (International Agency For Research On Cancer) (2002). IARC Monographs on the evaluation of carcinogenic risks to humans. Volume 82: 301-366. Some traditional herbal medicines, some mycotoxins, naphthalene and styrene. IARC, Lyon France.
Jornal Oficial da União Europeia. Recomendação da Comissão de 17 de Fevereiro de 2004 relativa ao programa coordenado de controlo no domínio da alimentação animal para 2004, nos termos da Directiva 95/53/CE do Conselho.
Jurgenson, J.E., Zeller, K.A. e Leslie, J.F. (2002). Expanded genetic map of Gibberella moniliformis (Fusarium verticillioides). Appl. Environ. Microbiol., 68(4), 1972-1979.
Kedera, C.J., Plattner, R.D. e Desjardin, A.E. (1999). Incidence of Fusarium spp. and levels of fumonisin B1 in maize in western Kenya. Appl. Environ. Microbiol., 65 (1), 41-44.
Kim, E.–K., Scott, P.M. e Lau, B.P.–Y. (2003). Hidden fumonisin in corn-flakes. Food Add. Contam., 20(2), 161-169.
Kubena, L.F., Edrington, T.S., Harvey, R.B., Phillips, T.D., Sarr, A.B. e Rottinghaus, G.E. (1997). Individual and combined effects of fumonisin B1 present in Fusarium moniliforme culture material and diacetoxyscirpenol or ochratoxin A in turkey poults. Poultry Sci., 76, 256-264.
Labuda, R., Tancinova, D. e Hudec, K. (2003). Identification and enumeration of Fusarium species in poultry feed mixtures from Slovakia. Ann. Agric. Environ. Med, 10, 61-66.
Lombaert, G.A., Pellaers, P., Roscoe, V., Mankotia, M., Neil, R. e Scott, P.M. (2003). Mycotoxins in infant cereal foods from the Canadian retail market. Food Add. Contam., 20(5), 494-504.
Marasas, W.F.O. (1996). Fumonisins: history, world-wide occurrence and impact. in Fumonisins in food; Advances in experimental medicine and biology v. 392, Jackson, L.S., De Vries, J.W., Bullerman, L.B., Eds; Plenum Press; New York, N.Y.; pp. 1-18.
Martins, H.M. e Martins, M.L. (2001). Qualidade micológica de rações para bovinos (Portugal: 1996-1999). Rev. Port. Ciências Vet., 96(538), 85-88.
Martins, M.L., Martins, H.M. e Bernardo, F. (2001). Fumonisins B1 and B2 in black tea and medicinal plants. J. Food Prot., 64(8), 1268-1270.
Meyer, K., Mohr, K., Bauer, J., Horn, P. e Kovács, M. (2003). Residue formation of fumonisin B1 in porcine tissues. Food Add. Contam., 20(7), 639-647.
Molinié, A., Faucet, V., Castegnaro, M. e Pfohl-Leskowicz, A. (2005). Analysis of some breakfast cereals on the French market for their contents of ochratoxin A, citrinin and fumonisin B1: development of a method for simultaneous extraction of ochratoxin A and citrinin. Food Chem. 92, 391-400
Momany, F.A. e Dombrink-Kurtzman, M.A. (2001). Molecular dynamics simulations on the mycotoxin fumonisin B1. J. Agric. Food Chem., 49, 1056-1061.
Müller, G., Kielstein, P., Rosner, H., Berndt, A., Heller, M. e Kohler, H. (1999). Studies on the influence of combined administration of ochratoxin A, fumonisin B1, deoxynivalenol and T2 toxin on immune defence reactions in weaner pigs. Mycoses, 42(7-8), 485-493.
Munkvold, G.P. e Desjardin, A.E. (1997). Fumonisins in maize– Can we reduce their occurrence? Plant Disease, 81(6), 556-565.
Nelson, P.E. (1991). Taxonomy and biology of Fusarium moniliforme. Mycopathologia, 117, 29-36.
Nelson, P.E., Desjardin, A.E. e Plattner, R.D. (1993). Fumonisins mycotoxins produced by Fusarium species: biology, chemistry and significance. Annu. Rev. Phytopathol., 31, 233-252.
Omurtag, G.Z. e Yazicioglu, D. (2004). Determination of Fumonisins B1 and B2 in herbal tea and medicinal plants in Turkey by high-performance liquid chromatography. J. Food Prot., 67(8), 1782-1786.
Pietri, A., Bertuzzi, T., Pallaroni, L. e Piva, G. (2004). Occurrence of mycotoxins and ergosterol in maize harvested over 5 years in Northern Italy. . Food Add. Contam., 21(5), 479- 487.
Piñeiro, M.S., Silva, G.E., Scott, P.M., Lawrence, G.A. e Stack, M.E. (1997). Fumonisins levels in Uruguayan corn products. J. AOAC Int., 80(4), 825-828.
Pittet, A., Parisod, V. e Schellenberg, M. (1992). Occurrence of fumonisin B1 and B2 in corn-based products from the Swiss market. J. Agric. Food Chem., 40, 1352-1354.
Plattner, R.D., Weisleder, D., Shackelford, D.D., Peterson, R. e Powell, R.G. (1992). A new fumonisin from solid cultures of Fusarium moniliforme. Mycopathologia, 117, 23-28.
Poling, S.M. e Plattner, R.D. (1999). Rapid purification of fumonisins and their hydrolysis products with solid-phase extraction columns. J. Agric. Food Chem., 47, 2344-2349.
Pozzi, C.R., Arcaro, J.R.P., Júnior, I.A., Fagundes, H. e Corrêa, B. (2002). Aspectos relacionados à ocorrência e mecanismo de ação de fumonisinas. Ciência Rural, 32(5), 901- 907.
Rheeder, J.P., Marasas, W.F.O., Thiel, P.G, Sydenham, E.W., Shephard, G.S. e van Schalkwyk, D.J. (1992). Fusarium moniliforme and fumonisins in corn related to human esophageal cancer in Transkei. Phytophathology, 82, 353- 357.
Riley, R.T., Wang, E. e Merrill, A.H. (1994). Liquid chromatographic determination of sphinganine and sphingosine: use of the free sphinganine-to-sphingosine ratio as a biomarker for consumption of fumonisins. J. AOAC Int., 77(2), 533- 540.
Ross, P.F., Nelson, P.E., Richard, J.L., Osweiler, G.D., Rice, L.G., Plattner, R.D. e Wilson, T.M. (1990). Production of fumonisins by Fusarium moniliforme and Fusarium proliferatum isolates associates with equine leucoencefalomalacia and pulmonary edema syndrome in swine. Appl. Environ. Microbiol, 56(10), 3225-3226.
Ross, P.F., Wilson, T.M., Owens, D.L., Nelson, H.A. e Richard, J.L. (1991). Concentrations of fumonisin B1 in feeds associated with animal health problems. Mycopathologia, 114, 129-135.
Scott, P.M. e Lawrence, G.A. (1995). Analysis of beer for fumonisins. J. Food Protection 58 (12), 13791382. Scudamore, K.A., Nawaz, S. e Hetmanski, M.T. (1997). Determination of mycotoxins in pet foods sold for domestic pets and wild birds using linked-column immunoassay cleanup and HPLC. Food Add. Contam., 14(2), 175-186.
Scudamore, K.A., Nawaz, S. e Hetmanski, M.T. (1998). Mycotoxins in ingredients of animal feeding stuffs: II. Determination of mycotoxins in maize and maize products. Food Add. Contam., 15(1), 30-55.
Scudamore, K.A. e Patel, S. (2000). Survey for aflatoxins, ochratoxin A, zearalenone and fumonisins in maize imported into the United Kingdom. Food Add. Contam., 17(5), 407- 416.
Seefelder, W., Knecht, A. e Humpt, H.–U. (2003). Bound fumonisin B1: analysis of fumonisin-B1 glyco and amino acid conjugates by Liquid Chromatography – Electrospray Ionization – Tandem Mass Spectrometry. J. Agric. Food Chem., 151, 5567-5573.
Seo, J.–A. e Lee, Y.–W. (1999). Natural occurrence of the C series of fumonisins in moldy corn. Appl. Environ. Microbiol., 65(3), 1331-1334.
Shephard, G.S., Marasas, W.F.O., Leggott, N.L., Yasdanpanah, H., Rahimian, H. e Safavi, N. (2000). Natural occurrence of fumonisins in corn from Iran. J. Agric. Food Chem., 48, 1860-1864.
Shephard, G.S., Thiel, P.G., Stockenström, S. e Sydenham, E.W. (1996). Worldwide survey of fumonisin contamination of corn and corn-based products. J. AOAC Int., 79(3), 671- 686.
Shetty, P.H. e Bhat, R.V. (1998). Sensitive method for the detection of fumonisin B1 in human urine. J. Chromatography B, 705, 171-173.
Shetty, P.H. e Bhat, R.V (1999). A physical method for segregation of fumonisin-contaminated maize. Food Chemistry 66, 371-374.
Solfrizzo, M., Avantaggiato, G. e Visconti, A. (1997). Rapid method to determine sphinganine/ sphingosine in human and animal urine as a biomarker for fumonisin exposure. J. Chromatography B, 692, 87-93.
Soriano, J.M. e Dragacci, S. (2004). Intake, decontamination and legislation of fumonisins in foods. Food Research International 37(4), 367-374.
Speijers, G.J.A. e Speijeirs, M.H.M. (2004). Combined toxic effects of mycotoxins. Toxicology Letters, 153, 91-98.
Stack, M.E. (1998). Analysis of fumonisin B1 and its hydrolysis product in tortillas. J. AOAC Int., 81(4), 737-740.
Sydenham, E.W., Gelderblom, W.C.A., Thiel, P.G e Marasas, W.F.O. (1990). Evidence for the natural occurrence of fumonisin B1, a mycotoxin produced by Fusarium moniliforme, in corn. J. Agric. Food Chem., 38, 285-290.
Sydenham, E.W., Shephard, G.S. e Thiel, P.G. (1992a). Liquid chromatographic determination of fumonisins B1, B2, and B3 in foods and feeds. J. AOAC Int., 75(2), 313-318.
Sydenham, E.W., Marasas, W.F.O., Shephard, G.S., Thiel, P.G. e Hirooka, E.Y. (1992b). Fumonisins concentrations in Brazilian feeds associated with field outbreaks of confirmed and suspected animal micotoxicoses. J. Agric. Food Chem., 40, 994-997.
Sydenham, E.W., Shephard, G.S., Thiel, P.G., Marasas, W.F.O. e Stockenström, S. (1991). Fumonisins contamination of commercial corn-based human foodstuffs. J. Agric. Food Chem., 39, 2014-2018.
Sydenham, E.W., Shephard, G.S., Thiel, P.G., Marasas, W.F.O., Rheeder, J.P., Sanhueza, C.E.P., González, H.H.L. e Resnik, S.L. (1993). Fumonisins in Argentinian field-trial corn. J. Agric. Food Chem., 41, 891-895.
Sydenham, E.W., Thiel, P.G., Shephard, G.S., Koch, K.R. e Hutton, T. (1995). Preparation and isolation of the partially hydrolysed moiety of fumonisin B1. J. Agric. Food Chem., 43, 2400-2405.
Tajima, O., Schoen, E.D., Feron, V.J. e Groten, J.P. (2002). Statistically designed experiments in a tiered approach to screen mixtures of Fusarium mycotoxins for possible interactions. Food and Chem. Toxicol., 40(5), 685-695.
Thiel, P.G., Marasas, W.F.O., Sydenham, E.W., Shephard, G.S., Gelderblom, W.C.A. e Nieuwenhuis, J.J. (1991). Survey of fumonisin production by Fusarium species. Appl. Environ. Microbiol, 57(4), 1089-1093.
Thiel, P.G., Marasas, W.F.O., Sydenham, E.W., Shephard, G.S. e Gelderblom, W.C.A. (1992). The implications of naturally occurring levels of fuminisins in corn for human and animal health. Mycopathologia, 117: 3-9.
Turner, P.C., Nikiema, P. e Wild, C.P. (1999). Fumonisin contamination of food: progress in development of biomarkers to better assess human health risks. Mutation Research, 443, 81-93.
USFDA-CFSAN (2001a). Fumonisin levels in human foods and animal feeds in http://www.cfsan.fda.gov/~dms/fumongu2. html 12-09-2003.
USFDA-CFSAN (2001b). Background paper in support of fumonisins levels in corn and corn products intended for human consumption. http://www.cfsan.fda.gov/~dms/fumongu3. html 12-09-2003.
USFDA-CFSAN (2001c). Background paper in support of fumonisin levels in animal feed: executive summary of this scientific support document” p. 18 cfsan.fda.gov/~dms/fumonbg4. html 12-09-2003.
Voss, K.A., Riley, R.T., Norred, W.P., Bacon, C.W., Meredith, F.I., Howard, P.C., Plattner, R.D., Collins, T.F.X., Hansen, D.K. e Porter, J.K. (2001). An overview on rodent toxicities: liver and kidney effects of fumonisins and Fusarium moniliforme. Environ. Health. Perspectives, 109 (suppl. 2), 259-266.
Wang, H., Jones, C., Cicci-Zanella, J., Holt, T., Gil Christ, D.C. e Dickman, M.B. (1996). Fumonisins and Alternaria alternatalycopersici toxins: sphinganine analog mycotoxins induce apoptosis in monkey kidney cells. Proc. Natl. Acad. Sci, 93, 3461-3465.
Weidenbörner, M. (2001). Foods and fumonisins. Eur. Food Res. Technol., 212: 262-273.
Westhuizen, L., Gelderblom, W.C.A., Shephard, G.S. e Swanevelder, S. (2004) Disruption of sphingolipid biosynthesis in hepatocyte nodules: selective proliferative stimulus induced by fumonisin B1.Toxicology, 200, 69-75.
Westhuizen, L., Shepard, G.S., Scussel, V.M., Costa, L.L.F., Vismer, H.F., Rheeder, J.P. e Marasas, W.F.O. (2003). Fumonisin contamination and Fusarium incidence in corn from Santa Catarina, Brazil. J. Agric. Food Chem., 51, 5574-5578.
WHO. (2002). Evaluation of certain mycotoxins in food. Report of the 56th meeting of the joint FAO/WHO expert committee on food additives. WHO technic report series 906. Geneve, Switzerland: WHO.
Williams, L.D., Bacon, C.W., Meredith, F.I., Franzluebbers, A.J., Wyatt, R.D., Smith, M.A. e Riley, R.D. (2003). Leaching and biding of fumonisins in soil microcosms. J. Agric. Food. Chem., 51, 685-690.
Woloshuk, C.P. e Shim, W. (2001). Regulation of fumonisin B1 biosynthesis and conidiation in Fusarium verticillioides by a cyclin-like(C-type) gene, FCC. Appl. Environ. Microbiol., 67(4), 1607-1612.
Wu, F. (2004). Mycotoxin risk assessment for the purpose of setting international regulatory standards. Environ. Sci. Technol., 38(15), 4049-4055.
Xie, W., Mirocha, C.J. e Chen, J. (1997). Detection of two naturally occurring structural isomers of partially hydrolysed fumonisin B1 in corn by On-Line Capillary Liquid Chromatography– Fast Atom Spectrometry. J. Agric. Food Chem., 45, 1251-1255.
As micotoxinas, metabolitos fúngicos secundários presentes numa grande parte de alimentos, além de provocarem grandes perdas económicas para os produtores de cereais e processadores de alimentos, representam um sério risco para a saúde humana e animal. A microflora está estimada entre 200.000 e 300.000 espécies, tendo sido identificadas mais de 400 micotoxinas.
A produção mundial anual de cereais excede os 160 kg per capita, com tendência para aumentar, mas estima- se que cerca de 10 a 30% dos grãos colhidos se percam por infecções promovidas pelo desenvolvimento de fungos. A FAO/WHO (Food and Agriculture Organization of the United Nations/World Health Organization) estima que, em todo o mundo, cerca de 25% das colheitas de alimentos estão afectadas por micotoxinas (Cirillo et al., 2003).
Cinco tipos de micotoxinas são considerados económica e toxicologicamente importantes: aflatoxinas (AFs), ocratoxina A (OTA), tricotecenos (desoxinivalenol (DON), nivalenol (NIV) e HT2-toxina (HT-2)), zearalenona (ZEA) e fumonisinas (FB1, FB2) (Charmley et al., 1994).
As fumonisinas são produzidas por espécies do género Fusarium (Charmely et al., 1994). Os membros pertencentes a este género são economicamente importantes uma vez que são fungos patogénicos para plantas, causando, todos os anos, vastos prejuízos, nomeadamente em culturas de milho e de sorgo (Jurgenson et al., 2002). O interesse sobre as fumonisinas tem aumentado e, a nível mundial, continuam a realizar-se investigações para melhor as conhecer, bem como aos prejuízos por elas provocados. Este grande interesse deve-se a duas razões fundamentais: ao facto das fumonisinas se encontrarem em concentrações mensuráveis no milho e ao facto de estudos epidemiológicos realizados as associarem ao cancro esofágico (EC) em humanos (Fumonisins Page).
A produção de fumonisinas está restringida a duas espécies da secção Liseola (uma secção separa espécies dum género grande em unidades mais pequenas com características semelhantes) (Thiel et al., 1991). As espécies de Fusarium produtoras de fumonisinas são o Fusarium verticillioides (Sacc.) Nirenberg (sinónimo de Fusarium moniliforme Sheldon, teleomorfo Giberella moniliformes, sinónimo Giberella fujikuroi) (Woloshuk e Shim, 2001) e o Fusarium proliferatum (T. Matsushima) Nirenberg. Ambas as espécies são isoladas no milho, sendo a primeira a mais prevalente (Scott e Lawrence, 1995).
1. Características fisico-químicas
As fumonisinas B1 (FB1) e B2 (FB2) foram isoladas de culturas de Fusarium moniliforme MRC 826 por Gelderblom et al., investigadores do South African Medical Research Council, em 1988 (Gelderblom et al., 1988; Shephard et al., 2000; Nelson et al., 1993; Fumonisins Page). Vinte anos de investigação na possível causa para a elevada incidência de EC na região de Transkei (África do Sul) culminaram com esta descoberta (Nelson et al., 1993).
Em 1998 Bezuidenhout et al. elucidaram a estrutura das FB1 e FB2 . No curto espaço de tempo entre a descoberta destas micotoxinas e a ocorrência de epidemias, como a leucoencefalomalacia (ELEM) e edema pulmonar (PPE) em cavalos e porcos, observou-se uma explosão no seu estudo, bem como no estudo de Fusarium spp. (Fumonisins Page).
Existem diferentes séries de fumonisinas, estruturalmente relacionadas: A (A1- A4), B (B1- B4), C (C1- C4, seguindo-se a FB2 e a FB3 (Labuda et al., 2003), sendo também considerada a mais tóxica.
A FB1, segundo Bezuidenhout et al. (1988), é um diéster de propano-1,2,3-ácido tricarboxílico e 2S-amino- 12S,16R-dimetilo-3S,5R,10R,14S,15R-pentahidroxieicoisano, em que os grupos hidroxilos em C14 e C15 estão esterificados com um grupo carboxilo terminal do ácido tricarboxílico (Sydenham et al., 1995; Kim et al., 2003). As FB2-B4 apresentam padrões diferentes de hidroxilação (Figura 1).

A FB2 não possui o grupo hidroxilo em C10, enquanto que a FB3 não apresenta o grupo hidroxilo em C5. Algumas amostras de milho também possuem FB4 verificando- se, neste caso, a ausência de grupos hidroxilos em ambos os carbonos (C5 e C10) (Seo e Lee, 1999).
As fumonisinas da série A são n-acetiladas e ocorrem apenas em pequenas concentrações (Nelson et al., 1993). A série C é quimicamente semelhante à série B, com a excepção de não possuir o grupo metilo terminal em C1 (Seo e Lee, 1999).
A ocorrência natural de FA1, FB4 e da série C nunca foi referida (Seo e Lee, 1999). Segundo Plattner et al., (1992) as fumonisinas da série A podem ser artefactos criados durante o isolamento inicial das fumonisinas. A quantidade de fumonisinas hidrolisadas (HFBs) e parcialmente hidrolisadas (PHFBs) em milho naturalmente contaminado é bastante inferior relativamente à quantidade de fumonisinas intactas. As fumonisinas hidrolisadas não apresentam os dois grupos de ácido tricarboxílico que nas fumonisinas intactas se encontram esterificados em C14 e C15; as fumonisinas parcialmente hidrolisadas apresentam apenas um grupo de ácido tricarboxílico. Os métodos utilizados nos processos de fabrico de produtos derivados do milho podem converter fumonisinas intactas em fumonisinas hidrolisadas e parcialmente hidrolisadas (Polling e Plattner, 1999).
As fumonisinas são moléculas fortemente polares, solúveis em água e acetonitrilo e insolúveis em solventes orgânicos (Pozzi et al., 2002).
2. Mecanismo de acção Em todas as espécies de animais estudadas verificouse que a absorção das fumonisinas no tubo digestivo é diminuta, sendo rapidamente eliminadas. O fígado e o rim são os órgãos que retêm a maior parte das fumonisinas absorvidas (FAO/WHO, 2001; Williams et al., 2003).
O modo de acção das fumonisinas relaciona-se com a sua interferência com o metabolismo da esfingosina - esfinganina (So - Sa) (Cirillo et al., 2003), perturbando o metabolismo dos esfingolípidos (Turner et al., 1999).
Os esfingolípidos estão presentes nas membranas celulares, desempenhando um papel fundamental na regulação celular e no controlo de proteínas membranares, mediando o crescimento celular, a diferenciação e a morte das células (Turner et al., 1999). Os esfingolípidos mais simples são as bases esfingóides. Nas células dos mamíferos as bases esfingóides mais comuns são a esfingosina e a esfinganina. Normalmente a concentração de esfingosina é 3 a 5 vezes mais elevada do que a de esfinganina (Riley et al., 1994).
Em estudos in vivo e in vitro foi demonstrado que as fumonisinas, com excepção da série A, são potentes inibidores competitivos da esfinganina N-aciltransferase e da esfingosina N-aciltransferase (ceramida sintetase) uma vez que, estruturalmente, são análogas de bases esfingóides. As enzimas anteriormente referidas são elementos chave para a via metabólica da biossíntese dos esfingolípidos de novo e turnover dos mesmos. Deste modo, as fumonisinas podem alterar a concentração e a proporção entre a esfinganina e a esfingosina, diminuindo a biossíntese de esfingosina e acumulando esfinganina (Riley et al., 1994; Turner et al., 1999; Desai et al., 2002, Carratù et al., 2003) (Figura 2).

Figura 2 – Modo de acção das fumonisinas
Podem também bloquear a biossíntese de esfingolípidos complexos em células eucarióticas. Os esfingolípidos complexos desempenham funções muito importantes a nível membranar, estando também na base da formação de mensageiros secundários que controlam diferentes processos celulares, incluindo a expressão genética e a activação/desactivação de proteínas específicas (Riley et al., 1994). Assim, estas micotoxinas contribuem para uma variedade de consequências a nível celular, como sejam a indução da apoptose e efeitos carcinogénicos (Turner et al., 1999; Momany e Dombrink-Kurtzman, 2001; Desai et al., 2002, Meyer et al., 2003).
3. Efeitos biológicos
A contaminação de alimentos e alimentos compostos com fumonisinas tem sido associada a doenças várias, quer em animais quer em humanos. As manifestações clínicas que decorrem das toxicoses provocadas pelas fumonisinas, bem como os órgãos atingidos variam de espécie para espécie. Nos cavalos conduzem ao aparecimento de leucoencefalomalacia (ELEM), em suínos provocam edema pulmonar (PPE). Em ovelhas, ratos e coelhos induzem a toxicidade renal, sendo também hepatotóxicas para os segundos. Outras espécies também são atingidas por toxicoses provocadas por estas micotoxinas.
Alguns efeitos anti-nutricionais e alterações fisiopatológicas em ratos adultos estão descritos, nomeadamente a redução da toma de folatos (Carratù et al., 2003). Também têm sido epidemiologicamente relacionadas com o EC nos humanos (Meyer et al., 2003). Estas micotoxinas são citotóxicas e inibem a síntese proteica e do DNA, promovem stress oxidativo, induzem a fragmentação do DNA e interrompem o ciclo celular (Creppy et al., 2004).
3.1. Animais
Todos os problemas causados estão relacionados com a inibição da biossíntese de esfingolípidos, sendo os órgãos mais afectados o fígado e o rim. Lesões mais avançadas de ambos os órgãos em ratos são caracterizadas por morte celular simultânea (apoptose) e proliferação celular (Voss et al., 2001).
Em animais de experimentação, a FB1 mostrou possuir um efeito promotor e iniciador de cancro, bem como actividade hepatocarcinogénica e nefrototóxica em ratos (Hopmans e Murphy, 1993; Shephard et al., 1996; Westhuizen et al., 2004). São ainda citadas a citotoxicidade em culturas de células de mamíferos e fitotoxicidade (Marasas, 1996; Bacon et al., 1992; Bacon et al., 1996).
A toxicidade que provocam nos animais domésticos está sobejamente referenciada: a ELEM, um síndroma que atinge o sistema nervoso central dos cavalos e que leva à liquefacção da substância branca do cérebro; o PPE que aparece secundariamente devido a problemas cardiovasculares (Turner et al., 1999; FAO/WHO, 2001; Kim et al., 2003; Seefelder et al., 2003); a indução de diarreia e redução do peso corporal em perus e frangos jovens (Sydenham et al., 1993; Shephard et al., 2000); a toxicidade renal em ovelhas, coelhos e ratos (Meyer et al., 2003). Em macacos verificou-se a indução de apoptose em células hepáticas (Wang et al., 1996), renais e quaisquer outras em que ocorre acumulação de esfinganina (e esfingosina) (Desai et al., 2002), tendo sido também observadas alterações a nível renal e alterações em parâmetros bioquímicos do sangue e da urina (Gelderblom et al., 2001).
Em 1991, Ross et al. analisaram alimentos compostos para avaliar os níveis de FB1 e efectuaram a associação com a ELEM e o PPE. Os alimentos compostos associadas à ELEM apresentavam concentrações de FB1 que variavam entre 1 μg/g e 126 μg/g. O teor de FB1 em alimentos compostos associados à PPE variava entre 1 μg/g e 330 μg/g.
3.2. Homem
Com base nos dados actuais, a Agência Internacional de Pesquisa sobre o Cancro (IARC) classificou a FB1 como possivelmente carcinogénica para o homem, incluindo-a no grupo 2B (IARC, 2002). Os níveis de fumonisinas em milho com fungos estão epidemiologicamente correlacionados com alta incidência de EC em humanos. Esta patologia tem sido referenciada em regiões da África do Sul, Transkei, dos EUA, Carolina do Sul, dos cantões Linxian e Cixian na China (Rheeder et al., 1992; Sydenham et al., 1991; Chu e Li, 1994; Shepard et al., 2000), na região meridional do Brasil (Santa Catarina, Paraná e Rio Grande do Sul) (Westhuizen et al., 2003), na província de Mazandaran do Irão (Shepard et al., 2000) e no nordeste de Itália (Piñeiro et al., 1997; Solfrizzo et al., 1997). Esses níveis são superiores a 118 μg/g em Transkei e a 155 μg/g na China (Munkvold e Desjardins, 1997; Turner et al., 1999).
As populações da África do Sul e da China apresentam os números mais elevados de EC do mundo. Enquanto no Ocidente o aparecimento deste tumor é atribuído a factores como o tabaco e álcool, nas regiões referidas estes factores não são considerados significativos (Turner et al., 1999).
As fumonisinas têm sido consideradas como suspeitas no aumento da incidência de alterações no tubo neural (NTD) entre a população que vive ao longo da fronteira Texas-México (Stack, 1998).
4. Interacção com outras micotoxinas
Diferentes micotoxinas, produzidas pela mesma ou por diferentes espécies fúngicas, ocorrem simultaneamente em produtos derivados de plantas. No entanto, existe pouca informação no que diz respeito à interacção de micotoxinas concomitantes e às consequências que daí advêm em relação à toxicidade (Speijers e Speijers, 2004).
Estudos adequados para estabelecer efeitos antagónicos, aditivos ou sinérgicos na exposição a micotoxinas combinadas são raros. Neste campo, é essencial perceber o modo de acção de cada micotoxina a nível celular para se compreender a interacção com a toxicidade de outras micotoxinas. Seria de esperar que micotoxinas com modos de acção semelhantes apresentassem, pelo menos, efeitos aditivos. Pelo contrário, algumas interacções podem apresentar efeitos subtractivos (Speijers e Speijers, 2004).
Como exemplo dum efeito subtractivo pode citar-se a interacção entre as esfingofunginas (inibidoras da serina palmitoil transferase fúngica) e as fumonisinas. Esta interacção previne a acumulação de bases esfingóides livres (Speijers e Speijers, 2004).
Infelizmente as micotoxinas não podem ser classificadas com base no seu mecanismo de acção dada a diversidade de estruturas químicas. No entanto, o conhecimento do modo de acção in vitro pode fornecer a base racional para predizer interacções entre micotoxinas (Speijers e Speijers, 2004).
Estas considerações teóricas, baseadas no modo de acção a nível celular, podem não conduzir a uma resposta final esperada, pois o comportamento toxicocinético e os aspectos toxicodinâmicos de cada uma influenciam o resultado da exposição a um conjunto combinado de micotoxinas (Speijers e Speijers, 2004).
Em estudos realizados com suínos desmamados, a administração combinada de fumonisinas, DON, toxina T2 com OTA deu origem, em geral, a alterações semelhantes às observadas aquando da administração de OTA isoladamente. Apenas se observou que ocorreu supressão na formação de radicais e anticorpos quando a OTA foi combinada com FB1 ou DON, o que não se verificou na administração isolada de OTA. A amplificação sinérgica de alterações imunossupressivas devido ao consumo simultâneo destas micotoxinas em baixas concentrações é pouco provável (Müller et al., 1999).
Groten et al. (1998) e Tajima et al. (2002) estudaram a interacção entre 5 tipos de micotoxinas (NIV, DON, toxina T2, ZEA e FB1) através da inibição da síntese de DNA em fibroblastos. Os resultados mostraram que a exposição combinada a diferentes classes de micotoxinas geralmente conduzem a um efeito aditivo, havendo algumas excepções que indicam interacção sinérgica. No entanto, a magnitude da interacção foi relativamente pequena para NIV, DON, T2, ZEA e FB1. A interacção entre ZEA e FB1 foi interpretada como sinérgica no que diz respeito à inibição da síntese de DNA.
Creppy et al. (2004) estudaram a interacção entre OTA e FB1 em diferentes tipos de linhas celulares, in vitro, com o objectivo de prever a toxicidade in vivo. Os efeitos combinados de OTA e FB1 são claramente de natureza sinérgica in vitro, sendo as concentrações das micotoxinas testadas muito importantes para os resultados obtidos.
No entanto, Kubena et al. (1997) demonstraram, in vivo, efeitos aditivos entre FB1 e OTA através de estudos realizados com perus jovens.
O facto de se encontram interacções sinérgicas entre FB1 e OTA depende das doses usadas. O sinergismo na toxicidade de FB1 e OTA pode estar relacionado com a capacidade de ambas as toxinas produzirem espécies reactivas de oxigénio e à capacidade de comprometerem mais ou menos especificamente a síntese de proteínas e de macromoléculas celulares (Creppy et al., 2004).
5. Presença em alimentos
A incidência de fumonisinas verifica-se a nível mundial e é clara a sua presença em alimentos destinados a humanos e animais, dada a incidência destas micotoxinas no milho (Shepard et al., 1996), uma vez que cerca de 90% do F. moniliforme se encontra no referido cereal (Fumonisins Page).
A FB1 é a fumonisina predominante, encontrada no milho contaminado naturalmente, e constitui normalmente cerca de 70% da quantidade total de fumonisinas presentes (Polling e Plattner, 1999).
A primeira descrição da ocorrência natural de FB1 foi realizada por Sydenham et al. (1990) a partir de milho contaminado da região do Transkei, na África do Sul, que apresentava alta incidência de EC no Homem. Os níveis detectados nas amostras variavam entre 44 e 83 μg/g (Pozzi et al., 2002).
A relação entre o milho e o Fusarium moniliforme é uma relação endófita, trazendo benefícios para a planta. Assim, pode estimular o seu crescimento e desenvolvimento, uma vez que produz hormonas promotoras do seu crescimento, protege a planta contra outros agentes patogénicos ou insectos, reduz a infecção por Aspergillus flavus, reduzindo a produção de aflatoxinas e diminui a infecção por Fusarium graminearum (Munkvold e Desjardins, 1997).
Por outro lado, no milho, o Fusarium moniliforme pode provocar a decomposição do caule, da espiga e do grão. O vento, a chuva e os insectos podem conduzir à dispersão do fungo, podendo os insectos ser responsáveis por infecções entre culturas de anos diferentes. O fungo chega ao grão através das barbas, cresce através do pericarpo até ao seu interior. Ocasionalmente as hifas podem ser encontradas no embrião e endosperma. O pericarpo constitui, portanto, um meio de defesa, pelo que a sua danificação pode levar à contaminação do grão (Nelson, 1991).
5.1. Alimentos para animais
Em 1990 foi correlacionada a ocorrência de fumonisinas com o diagnóstico de ELEM na África do Sul, analisando amostras de milho contaminado com concentrações de FB1 que variavam de 37 a 122 μg/g (Pozzi et al., 2002). Nesse mesmo ano também se detectou a presença de FB1 e FB2 em amostras de milho destinados a cavalos e porcos nos Estados Unidos que apresentavam ELEM e PPE, respectivamente (Ross et al., 1990).
Na Tabela 1 mostram-se os níveis médios de fumonisinas associados a epidemias de ELEM.
Tabela 1 - Níveis médios de fumonisinas em alimentos compostos associados à ELEM (Thiel et al., 1992; Sydenham et al., 1992b)

Em 1997, Scudamore et al., analisaram a presença de micotoxinas em alimentos para animais domésticos. As fumonisinas foram encontradas em 30% das amostras testadas, com um máximo de 750 μg/g encontrado numa amostra de comida para gato. Os mesmos autores, em 1998, determinaram a quantidade de micotoxinas em alimentos compostos para animais. Relativamente às fumonisinas verificaram que estas ocorreram em todas as amostras, excepto em duas amostras de glúten, em concentrações que variavam entre 32 mg/kg e 8 mg/kg.
Em Portugal, entre 1996 e 1999, foi analisada a qualidade micológica de alimentos compostos para bovinos. No que respeita ao género Fusarium, este foi encontrado em 20% das amostras, o que corresponde a um ligeiro decréscimo da contaminação dos referidos alimentos relativamente a épocas anteriores, perspectivando, assim, uma evolução qualitativa positiva (Martins e Martins, 2001).
5.2. Alimentos destinados ao homem
Inúmeras publicações científicas traduzem as preocupações em avaliar os níveis de fumonisinas no milho e em alimentos contendo milho em diferentes países: nos EUA (Hopmans e Murphy, 1993), na fronteira Texas- México (Stack, 1998), na África do Sul (Sydenham et al., 1990; Sydenham et al., 1991; Sydenham et al., 1992a), no Brasil (Westhuizen, et al., 2003; Castro et al., 2004; Bittencourt et al., 2005), na Argentina (Sydenham et al., 1993), na Suíça (Pittet et al., 1992; Xie et al., 1997), no Irão (Shephard et al., 2000), no México (Dombrink-Kurtzman e Dvorak, 1999; Cortez-Rocha et al., 2003), na zona oeste do Quénia (Kedera et al., 1999), em Itália (Cirillo et al., 2003), em Espanha (Castellá et al., 1999), no Uruguai (Piñeiro et al., 1997), no Canadá (Lombaert et al., 2003), na Croácia (Domijan et al., 2003), em França (Molinié et al., 2005) e na Nigéria (Bankole e Mabekoje, 2004).
Na Tabela 2 podem observar-se os níveis de fumonisinas em alimentos de diferentes países.
Scudamore e Patel (2000) mostraram que a contaminação por FB1 decresce com o aumento da latitude. Em particular, amostras do sul de França e Espanha, apresentavam maior concentração de FB1 do que amostras do norte de França. Investigações realizadas na Europa do Sul revelaram que o Fusarium verticillioides é o fungo predominante do milho e que o Fusarium proliferatum é frequentemente encontrado com o primeiro. Por outro lado, na Europa Central e do Norte os fungos prevalecentes são: F. graminearum, F. culmorum e F. subglutinans. Sendo o Fusarium verticillioides e o Fusarium proliferatum os principais produtores de FB1, a sua presença no Sul da Europa explica a elevada concentração desta micotoxina nesta zona do planeta (Pietri et al., 2004).
Especial atenção deve ser dada à presença de fumonisinas na dieta de populações vulneráveis, como são as crianças, atendendo a que os alimentos à base de cereais são uma importante fonte nutritiva da sua dieta, que a quantidade que consomem é proporcionalmente mais elevada, em relação ao seu peso corporal, do que os adultos, que a sua dieta é mais limitada e que a sua fisiologia é algo diferente (Lombaert et al., 2003).
6. Processos de descontaminação
A extensão da contaminação do milho bruto com fumonisinas está dependente de diversos factores como a localização geográfica, as práticas agronómicas e de conservação, a vulnerabilidade das plantas à invasão por fungos durante todas as fases de crescimento, conservação e processamento. Os níveis de fumonisinas são também influenciados por factores ambientais como temperatura, humidade e chuva durante os períodos de pré-colheita e colheita e pela infestação com insectos (USFDA-CFSAN, 2001a).
Existem diferentes métodos de descontaminação: físicos, químicos e biológicos. Porém, de acordo com a European Mycotoxin Awareness Network (EMAN) (EMAN, 2000), o processo ideal de descontaminação deve ser fácil de usar, económico, não deve dar origem à formação de compostos que ainda apresentem toxicidade, ou alterar as propriedades nutricionais e a palatibilidade do grão e respectivos derivados.
O grau de descontaminação depende do método usado e da toxicidade que subsiste na amostra tratada (Soriano e Dragacci, 2004). Pode ocorrer redução do teor de fumonisinas, mas não se registar diminuição da toxicidade devido a alterações nas moléculas das fumonisinas (Munkvold e Desjardins, 1997).
6.1. Físicos
As fumonisinas são de difícil eliminação. Nos alimentos processados à base de milho, os níveis de fumonisinas estão dependentes dos processos de moagem e de manufactura a que o milho em bruto é submetido.
A eliminação do germe e ou do pericarpo pode dar duranorigem a teores inferiores de fumonisinas uma vez que estas se concentram no germe e no pericarpo (USFDACFSAN, 2001b). Este processo pode ser considerado um procedimento preliminar na descontaminação de fumonisinas, que pode reduzir o seu conteúdo entre 26,2% e 64,4% (Soriano e Dragacci, 2004).

A moagem seca ou húmida pode reduzir o teor de fumonisinas nos alimentos (Soriano e Dragacci, 2004). Na moagem seca verifica-se um aumento da concentração de fumonisinas no pericarpo. Na moagem húmida as fumonisinas migram para a solução aquosa, sendo reduzida a sua concentração (EMAN, 2000).
Apesar das fumonisinas serem termicamente estáveis, temperaturas superiores a 150ºC são eficazes na remoção destas micotoxinas das amostras (Soriano e Dragacci, 2004). Mas a sua eficácia depende da relação tempo - temperatura. No entanto, estes processos térmicos de descontaminação resultam na conversão de fumonisinas intactas em fumonisinas hidrolisadas (Polling e Plattner, 1999) que são mais citotóxicas que as FB1 (Seefelder et al., 2003). Na preparação dos flocos, o teor em fumonisinas pode ser reduzido durante a extrusão do milho meio moído, da farinha de milho, da conversão em flocos e do tostar do milho (Kim et al., 2003). Também nas pipocas pode ocorrer redução significativa de fumonisinas, que podem estar presentes no grão inteiro (USFDA-CFSAN, 2001b).
Outro método físico de descontaminação envolve a utilização de materiais adsorventes com capacidade para se ligarem eficazmente às micotoxinas e imobilizarem- nas no tracto gastrointestinal dos animais, reduzindo a biodisponibilidade da toxina. Exemplos destes materiais são o carvão activado, a colestiramina (Soriano e Dragacci, 2004), o aluminosilicato de cálcio e sódio hidratado e a montmorilonite egípcia (Aly et al., 2004). Estes dois últimos adsorventes manifestaram capacidades de adsorção entre 88,2% e 92,5% para a FB1 presente em extractos de malte usado na indústria alimentar e em bebidas.
Outro método físico consiste na utilização de radiação gamma, observando-se uma redução de cerca de 20% no conteúdo em FB1 e FB2 em amostras de milho, para intensidade de radiação da ordem de 15 kGy (Soriano e Dragacci, 2004).
6.2. Químicos
A lavagem com água ou com uma solução de bissulfito de sódio pode reduzir o teor de fumonisinas nos alimentos (Soriano e Dragacci, 2004). O recurso a solução saturada de cloreto de sódio pode originar perdas da ordem dos 86% em milho contaminado com FB1 (Shetty e Bhat, 1999).
O tratamento com hidróxido de amónio pode reduzir em 79% os níveis de FB1 em milho contaminado. A nixtamilização, que consiste no tratamento do milho com Ca(OH)2, pode reduzir a concentração de fumonisinas em cerca de 50% (Soriano e Dragacci, 2004). Este processo é usado na produção de masa usada na preparação de tortilla, substituto mexicano do pão e tiras de milho (Dombrink-Kurtzman et al., 2000 e Seefelder et al., 2003). Amra et al. (2003) encontraram perdas da ordem dos 66% aquando do processamento de tortilla. Porém, ambos os métodos conduzem ao aparecimento de fumonisinas hidrolisadas e parcialmente hidrolisadas - em que são removidos os dois ou apenas um grupo de ácido tricarboxílico da molécula de fumonisina, respectivamente - que continuam a exercer efeitos hepatotóxicos e nefrotóxicos (Polling e Plattner, 1999; Seefelder et al., 2003; Soriano e Dragacci, 2004). Uma combinação de métodos químicos - nixtamilização - e físicos - tratamento com temperaturas elevadas - pode reduzir a concentração de fumonisinas em 79% (Soriano e Dragacci, 2004).
O efeito tóxico da FB1 pode ser eliminado, em cerca de 95%, durante o processamento do milho por reacção entre a micotoxina e a frutose, já que a amina primária das fumonisinas pode reagir com o grupo carboxilo do açúcar redutor quando este é aquecido a 80ºC durante 48 horas, formando-se bases de Schiff que, posteriormente, se convertem em outros produtos de acastanhamento não enzimático destituídos de perigo (Seefelder et al., 2003; Soriano e Dragacci, 2004).
A ozonização foi tentada, mas a conversão da FB1 em 3-ceto FB1, composto dotado de toxicidade mais elevada, pôs de lado esta tentativa de oxidação (Soriano e Dragacci, 2004).
6.3. Biológicos
Os métodos físicos e químicos possuem grandes desvantagens, nomeadamente eficácia limitada, perda de nutrientes e alto custo, pelo que muitos investigadores são de opinião que a melhor solução para a descontaminação, no futuro, será a descontaminação por biodegradação.
A descontaminação de micotoxinas por processos biológicos tem enveredado pelo recurso a bactérias, iniciando-se esta nos anos sessenta, ou a processos fermentativos, em que o uso de leveduras se iniciou nos anos oitenta (Bata e Lásztity, 1999). Nos últimos tempos têm sido também referenciados o recurso a compostos presentes em extractos de plantas ou a modificações genéticas (Soriano e Dragacci, 2004).
Uma forma de controlar biologicamente o Fusarium moniliforme consiste na utilização de uma bactéria endófita, Bacillus subtilis, que reduz a acumulação de FB1 durante a fase do ciclo de vida do fungo em que não se observa infecção apesar deste estar presente. Tal facto observa-se uma vez que a bactéria compete com o fungo pelo mesmo nicho ecológico na planta (Bacon et al., 2001).
No caso das fumonisinas, foi tentado o uso da levedura Exophiala spinifer que promove a hidrólise da FB1 em aminopentol e ácido tricarboxílico, tendo também a capacidade de descontaminar o aminopentol com a libertação de CO2 (Soriano e Dragacci, 2004). A utilização de três variedades de Saccharomyces duranorigemte oito dias originou reduções de cerca de 28% para a FB1 e 17% para a FB2 (Bata e Lásztity, 1999).
Diversos compostos naturais de plantas podem ser usados. O majonósido-R2, saponina extraída de raízes e rizomas de Panax vietnamensis, diminui a actividade da FB1 como promotora de tumores em ratos. O eugenol, óleo presente no cravo da Índia, inibe o crescimento de Fusarium verticillioides e regula a produção de fumonisinas (Soriano e Dragacci, 2004). Diversos compostos fenólicos inibem o crescimento daquele fungo, reduzindo a produção de FB1 (Beekrum et al., 2003). O extracto de isoflavona de soja reduz a actividade hepatotóxica da FB1 em ratos devido à supressão da produção de prostaglandina que estimula a FB1 (Soriano e Dragacci, 2004).
O milho transgénico, milho Bt, expressa uma toxina de Bacillus thuringiensis (Bt) que aumenta a resistência da planta ao fungo uma vez que aumenta a resistência da mesma a insectos. A diminuição da infecção por Fusarium pode também dever-se ao aumento da expressão de proteínas anti-fúngicas específicas e metabolitos ou conseguir-se acentuando as próprias defesas da planta nos tecidos dos grãos. Outra estratégia de modificação genética consiste no uso de genes que codificam enzimas que degradam as fumonisinas. Estas enzimas foram identificadas em fungos isolados no milho, tendo os genes que as codificam sido clonados e colocados em milho transgénico (Duvick, 2001).
Não obstante a diversidade de métodos conducentes à descontaminação, os métodos de descontaminação in vitro não são necessariamente aplicáveis in vivo.
7. Avaliação do grau de exposição das populações
São preconizadas duas formas de avaliação da exposição de populações às fumonisinas. Uma consiste em calcular a respectiva ingestão diária tolerável (TDI), através dos níveis de fumonisinas ingeridos nos distintos itens alimentares. Um estudo de avaliação da contaminação do milho e de produtos à base de milho com fumonisinas, realizado a nível mundial sob orientação da “Commission on Food Chemistry of the International Union of Pure and Applied Chemistry”, concluiu que, na região de Transkei (África do Sul), o consumo diário de milho será de 460 g, enquanto na Alemanha e Reino Unido é apenas de 7 g e na Suíça de 4 g. Assim sendo, para indivíduos com um peso de 70 kg que ingerem milho com uma contaminação média de fumonisinas de 1,7 μg/g, na região de Transkei, e de 0,5 μg/g, na Europa, a ingestão diária provável (PDI) nessas populações é de 11,2 μg/kg peso corporal/dia, de 0,05 μg/kg peso corporal/dia e de 0,03 μg/kg peso corporal/dia em Transkei, na Alemanha e Reino Unido, e na Suíça, respectivamente (Shepard et al., 1996). De acordo com dados mais recentes, o consumo total de fumonisinas nas dietas europeias foi estimado em cerca de 1,4 μg/kg peso corporal/semana (EMAN, 2000).
Foi proposta uma TDI de 800 ng/kg p. c. para a FB1. O European Mycotoxin Awareness Network (EMAN, 2000) e a OMS (WHO, 2002) consideram que a ingestão diária máxima tolerável provisória (PMTDI) para humanos é de 2 μg/kg peso corporal/ dia para a FB1.
O Joint FAO/WHO Expert Committee on Food Additives fixou uma PMTDI de 2 μg/kg peso corporal para as FB1 e FB2 isoladas ou combinadas em alimentos para humanos (FAO/WHO, 2001) De acordo com esta recomendação, uma criança de 20 kg não deverá exceder uma dose diária de 40 μg (Molinié et al., 2005). Tendo em conta este valor e considerando que a TDI é de 0,8 μg/kg peso corporal/dia, esta ingestão nas populações dos países do norte da Europa é claramente inferior, enquanto que as populações do Brasil, China e África do Sul podem estar em risco (Shephard et al., 1996; Soriano e Dragacci, 2004).
Outra forma de avaliar a exposição das populações às fumonisinas consiste em avaliar os níveis de FB1 ou de biomarcadores adequados, como a proporção esfinganina/ esfingosina (Sa/So), nos fluidos biológicos, como urina e soro, e tecidos, que traduzem uma medida mais correcta da exposição às referidas micotoxinas (Shetty e Bhat, 1998; Solfrizzo et al., 1997; Turner et al., 1999). A urina é um indicador para monitorizar a exposição das populações às fumonisinas, tendo sido já demonstrada a sua excreção através da urina, por estudos toxicocinéticos (Shetty e Bhat, 1998). A determinação da proporção Sa/So, em fluidos biológicos, também permite avaliar a exposição à FB1, uma vez que esta provoca uma acumulação de Sa livre e um aumento da proporção Sa livre/So livre, por inibição das enzimas esfingosina e esfinganina N-aciltransferase (Solfrizzo et al., 1997; Castegnaro et al., 1998; Turner et al., 1999) (Figura 2). Como já foi anteriormente referenciado, nos mamíferos a quantidade de esfingosina é cerca de 3 a 5 vezes a de esfinganina livre e a manutenção de baixas concentrações de esfinganina livre e esfingosina livre é importante porque esses compostos têm actividade biológica intrínseca considerável (Riley et al., 1994).
Esta é uma área em que o nosso país não tem investido, apesar das preocupações subjacentes em países do continente europeu (Piñeiro et al., 1997; Solfrizzo et al., 1997), americano (Westhuizen et al., 2003; Rheeder et al., 1992), africano (Sydenham et al., 1991; Shepard et al., 2000) e asiático (Chu e Li, 1994; Shepard et al., 2000) em consequência da correlação encontrada entre a presença de elevados teores das referidas fumonisinas nos alimentos e o seu aparecimento na urina (Shetty e Bhat, 1998) e uma proporção elevada de Sa/ So, bem como com o aparecimento de EC (Kim et al., 2003; Solfrizzo et al., 1997; Turner et al., 1999).
8. Legislação
Não existe uma legislação global para regular os níveis permitidos de fumonisinas no milho e em produtos processados a partir do mesmo. Mais de 90 países apresentam regulamentação própria ou níveis máximos para algumas micotoxinas, dependendo do tipo de matriz.
Na Suíça foi estabelecido um limite máximo de 1 mg/kg para a soma da FB1 e FB2 em milho para consumo humano (Shephard et al., 2000) e, em 1997, o “Swiss Federal Office of Public Health” estabeleceu um valor de tolerância de 1,0 μg/kg para as FB1 e FB2 em produtos processados a partir do milho seco (Cirillo et al., 2003; Soriano e Dragacci, 2004).
O “French Council of Public Hygiene” recomendou um valor máximo de 3,0 mg/kg para as FB1 e FB2 em cereais. A US-FDA, em 2000, aconselhou níveis de 2-4 μg/g, que foram considerados em Itália como limites de referência (Cirillo et al., 2003).
A Eslováquia estabeleceu limites no milho contaminado, não devendo exceder 100-200 μg/kg (Labuda et al., 2003).
A Food and Drug Administration (FDA) recomenda níveis máximos de fumonisinas de 1, 10, 30, 50 e 15 mg/kg na ração total de cavalos, suínos, ruminantes, aves e vacas leiteiras, respectivamente (USFDA-CFSAN, 2001c).
A legislação portuguesa não contempla limites para os níveis de fumonisinas em alimentos destinados a humanos e animais.
A FDA considera que os níveis recomendados para as fumonisinas no milho e derivados para consumo humano são uma medida prudente para a Saúde Pública (USFDA-CFSAN, 2001b).
Segundo dados do Jornal Oficial da União Europeia, a recomendação da Comissão de 17 de Fevereiro de 2004 refere que, embora já exista uma directiva que regula os teores máximos de aflatoxina B1 nos alimentos para animais, não existe regulamentação comunitária para as demais micotoxinas, como é o caso das fumonisinas. Assim a Comissão recomendou que os estados membros realizassem durante o ano de 2004 um programa coordenado de controlo destinado a verificar a concentração de micotoxinas em alimentos para animais indicando a metodologia de análise (Jornal Oficial da União Europeia, 2004).
Até à data a Comissão Europeia recomendou, mas não legislou, níveis máximos de FB1+FB2 que variam entre 2000 μg/kg em milho não processado e 100 μg/kg em alimentos infantis (Soriano e Dragacci, 2004).
O relatório do “Council for Agricultural Science and Technology” estabelece que um dos objectivos para o século XXI é o desenvolvimento de uma legislação uniforme, a nível mundial, para a contaminação dos alimentos por micotoxinas. Os objectivos serão a identificação das nações que seriam sujeitas a um maior impacto, caso se estabelecesse legislação mais rígida, e a avaliação dos benefícios para a saúde humana, bem como os prejuízos a nível económico, caso se optasse por tal. Estes padrões legislativos levariam a que, entre as nações industrializadas, fossem os Estados Unidos a experimentar maiores perdas económicas. As condições ambientais dos países em desenvolvimento são, no entanto, mais favoráveis à acumulação de micotoxinas. Contrariamente às preocupações expressas pelos legisladores, não seriam os países menos desenvolvidos, como as nações africanas sub-sarianas, a experimentar as maiores perdas económicas, mas antes a China e a Argentina. Se fosse implementado a nível mundial um limite de 0,5 mg/kg para as fumonisinas, o prejuízo total nas exportações, devido à contaminação do milho por fumonisinas, excederia os 300 milhões de dólares/ano. Caso se adoptassem os limites menos restritivos dos Estados Unidos, 2 mg/kg, os prejuízos seriam 3 vezes inferiores (Wu, 2004).
9. Conclusões
Conhecidas por poderem exercer efeitos sinérgicos in vivo, o controlo de fumonisinas em alimentos e em fluídos biológicos das populações é útil para uma melhor avaliação do risco para a saúde humana e animal.
As avaliações da exposição das populações às fumonisinas, através dos alimentos ingeridos e da respectiva presença nos líquidos biológicos são imprescindíveis para a investigação epidemiológica e monitorização da Saúde Pública.
Os processos de descontaminação a utilizar nos itens alimentares apresentam eficácias muito diversificadas.
Apesar de em algumas sociedades a exposição ser baixa, a investigação e a implementação de medidas legislativas são necessárias para se diminuir a exposição das comunidades urbanas e rurais, especialmente as de tenra idade, e daquelas em que se verifica uma dieta excessivamente rica em milho.
Agradecimentos
Os autores agradecem à FCT e FEDER (POCTI) a bolsa de doutoramento concedida a Liliana J. G. Silva.
Bibliografia
Aly, S.E., Abdel-Galil, M. e Abdel-Wahhab, M.A. (2004). Application of adsorbent agents technology in the removal of aflatoxin B1 and fumonisin B1 from malt extract. Food Chem. Toxicol., 42, 1825-1831.
Amra, H.A., Enein, A.A., Ragab, A.A., Ayesh, A.M. e Mohamed, M.I. (2003). Effect of tortilla processing on fumonisin B1 destruction. Toxicology Letters, 144, Supplement 1, s62.
Bacon, C.W., Bennett, R.M., Hinton, D.M. e Voss, K.A. (1992). Scanning electron microscopy of Fusarium moniliforme within asymptomic corn kernels and kernels associated with equine leukoencephalomalacia. Plant Disease, 76(2), 144-148.
Bacon, C.W. e Hinton, D.M. (1996). Fusaric acid and pathogenic interactions of corn and non-corn isolates of Fusarium moniliforme, a nonobligate pathogene of corn. In: Fumonisins in food; Advances in experimental medicine and biology v. 392, Jackson, L. S. De Vries, J. W., Bullerman, L. B., Eds; Plenum Press; New York, N.Y.; pp. 1-18.
Bacon, C.W., Yates, I.E., Hinton, D.M. e Meredith, F. (2001). Biological control of Fusarium moniliforme in maize. Environ. Health Perspectives, 109 (suppl. 2), 325-332.
Bankole, S.A e Mabekoje, O.O. (2004). Occurrence of aflatoxins and fumonisins in preharvest maize from south-western Nigeria. Food Add. Contam., 21, 251-255.
Bata, Á. e Lásztity, R. (1999). Detoxification of mycotoxin-contaminated food and feed by microorganisms. Trends in Food Science & Technol. 10, 223-228.
Beekrum, S., Govinden, R., Padayachee e Odhav, B. (2003). Naturally occurring phenols: a detoxification strategy for fumonisin B1. Food Add. Contam., 20(5), 490-493.
Bezuidenhout, G.C., Gelderblom, W.C.A., Gorst-Allman, C.P., Horak, R.M., Marasas, W.F.O., Spiteller, G. e Vleggaar, R. F (1988). Structure elucidation of the fumonisins, mycotoxins from Fusarium moniliforme. J. Chem. Soc., Chem. Commun., 11, 743-745.
Bittencourt, A.B.F., Oliveira, C.A.F., Dilkin, P. e Corrêa, B. (2005). Mycotoxin occurrence in corn meal and flour traded in São Paulo, Brazil. Food Control, 16, 117-120.
Carratù, M.R., Cassano, T., Coluccia, A., Borracci P. e Cuomo, V. (2003). Antinutritional effects of fumonisin B1 and pathophysiological consequences. Toxicology Letters, 140-141, 459-463.
Castegnaro, M., Garren, L., Galendo, D., Gelderblom, W.C.A., Chelule, P., Dutton, M.F., Wild, C.P. (1998). Analytical method for the determination of sphinganine and sphingosine in serum as a potential biomarker for fumonisin exposure. J. Chromatography. B, 720, 15-24.
Castellá, G., Bragulat, M.R. e Cabañes, F.J. (1999). Surveillance of fumonisins in maize-based feeds and cereals from Spain. J. Agric. Food Chem. , 47, 4707-4710.
Castro, M.F.P.M., Shephard, G.S., Sewram, V., Vicente, E., Mendonça, T.A. e Jordan, A.C. (2004). Fumonisins in Brazilian corn-based foods for human consumption. Food Add. Contam., 21(7), 693-699(7).
Charmley, L.L., Rosenberg, A. e Trenholm, H.L. (1994). Factors responsible for economic losses due to Fusarium mycotoxin contamination of grain, foods and feedstuffs. in: Mycotoxins in Grains. Miller J.D. e Trenholm H. L. (eds). St. Paul, MN: Eagan Press. p471.
Chu, F.S. e Li, G.Y. (1994). Simultaneous occurrence of fumonisin B1 and other mycotoxins in moldy corn collected from the People’s Republic of China in regions with high incidences of esophageal cancer. Appl. Environ. Microbiol., 60(3), 847-852.
Cirillo, T., Ritieni, A., Galvano, F. e Cocchieri, R.A. (2003). Natural co-occurrence of deoxynivalenol and fumonisins B1 and B2 in Italian marketed foodstuffs. Food Add. Contam., 20(6), 566-571.
Cortez-Rocha, M.O., Ramírez-Astudillo, W.R., Sánchez-Mariñez, R.I., Rosas-Burgos, E.C., Wong-Corral, F.J., Borboa- Flores, J., Castillón-Campaña, L.G- e Tequida-Meneses, M. (2003). Fumonisins and fungal species in corn from Sonora, Mexico. Bull. Environ. Contam. Toxicol., 70: 668-673.
Creppy, E.E., Chiarappa, P., Baudrimont, I., Borracci, P., Moukha, S. e Carratú, M.R. (2004). Synergistic effects of fumonisin B1 and ochratoxin A: are in vitro cytotoxicity data predictive of in vivo acute toxicity? Toxicology, 201(1-3), 115-123.
Desai, K., Sullards, M.C., Allegood, J., Wang, E., Schmelz, E.M., Hartl, M., Humpf, H-U., Liotta, D.C., Peng, Q. e Merrill, Jr, A.H. (2002) Fumonisins and fumonisin analogs as inhibitors of ceramide synthase and inducers of apoptosis. Biochimica et Biophysica Acta 1585, 188-192.
Doko, M.B., Rapior, S., Visconti, A. e Schjøth, J.E. (1995). Incidence and levels of fumonisin contamination in maize genotypes grown in Europe and Africa. J. Agric. Chem., 43, 429-434.
Dombrink-Kurtzman, M.A. e Dvorak, T.J. (1999). Fumonisin content in masa and tortillas from Mexico. J. Agric. Food Chem., 47, 622-627.
Dombrink-Kurtzman, M.A., Dvorak, T.J., Barron, M.E. e Rooney, L.Y. (2000). Effect of nixtamilization (alkaline cooking) on fumonisin-contaminated corn for production of masa and tortillas. J. Agric. Food. Chem., 48, 5781-
5786.
Domijan, A.-M., Peraica, M., Fuchs, R., Luci??, A., Radi??, B., Jurjevi??, Ž. e Cvjetkovi??, B. (2003). Screening for fumonisins B1 and B2 in corn collected in Republic of Croatia.
Toxicology Letters, 144, Supplement 1, s64.
Duvick, J. (2001). Prospects for reducing fumonisin contamination of maize through genetic modification. Environ. Health Perspectives, 109 (suppl. 2), 337-342.
EMAN (2000). European Mycotoxin Awareness Network (http:// www.mycotoxins.org). 7-04-2004 FAO/WHO (2001). Fifty-sixth meeting, Geneva, Summary and conclusions (http://www.who.int/pcs/jecfa/summary56.
pdf) 14-09-2003.
Fumonisins Page: (http://www.ansci.cornell.edu/courses/as625/ 1997term/Park) 12-09-2003. Fumonisins: (http://micotoxinas.com.br/fumofacts.htm) 13-09- 2003
Gelderblom, W.C.A., Jaskiewicz, K., Marasas, W.F.O., Thiel, P.G., Horak, R.M., Vleggaar, R., e Kriek, P.J. (1988). Fumonisins– novel mycotoxins with cancer promoting activity produced by Fusarium moniliforme. Appl. Environ. Microbiol., 54(7), 1806-1811.
Gelderblom, W.C.A., Seier, J.V., Snijman, P.W., Schalkwyk, D.J., Shephard, G.S. e Marasas, W.F.O. (2001). Toxicity of culture material of Fusarium verticillioides strain MRC 826 to nonhuman primates. Environ. Health. Perspectives, 109 (suppl. 2), 267-276.
Groten, J.P., Tajima, O., Feron, V.J. e Schoen, E.D. (1998). Statistically designed experiments to screen mixtures chemical mixtures for possible interactions. Environ. Health. Perspectives, 106 (suppl. 6), 1361-1365.
Gutema, T., Munimbazi, C. e Bllerman, L.B. (2000). Occurrence of fumonisins and moniliformin in corn and corn based food products of U.S. origin. J. Food Prot., 63(12), 1732- 1737.
Hopmans, E.C. e Murphy, P.A. (1993). Detection of fumonisins B1, B2, and B3 and hydrolysed fumonisin B1 in corn-containing foods. J. Agric. Food Chem., 41, 1655-1658.
IARC (International Agency For Research On Cancer) (2002). IARC Monographs on the evaluation of carcinogenic risks to humans. Volume 82: 301-366. Some traditional herbal medicines, some mycotoxins, naphthalene and styrene. IARC, Lyon France.
Jornal Oficial da União Europeia. Recomendação da Comissão de 17 de Fevereiro de 2004 relativa ao programa coordenado de controlo no domínio da alimentação animal para 2004, nos termos da Directiva 95/53/CE do Conselho.
Jurgenson, J.E., Zeller, K.A. e Leslie, J.F. (2002). Expanded genetic map of Gibberella moniliformis (Fusarium verticillioides). Appl. Environ. Microbiol., 68(4), 1972-1979.
Kedera, C.J., Plattner, R.D. e Desjardin, A.E. (1999). Incidence of Fusarium spp. and levels of fumonisin B1 in maize in western Kenya. Appl. Environ. Microbiol., 65 (1), 41-44.
Kim, E.–K., Scott, P.M. e Lau, B.P.–Y. (2003). Hidden fumonisin in corn-flakes. Food Add. Contam., 20(2), 161-169.
Kubena, L.F., Edrington, T.S., Harvey, R.B., Phillips, T.D., Sarr, A.B. e Rottinghaus, G.E. (1997). Individual and combined effects of fumonisin B1 present in Fusarium moniliforme culture material and diacetoxyscirpenol or ochratoxin A in turkey poults. Poultry Sci., 76, 256-264.
Labuda, R., Tancinova, D. e Hudec, K. (2003). Identification and enumeration of Fusarium species in poultry feed mixtures from Slovakia. Ann. Agric. Environ. Med, 10, 61-66.
Lombaert, G.A., Pellaers, P., Roscoe, V., Mankotia, M., Neil, R. e Scott, P.M. (2003). Mycotoxins in infant cereal foods from the Canadian retail market. Food Add. Contam., 20(5), 494-504.
Marasas, W.F.O. (1996). Fumonisins: history, world-wide occurrence and impact. in Fumonisins in food; Advances in experimental medicine and biology v. 392, Jackson, L.S., De Vries, J.W., Bullerman, L.B., Eds; Plenum Press; New York, N.Y.; pp. 1-18.
Martins, H.M. e Martins, M.L. (2001). Qualidade micológica de rações para bovinos (Portugal: 1996-1999). Rev. Port. Ciências Vet., 96(538), 85-88.
Martins, M.L., Martins, H.M. e Bernardo, F. (2001). Fumonisins B1 and B2 in black tea and medicinal plants. J. Food Prot., 64(8), 1268-1270.
Meyer, K., Mohr, K., Bauer, J., Horn, P. e Kovács, M. (2003). Residue formation of fumonisin B1 in porcine tissues. Food Add. Contam., 20(7), 639-647.
Molinié, A., Faucet, V., Castegnaro, M. e Pfohl-Leskowicz, A. (2005). Analysis of some breakfast cereals on the French market for their contents of ochratoxin A, citrinin and fumonisin B1: development of a method for simultaneous extraction of ochratoxin A and citrinin. Food Chem. 92, 391-400
Momany, F.A. e Dombrink-Kurtzman, M.A. (2001). Molecular dynamics simulations on the mycotoxin fumonisin B1. J. Agric. Food Chem., 49, 1056-1061.
Müller, G., Kielstein, P., Rosner, H., Berndt, A., Heller, M. e Kohler, H. (1999). Studies on the influence of combined administration of ochratoxin A, fumonisin B1, deoxynivalenol and T2 toxin on immune defence reactions in weaner pigs. Mycoses, 42(7-8), 485-493.
Munkvold, G.P. e Desjardin, A.E. (1997). Fumonisins in maize– Can we reduce their occurrence? Plant Disease, 81(6), 556-565.
Nelson, P.E. (1991). Taxonomy and biology of Fusarium moniliforme. Mycopathologia, 117, 29-36.
Nelson, P.E., Desjardin, A.E. e Plattner, R.D. (1993). Fumonisins mycotoxins produced by Fusarium species: biology, chemistry and significance. Annu. Rev. Phytopathol., 31, 233-252.
Omurtag, G.Z. e Yazicioglu, D. (2004). Determination of Fumonisins B1 and B2 in herbal tea and medicinal plants in Turkey by high-performance liquid chromatography. J. Food Prot., 67(8), 1782-1786.
Pietri, A., Bertuzzi, T., Pallaroni, L. e Piva, G. (2004). Occurrence of mycotoxins and ergosterol in maize harvested over 5 years in Northern Italy. . Food Add. Contam., 21(5), 479- 487.
Piñeiro, M.S., Silva, G.E., Scott, P.M., Lawrence, G.A. e Stack, M.E. (1997). Fumonisins levels in Uruguayan corn products. J. AOAC Int., 80(4), 825-828.
Pittet, A., Parisod, V. e Schellenberg, M. (1992). Occurrence of fumonisin B1 and B2 in corn-based products from the Swiss market. J. Agric. Food Chem., 40, 1352-1354.
Plattner, R.D., Weisleder, D., Shackelford, D.D., Peterson, R. e Powell, R.G. (1992). A new fumonisin from solid cultures of Fusarium moniliforme. Mycopathologia, 117, 23-28.
Poling, S.M. e Plattner, R.D. (1999). Rapid purification of fumonisins and their hydrolysis products with solid-phase extraction columns. J. Agric. Food Chem., 47, 2344-2349.
Pozzi, C.R., Arcaro, J.R.P., Júnior, I.A., Fagundes, H. e Corrêa, B. (2002). Aspectos relacionados à ocorrência e mecanismo de ação de fumonisinas. Ciência Rural, 32(5), 901- 907.
Rheeder, J.P., Marasas, W.F.O., Thiel, P.G, Sydenham, E.W., Shephard, G.S. e van Schalkwyk, D.J. (1992). Fusarium moniliforme and fumonisins in corn related to human esophageal cancer in Transkei. Phytophathology, 82, 353- 357.
Riley, R.T., Wang, E. e Merrill, A.H. (1994). Liquid chromatographic determination of sphinganine and sphingosine: use of the free sphinganine-to-sphingosine ratio as a biomarker for consumption of fumonisins. J. AOAC Int., 77(2), 533- 540.
Ross, P.F., Nelson, P.E., Richard, J.L., Osweiler, G.D., Rice, L.G., Plattner, R.D. e Wilson, T.M. (1990). Production of fumonisins by Fusarium moniliforme and Fusarium proliferatum isolates associates with equine leucoencefalomalacia and pulmonary edema syndrome in swine. Appl. Environ. Microbiol, 56(10), 3225-3226.
Ross, P.F., Wilson, T.M., Owens, D.L., Nelson, H.A. e Richard, J.L. (1991). Concentrations of fumonisin B1 in feeds associated with animal health problems. Mycopathologia, 114, 129-135.
Scott, P.M. e Lawrence, G.A. (1995). Analysis of beer for fumonisins. J. Food Protection 58 (12), 13791382. Scudamore, K.A., Nawaz, S. e Hetmanski, M.T. (1997). Determination of mycotoxins in pet foods sold for domestic pets and wild birds using linked-column immunoassay cleanup and HPLC. Food Add. Contam., 14(2), 175-186.
Scudamore, K.A., Nawaz, S. e Hetmanski, M.T. (1998). Mycotoxins in ingredients of animal feeding stuffs: II. Determination of mycotoxins in maize and maize products. Food Add. Contam., 15(1), 30-55.
Scudamore, K.A. e Patel, S. (2000). Survey for aflatoxins, ochratoxin A, zearalenone and fumonisins in maize imported into the United Kingdom. Food Add. Contam., 17(5), 407- 416.
Seefelder, W., Knecht, A. e Humpt, H.–U. (2003). Bound fumonisin B1: analysis of fumonisin-B1 glyco and amino acid conjugates by Liquid Chromatography – Electrospray Ionization – Tandem Mass Spectrometry. J. Agric. Food Chem., 151, 5567-5573.
Seo, J.–A. e Lee, Y.–W. (1999). Natural occurrence of the C series of fumonisins in moldy corn. Appl. Environ. Microbiol., 65(3), 1331-1334.
Shephard, G.S., Marasas, W.F.O., Leggott, N.L., Yasdanpanah, H., Rahimian, H. e Safavi, N. (2000). Natural occurrence of fumonisins in corn from Iran. J. Agric. Food Chem., 48, 1860-1864.
Shephard, G.S., Thiel, P.G., Stockenström, S. e Sydenham, E.W. (1996). Worldwide survey of fumonisin contamination of corn and corn-based products. J. AOAC Int., 79(3), 671- 686.
Shetty, P.H. e Bhat, R.V. (1998). Sensitive method for the detection of fumonisin B1 in human urine. J. Chromatography B, 705, 171-173.
Shetty, P.H. e Bhat, R.V (1999). A physical method for segregation of fumonisin-contaminated maize. Food Chemistry 66, 371-374.
Solfrizzo, M., Avantaggiato, G. e Visconti, A. (1997). Rapid method to determine sphinganine/ sphingosine in human and animal urine as a biomarker for fumonisin exposure. J. Chromatography B, 692, 87-93.
Soriano, J.M. e Dragacci, S. (2004). Intake, decontamination and legislation of fumonisins in foods. Food Research International 37(4), 367-374.
Speijers, G.J.A. e Speijeirs, M.H.M. (2004). Combined toxic effects of mycotoxins. Toxicology Letters, 153, 91-98.
Stack, M.E. (1998). Analysis of fumonisin B1 and its hydrolysis product in tortillas. J. AOAC Int., 81(4), 737-740.
Sydenham, E.W., Gelderblom, W.C.A., Thiel, P.G e Marasas, W.F.O. (1990). Evidence for the natural occurrence of fumonisin B1, a mycotoxin produced by Fusarium moniliforme, in corn. J. Agric. Food Chem., 38, 285-290.
Sydenham, E.W., Shephard, G.S. e Thiel, P.G. (1992a). Liquid chromatographic determination of fumonisins B1, B2, and B3 in foods and feeds. J. AOAC Int., 75(2), 313-318.
Sydenham, E.W., Marasas, W.F.O., Shephard, G.S., Thiel, P.G. e Hirooka, E.Y. (1992b). Fumonisins concentrations in Brazilian feeds associated with field outbreaks of confirmed and suspected animal micotoxicoses. J. Agric. Food Chem., 40, 994-997.
Sydenham, E.W., Shephard, G.S., Thiel, P.G., Marasas, W.F.O. e Stockenström, S. (1991). Fumonisins contamination of commercial corn-based human foodstuffs. J. Agric. Food Chem., 39, 2014-2018.
Sydenham, E.W., Shephard, G.S., Thiel, P.G., Marasas, W.F.O., Rheeder, J.P., Sanhueza, C.E.P., González, H.H.L. e Resnik, S.L. (1993). Fumonisins in Argentinian field-trial corn. J. Agric. Food Chem., 41, 891-895.
Sydenham, E.W., Thiel, P.G., Shephard, G.S., Koch, K.R. e Hutton, T. (1995). Preparation and isolation of the partially hydrolysed moiety of fumonisin B1. J. Agric. Food Chem., 43, 2400-2405.
Tajima, O., Schoen, E.D., Feron, V.J. e Groten, J.P. (2002). Statistically designed experiments in a tiered approach to screen mixtures of Fusarium mycotoxins for possible interactions. Food and Chem. Toxicol., 40(5), 685-695.
Thiel, P.G., Marasas, W.F.O., Sydenham, E.W., Shephard, G.S., Gelderblom, W.C.A. e Nieuwenhuis, J.J. (1991). Survey of fumonisin production by Fusarium species. Appl. Environ. Microbiol, 57(4), 1089-1093.
Thiel, P.G., Marasas, W.F.O., Sydenham, E.W., Shephard, G.S. e Gelderblom, W.C.A. (1992). The implications of naturally occurring levels of fuminisins in corn for human and animal health. Mycopathologia, 117: 3-9.
Turner, P.C., Nikiema, P. e Wild, C.P. (1999). Fumonisin contamination of food: progress in development of biomarkers to better assess human health risks. Mutation Research, 443, 81-93.
USFDA-CFSAN (2001a). Fumonisin levels in human foods and animal feeds in http://www.cfsan.fda.gov/~dms/fumongu2. html 12-09-2003.
USFDA-CFSAN (2001b). Background paper in support of fumonisins levels in corn and corn products intended for human consumption. http://www.cfsan.fda.gov/~dms/fumongu3. html 12-09-2003.
USFDA-CFSAN (2001c). Background paper in support of fumonisin levels in animal feed: executive summary of this scientific support document” p. 18 cfsan.fda.gov/~dms/fumonbg4. html 12-09-2003.
Voss, K.A., Riley, R.T., Norred, W.P., Bacon, C.W., Meredith, F.I., Howard, P.C., Plattner, R.D., Collins, T.F.X., Hansen, D.K. e Porter, J.K. (2001). An overview on rodent toxicities: liver and kidney effects of fumonisins and Fusarium moniliforme. Environ. Health. Perspectives, 109 (suppl. 2), 259-266.
Wang, H., Jones, C., Cicci-Zanella, J., Holt, T., Gil Christ, D.C. e Dickman, M.B. (1996). Fumonisins and Alternaria alternatalycopersici toxins: sphinganine analog mycotoxins induce apoptosis in monkey kidney cells. Proc. Natl. Acad. Sci, 93, 3461-3465.
Weidenbörner, M. (2001). Foods and fumonisins. Eur. Food Res. Technol., 212: 262-273.
Westhuizen, L., Gelderblom, W.C.A., Shephard, G.S. e Swanevelder, S. (2004) Disruption of sphingolipid biosynthesis in hepatocyte nodules: selective proliferative stimulus induced by fumonisin B1.Toxicology, 200, 69-75.
Westhuizen, L., Shepard, G.S., Scussel, V.M., Costa, L.L.F., Vismer, H.F., Rheeder, J.P. e Marasas, W.F.O. (2003). Fumonisin contamination and Fusarium incidence in corn from Santa Catarina, Brazil. J. Agric. Food Chem., 51, 5574-5578.
WHO. (2002). Evaluation of certain mycotoxins in food. Report of the 56th meeting of the joint FAO/WHO expert committee on food additives. WHO technic report series 906. Geneve, Switzerland: WHO.
Williams, L.D., Bacon, C.W., Meredith, F.I., Franzluebbers, A.J., Wyatt, R.D., Smith, M.A. e Riley, R.D. (2003). Leaching and biding of fumonisins in soil microcosms. J. Agric. Food. Chem., 51, 685-690.
Woloshuk, C.P. e Shim, W. (2001). Regulation of fumonisin B1 biosynthesis and conidiation in Fusarium verticillioides by a cyclin-like(C-type) gene, FCC. Appl. Environ. Microbiol., 67(4), 1607-1612.
Wu, F. (2004). Mycotoxin risk assessment for the purpose of setting international regulatory standards. Environ. Sci. Technol., 38(15), 4049-4055.
Xie, W., Mirocha, C.J. e Chen, J. (1997). Detection of two naturally occurring structural isomers of partially hydrolysed fumonisin B1 in corn by On-Line Capillary Liquid Chromatography– Fast Atom Spectrometry. J. Agric. Food Chem., 45, 1251-1255.
Tópicos relacionados:
Autores:
Recomendar
Comentário
Compartilhar
Alberto Gimeno
11 de agosto de 2009
Exma. Dra. Celeste M.Lino,
Na parte do seu artigo que corresponde à “Legislação”, considero que teria sido importante incluir a RECOMENDAÇÃO DA COMISSÃO de 17 de Agosto de 2006 (Jornal Oficial da União Europeia, 2006/576/CE) sobre a presença de deoxinivalenol, zearalenona, ocratoxina A, toxinas T-2 e HT-2 e fumonisinas em produtos destinados à alimentação animal.
Mesmo que ainda não é legislação, eles recomendam para fumonisinas B1+B2 os seguintes valores máximos de orientação em mg/Kg (ppm) de alimento para animais, para um teor de humidade de 12[percent].
- Milho, produtos à base de milho, forragens de milho: 60 mg/Kg
Alimentos complementares e alimentos completos para:
- Suínos, cavalos (equídeos), coelhos e animais de companhia: 5 mg/Kg
- Peixes: 10 mg/Kg
- Aves de capoeira, vitelos (menos de 4 meses), borregos e cabritos: 20 mg/Kg
- Ruminantes adultos (mais de 4 meses) e martas: 50 mg/Kg
Estes dados são mais atuais que os referidos no seu artigo quando fala da Comissão Europeia e do Jornal Oficial da União Europeia
A Comissão Europeia informou que os Estados-Membros deviam aplicar os valores de orientação relativos às fumonisinas B1+B2 apenas a partir de 1 de Outubro de 2007, para coincidirem com as regras estabelecidas pelo Regulamento (CE) nº 856/2005 da Comissão, de 6 de Junho de 2005, que altera o Regulamento (CE) nº 466/2001 no que diz respeito às toxinas de Fusarium.
Cumprimentos.
Alberto Gimeno
Recomendar
Responder
Alberto Gimeno
11 de agosto de 2009
Exma. Dra. Celeste M. Lino,
Me esqueci de lhe informar que se deseja obter informação técnica (características físico-químicas, poder adsorvente, ensaios ..... etc.) acerca do Filosilicato purificado e modificado anteriormente mencionado, pode dirigir-se ao Sr. Fernando Tamames III da firma Special Nutrients (Estados Unidos de América).
Cumprimentos.
Alberto Gimeno
Recomendar
Responder
Alberto Gimeno
11 de agosto de 2009
Exma. Dra. Celeste M.Lino,
Parabéns pelo artigo e simplesmente gostaria referir que, respeitante à destoxificação das fumonisinas em porcos, por métodos físicos, e mais concretamente para fumonisina B1, considero que há um bom exemplo “In Vivo” com um Filosilicato purificado e modificado e cujos resultados estão publicados no meu artigo intitulado “As fumonisinas e seus efeitos indesejáveis na produção porcina” publicado em www.engormix.com (área de micotoxinas em português).
Poderá observar que esses estudos “In Vivo” foram realizados aplicando as excelentes qualidades adsorventes de micotoxinas, do mencionado Filosilicato, simulando a pratica diária na alimentação dos porcos e que no fundo é o que interessa à industria pecuaria para tentar reduzir ou/e minimizar duma forma cómoda e relativamente económica, os efeitos indesejáveis das micotoxinas quando referidas à alimentação animal.
Com os melhores cumprimentos.
Alberto Gimeno
Recomendar
Responder

Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.



