Introdução
A avaliação seminal empregada na suinocultura nos dias de hoje é, essencialmente, a mesma há décadas. Ela é baseada nas características do ejaculado como concentração espermática, volume, pH, núcleo e e principalmente na motilidade e morfologia espermática. O que de fato mudou foram os processos e tecnologias empregadas para aquisição dos dados obtidos na avaliação, aumentando a sensibilidade e repetibilidade das análises realizadas (Mellagi et al., 2022). O controle adequado da qualidade seminal permite a maximização da produção de doses inseminantes por ejaculado, bem como organizar o acompanhamento da produtividade de cada macho. Este acompanhamento é crítico tanto quando o reprodutor jovem é introduzido na rotina de coleta de sexo quanto na determinação do momento do descarte e substituição (Bustamante-Filho et al., 2022). Na verdade, a análise do sêmen como preconizado pelo Manual de Exame Andrológico do Colégio Brasileiro de Reprodução Animal permite inferir sobre o status reprodutivo do macho (Cbra, 2013). Porém, não é possível garantir que um macho terá boas taxas de fertilidade durante sua vida reprodutiva.
Apesar desta aparente falta de novidade no desenvolvimento de novas formas de análise do sêmen, a pesquisa em andrologia animal vem expandindo uso de novas tecnologias e métodos de análise que vão além das características físico-químicas e morfofuncionais do sêmen. Estas tecnologias, largamente utilizadas em estudos de ponta em áreas da medicina como a oncologia, investigam com muito mais detalhes a composição e funcionamento de células e fluídos. Quando aplicados a andrologia, pudemos entender melhor os mecanismos moleculares que regem a fisiologia reprodutiva masculina, como a espermatogênese, maturação no epidídimo e interações do espermatozoide com o plasma seminal e o trato reprodutivo feminino (Bustamante-Filho et al., 2022). Embora estes conhecimentos não serem aparentes no dia a dia da produção de doses de sêmen em centrais e no manejo de reprodutores suínos, eles foram fundamentais para o desenvolvimento de novos diluentes para preservação seminal e inseminação artificial.
Neste artigo, serão apresentadas algumas técnicas avançadas que vêm contribuindo com o avanço da andrologia na espécie suína como o uso de sondas fluorescentes em microscopia e citometria de fluxo, as ciências “ômicas” que vêm permitindo identificar biomarcadores proteicos, lipídicos e metabólicos no sêmen associados eficiência reprodutiva.
Citometria de fluxo de espermatozoides suínos
Desenvolvida no final dos anos 1960, a citometria de fluxo tem o objetivo de contar, analisar e classificar células, componentes celulares e materiais não celulares em suspensão líquida (Mckinnon, 2018). Cada partícula é analisada individualmente e vários parâmetros celulares podem ser avaliados simultaneamente com o auxílio das sondas fluorescentes. Aplicada a andrologia, oferece grande vantagem uma vez que é possível analisar diferentes parâmetros em cada espermatozoide individualmente, gerando grande volume de dados com excelente precisão quantitativa.
Tal abordagem revoluciona a forma de olharmos o ejaculado, pois além de possibilitar uma avaliação célula por célula, permite ter mais de uma característica analisada por espermatozoide. Como exemplo, podemos citar a avaliação da atividade mitocondrial, organela que tem papel central no metabolismo energético da célula (Bucci et al., 2022). A capacidade das mitocôndrias espermáticas conseguirem produzir ATP está diretamente relacionada a motilidade do gameta. Além disso, mitocôndrias disfuncionais potencializam a produção de espécies reativas de oxigênio que danificam a própria célula e potencialmente outras (Bucci et al., 2021). Com a citometria de fluxo, podemos avaliar em uma mesma célula sua integridade de membranas, além no nível de atividade mitocondrial e danos oxidativos aos lipídios da membrana plasmática (Torres et al., 2016).
As sondas fluorescentes são moléculas que em seu estado de repouso não emitem fluorescência, mas quando excitadas por uma fonte luminosa (laser) emitem fluorescência com comprimento de onda maior, dando especificidade para as sondas (Cunha et al., 2015). Cada fluorocromo possui um comprimento de onda específico de excitação para gerar a emissão de um comprimento de onda característico. Os lasers normalmente utilizados para a excitação de fluorocromos são o laser azul (488 nm), vermelho (640 nm), verde-amarelo (561 nm), verde (532 ou 552 nm), violeta (405 nm) e o ultravioleta (355 nm).
A citometria de fluxo traz grandes vantagens em comparação a microscopia de epifluorescência, pois potencializa o uso e combinações de sondas fluorescentes, além de quantificar a intensidade das fluorescências emitidas, aumentando a especificidade e aplicações da técnica. Destaca-se ainda a possibilidade de se avaliar dezenas de milhares de células por minuto, o que é uma grande vantagem frente ao tradicional método de contagem de células em microscopia óptica. Resumidamente, o princípio da citometria de fluxo baseia-se na incubação da amostra de espermatozoides em soluções das sondas fluorescentes, e posterior injeção no aparelho. Após passarem pelo ponto de interceptação com o laser, as partículas são avaliadas quanto à dispersão da luz visível e pelos múltiplos parâmetros de fluorescência (Bustamante-Filho et al., 2021). A dispersão da luz visível é analisada em duas direções. A dispersão da luz visível é analisada independentemente do uso de fluorescência, esses parâmetros auxiliam no reconhecimento da população celular analisada. A dispersão frontal (do inglês Forward Scatter; FSC) determina o tamanho relativo da partícula, enquanto a dispersão lateral (do inglês Side Scatter, SSC) indica a complexidade ou granularidade interna da célula (Mckinnon, 2018). Ao mesmo tempo, são emitidos diferentes lasers com comprimentos de onda definidos, que excitam as sondas incubadas na amostra. Estas emitirão (ou não) fluorescências que são detectadas e quantificadas pelo aparelho, fornecendo um conjunto de dados para cada célula analisada. Após a captação dos dados, estes podem ser analisados com grande liberdade, permitindo a identificação de subpopulações espermáticas com características únicas (ex. dano no acrossoma) ou combinadas (ex. célula com acrossoma intacto e alto potencial mitocondrial) (Bustamante-Filho et al., 2021).
As sondas fluorescentes são moléculas que em seu estado de repouso não emitem fluorescência, mas quando excitadas por uma fonte luminosa (laser) emitem fluorescência com comprimento de onda maior, dando especificidade para as sondas (Cunha et al., 2015). Cada fluorocromo possui um comprimento de onda específico de excitação para gerar a emissão de um comprimento de onda característico. Os lasers normalmente utilizados para a excitação de fluorocromos são o laser azul (488 nm), vermelho (640 nm), verde-amarelo (561 nm), verde (532 ou 552 nm), violeta (405 nm) e o ultravioleta (355 nm).
A escolha das sondas para análise celular deve levar em consideração alguns fatores como o compartimento celular de interesse e as configurações (lasers e detectores) do equipamento no qual se pretende realizar a leitura seja um microscópio de fluorescência, microscópio confocal, citometria de fluxo, ou outros equipamentos capazes de ler e interpretar a fluorescência. Dentre as características passíveis de avaliação no espermatozóide destacam-se a fragmentação de DNA, integridade de acrossoma, integridade de membrana plasmática, translocação da fosfatidilserina da membrana plasmática, fluidez dos fosfolipídeos de membrana, estado mitocondrial, potencial de peroxidação dos lipídeos da membrana, espécies reativas de oxigênio, cálcio celular, entre outros.
A citometria de fluxo tem sido muito utilizada na análise do sêmen suíno à nível de pesquisa e demonstra potencial para ser incorporada na análise seminal de reprodutores de alto potencial genético. Várias técnicas estão disponíveis para a avaliação dos compartimentos espermáticos utilizando as sondas fluorescentes descritas na literatura citada. As técnicas mais utilizadas para a análise dos espermatozoides suínos estão descritas no quadro 1 e englobam a avaliação da integridade das membranas plasmática e acrossomal, fluidez e oxidação de fosfolipídios de membrana, potencial mitocondrial entre outros.
Apesar do seu enorme potencial em andrologia, sua aplicação na rotina da produção de doses de sêmen para IA na suinocultura (e para outras espécies) esbarra em algumas limitações como: (i) valor de aquisição e manutenção do equipamento, (ii) necessidade de alta qualificação da mão de obra para operação do citômetro de fluxo e interpretação de dados, (iii) otimização de protocolos e (iv) desenvolvimento de softwares dedicados para análise de espermatozoides suínos acoplados ao CASA. Todavia, dentre as cadeias produtivas de proteína animal, a suinocultura tem um histórico de tecnificação de processos em reprodução de grande sucesso, o que contribui para a incorporação da citometria de fluxo na análise de rotina em centrais de produção de dose de sêmen e unidades de difusão genética.
Tabela 1: Sondas fluorescentes mais utilizadas para avaliação dos espermatozoides suínos em citometria de fluxo e microscopia de epifluorescência.
1 Sondas permeáveis à membrana plasmática para a diferenciação de células vivas e a exclusão de debris celulares. 2 2’-desoxiuridina 5’ trifosfato. 3 aglutinina de Pisum sativum. 4 aglutinina do amendoim.
Proteômica e metabolômica do sêmen suíno
As últimas três décadas trouxeram um aumento exponencial no volume de conhecimento gerado graças aos avanços dos métodos analíticos de moléculas como DNA, RNA, proteínas, lipídios e outras pequenas moléculas. As ciências ômicas referem-se à produção de conhecimento a partir de técnicas high�throughput, ou seja, técnicas que geram grandes volumes de dados por análise. A genômica foi a primeira ciência ômica a ser estruturada, sendo inicialmente definida pelo sequenciamento do conteúdo genético de uma célula, tecido ou organismo. Tal conhecimento viabilizou o desenvolvimento de outras ciências ômicas como a proteômica, lipidômica e metabolômica, tornando viável uma melhor compreensão das complexas rotas metabólicas e vias de sinalização envolvidas em processos fisiológicos e patológicos.
A identificação de proteínas no sêmen de mamíferos vem sendo realizada há mais de 50 anos, uma vez era possível aplicar os mesmos métodos de análise empregados no estudo de proteínas séricas e de células sanguíneas. Assim, logo identificou-se que muitas proteínas presentes no sangue também estavam presentes no plasma seminal. Mas foi com o desenvolvimento de métodos de separação de proteínas em gel e por cromatografia que foi possível compreender melhor a complexa composição proteica do plasma seminal e do espermatozoide. Atualmente, já temos uma boa compreensão de quais proteínas (e suas quantidades) estão presentes no plasma seminal e espermatozoide suíno
Um dos primeiros trabalhos a caracterizar de forma mais abrangente a composição proteica do plasma seminal suíno foi desenvolvido por (Gonzalez-Cadavid et al., 2014). Por meio de 2D SDS-PAGE, foram identificadas 39 proteínas diferentes. Mais recentemente, utilizando abordagem shotgun, (Perez�Patino et al., 2018), expandiram este número para 872 proteínas, sendo 390 pertencendo especificamente a taxonomia Sus scrofa. Diferente de outras espécies de animais domésticos, o plasma seminal suíno possui grande quantidade de proteínas que se ligam à superfície do espermatozoide, denominadas espermadesinas, que representam cerca de 45 a 75% das proteínas totais (Dostalova et al., 1994; Gonzalez-Cadavid et al., 2014). A secreção da vesícula seminal é a maior fonte de espermadesinas suínas, sendo composta por cinco subfamílias que compreendem as proteínas AWN, AQN-1, AQN-3, PSP-1, PSP-2 (Calvete et al., 1995). As espermadesinas podem ser classificadas como proteínas ligantes à heparina (AQN- 1, AQN-3, AWN) e não ligantes à heparina (heterodímero PSP-I/PSP-II; (Assreuy et al., 2003)).
A PSP-I foi identificada como potencial candidata a marcador para qualidade seminal, estando presente em maior abundância nos ejaculados de qualidade inferior (De Lazari et al., 2019). Todavia, esta mesma proteína foi descrita como mais abundante no plasma seminal de ejaculados com maior resistência a preservação a 17°C (De Lazari et al., 2020). Outras proteínas do plasma seminal suíno foram associadas a uma maior resistência espermática a refrigeração seminal. Dada a tendência de redução do uso de antimicrobianos nas doses de sêmen comercializadas, a refrigeração seminal a 5°C é vem sendo testada para minimizar a contaminação microbiana. Utilizando a abordagem proteômica, foi identificado que as proteínas cathepsin B, legumain e cystatin E/M estão diferencialmente expressas em cachaços cujo ejaculados apresentam com maior resistência seminal a preservação 5°C por 120h. Estas proteínas fazem parte de um sistema proteolítico que pode ser responsável pela ativação ou inativação de vias de sinalização celular envolvendo metaloproteases, podendo modular a resistência espermática a conservação a 5°C (Menezes et al., 2020).
Estudos de proteômica de espermatozoide suíno comprovaram a já esperada complexidade em termos quantitativos e qualitativos. Foram descritas mais de 1600 proteínas associadas com diferentes processos celulares, componentes celulares e funções moleculares no espermatozoide suíno (Weber et al., 2020). Uma forma de correlacionar as funções bioquímicas das proteínas com seus potenciais papeis na fisiologia espermática é verificar sua localização celular. Proteínas de membrana plasmática podem ter diferentes papéis dependendo da sua distribuição regional, seja na cabeça, peça intermediária ou cauda. Por outro lado, proteínas encontradas no acrossoma estão possivelmente relacionadas ao processo de fertilização, assim como proteínas mitocondriais estão relacionadas ao metabolismo celular e a motilidade da espermática. Esta característica, também é influenciada pelas proteínas que compõe o axonema e todo a maquinaria proteica e energética responsável pelo batimento flagelar.
Além de avaliar a função de uma determinada proteínas espermáticas pela sua localização celular, temos que levar em consideração também a sua abundância. Ou seja, sua quantidade absoluta e relativa em comparação com as demais proteínas espermáticas. A proteína mais abundante no espermatozoide retirado da cauda do epidídimo do suíno foi a Heat Shock Protein (HSP) 70 kDa protein 1 like (Weber et al., 2020). Esta proteína ativa as funções de conformação e tráfico de proteínas, bem como na inibição da agregação proteica e na degradação proteica (Daugaard et al., 2007). A presença desta proteína no espermatozoide de suínos e no oviduto de mamíferos sugere uma relação na manutenção da viabilidade espermática e na fertilização (Belleannee et al., 2011; Elliott et al., 2009). Além disso, estudos in vitro demonstraram que ela ativa a motilidade espermática, ligando-se a superfície do espermatozoide e participando da migração espermática (Hiyama et al., 2014). O potencial uso da HSP 70 como marcador molecular se dá pela sua alta abundância em espermatozoides de ejaculados com maior criotolerância. A fosforilação de serinas da HSP 70 pode interferir nos processos de ativação e inativação espermática, alterando assim as taxas metabólicas e o estresse oxidativo (Yeste et al., 2014), possivelmente protegendo o espermatozoide das alterações causadas pelo congelamento.
A importância do acrossoma na fertilização o torna um local chave para a identificação de proteínas que podem determinar o sucesso ou o fracasso da fecundação. Dentre as proteínas já identificadas no acrossomo suíno, destaca-se a acrosin binding protein (ACRBP), que participa da reação do acrossomo durante a fertilização (Belleannee et al., 2011). Esta etapa é muito complexa e envolve a ativação do acrossomo, ligação e hidrólise da zona pelúcida (Mao; Yang, 2013). As proteínas acrossomais interagem com a zona pelúcida e formam complexos proteicos de alto peso molecular cooperando com a penetração espermática (Ferrer et al., 2012; Kongmanas et al., 2015). Os níveis da ACRBP podem ser utilizados para o monitoramento da espermatogênese in vivo e in vitro, bem como marcador molecular espermático e para monitoramentos das funções reprodutivas em garanhões (Kim et al., 2015). Em suínos, a análise da ACRBP e da triosephosphosphate isomerase após a coleta do sêmen pode predizer a congelabilidade, podendo ser usada como monitoramento visando otimizar a função reprodutiva (Vilagran et al., 2013).
Se a proteômica estuda as biomoléculas efetoras de processos fisiopatológicos, o desenvolvimento da metabolômica permitiu conhecer as variações em pequenas moléculas que muitas vezes são substratos ou alvos de proteínas identificadas na proteômica. Assim, com as duas é possível enxergar com maior precisão os processos bioquímicos relacionados aos fenômenos celulares e teciduais. A metabolômica é uma técnica que estuda pequenas moléculas (< 1500 Da, denominadas metabólitos) pertencentes à diversas classes como carboidratos, lipídios, amino ácidos, ácidos orgânicos, ácidos nucleicos, vitaminas, polifenóis, alcaloides e outra espécies inorgânicas. Os metabólitos são os produtos finais ou intermediários de várias reações celulares sendo a ciência ômica mais próxima ao fenótipo celular (D’occhio et al., 2019). A metabolômica pode ser realizada de duas formas sendo possível analisar o perfil de todos os metabólitos da amostra (metodologia non-target) ou o estudo de concentrações de metabólitos específicos (metodologia target).
O estudo da metabolômica do sêmen suíno ainda é muito restrito, ampliando as possibilidades de estudo desse tema. Jones e Bubb (2000) investigaram os substratos endógenos para o metabolismo dos espermatozoides suínos por NMR e identificaram que os di- ou triglicerídeos podem ser utilizados para a produção de glicerol, já os fosfolipídios de membrana como a acetilcarnitina e o glicerilfosfolipídio são utilizados para a produção de glicerol 3-fosfato (Jones; Bubb, 2000). O perfil metabólico dos espermatozoides suínos é caracterizado por uma alta taxa glicolítica, mas com baixos níveis de glicose-6- fosfato (Marin et al., 2003). Estudos ainda não publicados constataram que alguns metabólitos como inosina, hypoxantina, creatina, ADP, niacinamida, spermina e 2-metilbutirilcarnitina estão diretamente relacionados com o aumento da congelabilidade dos espermatozoides suínos durante o uso de holding time nos protocolos de criopreservação.
Considerações finais
Nesta revisão, foram apresentadas novas tecnologias aplicadas a andrologia suína, que permitem uma avaliação muito mais detalhada das características celulares e composição bioquímica de espermatozoides e fluidos reprodutivos. Décadas de pesquisas na área construíram um corpo de evidência grande o suficiente para justificar investimentos em biotecnologias reprodutivas baseadas em proteínas e metabólicos relacionados aos diferentes fenômenos reprodutivos (Figura 1).
De fato, a implementação destas metodologias e uso dos dados obtidos não é um processo simples quando se pensa em rotina de central de produção de doses de sêmen. A citometria de fluxo é o método com maior chance de implementação, assim como foi o CASA. A cada ano, novos equipamentos e sondas estão disponíveis, levando a redução de custo de aquisição e manutenção de equipamentos. O desenvolvimento de citômetro dedicados a análise de sêmen em centrais seria, talvez, o passo definitivo para a implementação da técnica na rotina de produção de doses de sêmen. Diferentemente, as técnicas de proteômica e metabolômica, apesar da busca por biomarcadores estar muito avançada, até o momento, existe apenas um sendo comercializado, o 4BioDX (SPQI, França), baseado na proteína ProAKAP4 do axonema (Bustamante-Filho et al., 2022). Provavelmente, as descobertas em proteômica e metabolômica do sêmen terão mais impacto de forma indireta, ou seja, não na aplicação diária como kits diagnósticos, mas fundamentais no desenvolvimento e aperfeiçoamento de novos diluentes e tecnologias de preservação seminal e seleção de reprodutores.
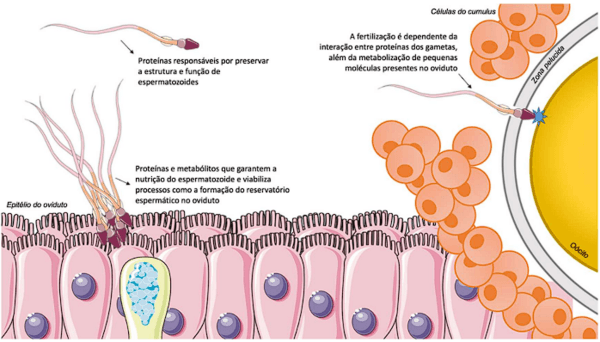
Figura 1. Representação das diferentes etapas e fenômenos da biologia reprodutiva de espermatozoides em que proteínas e metabólitos possuem influência.
Publicado originalmente em Anais do XXV Congresso Brasileiro de Reprodução Animal (CBRA-2023), Belo Horizonte, MG, 24 a 26 de maio de 2023.DOI: 10.21451/1809-3000.RBRA2023.045. Acesso disponível em: http://www.cbra.org.br/portal/downloads/publicacoes/rbra/v47/n2/RB%201081%20Bustamante-Filho%20p.300-306.pdf








