O que falta fazer para atender aos requerimentos nutricionais de suínos
Publicado: 17 de maio de 2013
Por: Dr. Bruno A.N. Silva, Professor Adjunto de Nutrição/ Produção de Suínos e Bioclimatologia Animal,
Universidade Federal de Minas Gerais - UFMG/ICA, MG, e Marcela D. Ferreira, Estudante BSc., Universidade Federal de Minas Gerais – UFMG/ICA, MG.
Atualmente o conceito da população sobre a carne suína remete-se à lembrança de uma produção em condições de pouca higiene, contendo alto teor de gordura e colesterol. Entretanto, hoje em dia, a carne suína, diferentemente da carne de porco, é resultado da evolução baseada na seleção genética, nutrição, manejo e status sanitário dos rebanhos, apresentando teores reduzidos de gorduras e calorias e maior percentual de carne magra em relação a 25 anos atrás.
Ao longo dos últimos 25 anos houve diversas mudanças na indústria suína. Estas mudanças contribuíram para a melhoria fenotípica apresentada pelos suínos no peso de abate (110 a 122 kg), rendimento de carcaça (71 a 74%), e no rendimento de carne (55 a 58%) (Fix et al., 2010). Chen et al. (2002) reportaram melhorias na qualidade e quantidade de carne depositada na carcaça para as raças modernas de Yorkshire, Duroc, Hampshire, Pietran e Landrace, raças estas que fazem parte dos programas de seleção genético para a produção dos suínos hibridos comerciais atuais.
Os programas de alimentação também sofreram mudanças nos últimos 25 anos, permitindo aumentar de forma significativa o ganho de tecido magro.
Em uma revisão sobre a produção de calor dos suínos terminadores modernos, Brown-Brandl et al. (2004), concluiram que os genótipos modernos apresentaram um aumento de produção de calor em 18,1% (aproximadamente 1% ao ano) de 1984 a 2002. Podemos atribuir a este aumento, mudanças na composição corporal dos suínos atuais (menos gordura e mais músculos; Figura 2 e 3) e no aumento das taxas de "turnover" proteico. De acordo com Ball et al. (2008), para cada 2,8% de aumento no percentual de tecido magro, a produção de calor aumenta em torno de 18,7%. O aumento apresenta um impacto significativo sobre as instalações e manejos adotados para estes animais. O aumento na produção de calor endógeno deve ser considerado, principalmente em regiões de clima Tropical, no momento em que está sendo feita a construção das instalações e durante as formulações das dietas. Estas mudanças ocorridas na composição corporal dos suínos e no aumento das taxas de "turnover" proteico, também contribuem para maiores necessidades de energia e aminoácidos.
Na Tabela 1, pode-se observar como as mudanças no potencial genético e no programa nutricional alteraram o potencial produtivo do suíno na fase de terminação.
Tabela 1. Efeito da linhagem genética e do programa nutricional sobre o desempenho de suínos na fase de terminação
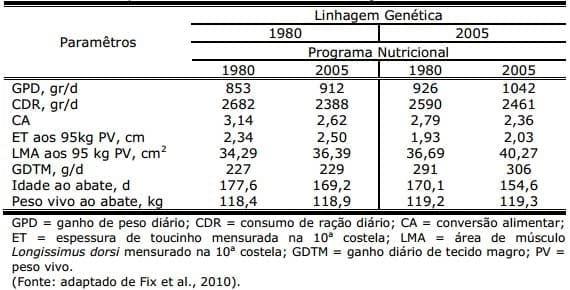
Com base nos dados apresentados, pode-se inferir que a redução em 15% nos dias ao abate e 45% de aumento na eficiência de carne magra podem ser atribuídas quase em uma mesma proporção que o melhoramento genético e aos avanços na nutrição. A melhora de 33% na conversão alimentar representa 2/3 dos resultados de mudanças no programa nutricional. Já a redução da espessura de toucinho é atribuida de forma exclusiva ao processo de seleção genética, enquanto que o percentual de tecido magro parece estar relacionado de maneira igual à genética e ao programa nutricional.
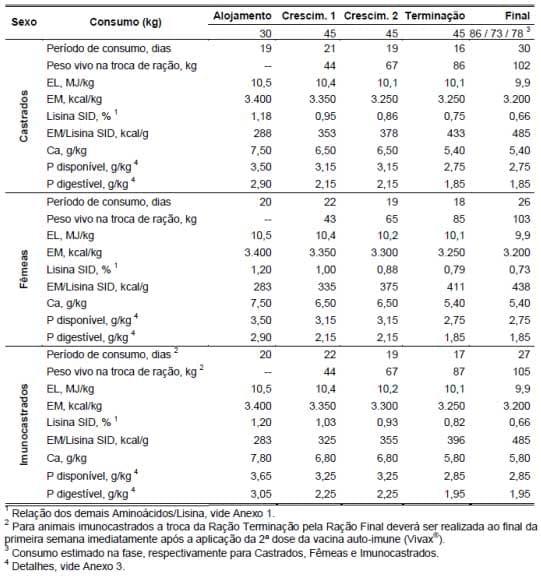
Na Tabela 2 pode-se visualizar a recomendação nutricional dada pela TOPIGS do Brasil (progênie TALENT, 2012) para as fases de crescimento e terminação. Esta recomendação visa maximizar não só o potencial de deposição proteico, mas também permite explorar de forma mais completa os potenciais dos diferentes sexos e suas respectivas fases de crescimento, permitindo assim, optimizar o potencial do genótipo.
Limitações para a Eficiência da Utilização de Aminoácidos para o Crescimento
Efeitos da utilização de dietas desbalanceadas na relação proteína: carboidratos/ gorduras
Após a ingestão de grandes quantidades de proteínas, o intestino e o fígado utilizam a maior parte dos aminoácidos absorvidos. O glutamato e o aspartato são usados como fontes de energia pelo intestino, e muito pouco dessas duas substâncias entram na veia porta (Colditz, 2002). O intestino também usa alguns outros aminoácidos. O fígado capta de 60 a 70% dos aminoácidos presentes na veia porta. Esses aminoácidos, em sua maior parte, são convertidos a glicose pela gliconeogênese. O aumento dos níveis de aminoácidos obtidos pela dieta estimula o pâncreas a liberar glucagon em níveis acima daqueles obtidos no jejum, aumentando a captação dos aminoácidos pelo fígado e estimulando a gliconeogênese (Dandona et al., 2004). A liberação de insulina também é estimulada, mas não próximo dos níveis encontrados após uma ingesta rica em carboidratos.
No geral, a liberação de insulina após uma alimentação rica em proteínas é suficientemente alta para permitir a captação dos aminoácidos pelo músculo esquelético e a síntese protéica, entretanto, a gliconeogênese no fígado não é inibida (Dandona et al., 2004). Quando se eleva os níveis de carboidratos na alimentação, há um aumento na relação insulina/glucagon, o que possibilita uma diminuição da gliconeogênese hepática a partir de aminácidos e um aumento na utilização desses aminoácidos para a síntese de proteínas como as proteínas plasmáticas.
Tabela 2. Programa alimentar sugerido e requerimentos nutricionais das dietas utilizadas para a linhagem TALENT (Fonte: adaptado do manual de alimentação da progênie TALENT, TOPIGS do Brasil 2012)
A maior parte dos aminoácidos que entram na circulação periférica após uma dieta rica em proteínas são aqueles que não são utilizados, ou pouco utilizados, pelo fígado, visto que este possui baixos níveis de transaminases para estes aminoácidos, e isso o impossibilita de oxidá-los de forma significativa, por isso eles entram na circulação sistêmica (Dandona et al., 2004). Esses aminoácidos são captados pelo músculo esquelético e outros tecidos, que os utilizam principalmente para a síntese protéica (Baker et al., 1999).
Dietas com baixas quantidades de carboidratos e gorduras mantém os níveis de insulina baixos, como se o conteúdo energético do organismo estivesse diminuído. Isso faz com que a secreção de glucagon pelo pâncreas esteja estimulada, diminuindo a relação insulina/glucagon (Husband e Bryden, 1996). Dessa forma, há uma mobilização das reservas energéticas do organismo, principalmente dos ácidos graxos provenientes dos adipócitos e sua oxidação por outros tecidos, o que contribui para a redução da quantidade de gordura corporal e, conseqüentemente, para a perda de peso e queda no desempenho produtivo (Elsasser et al., 2008).
Uso de Aminoácidos essencias (AAE) e não-essenciais (AANE) na produção de compostos nitrogenados não protéicos
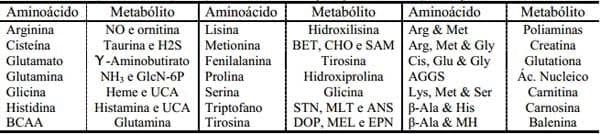
Os aminoácidos são precussores essenciais para a síntese de diversas substâncias nitrogenadas de grande importância biológica. Algumas destas moléculas bioativas estão presentes na Tabela 3, representadas por neurotransmissores (Ex. γ-aminobutirato, dopamina e serotonina), hormônios (e.x. epinefrina e noraepinefrina), vasodilatadores, gases sinalizadores (NO, CO e H2S), antioxidantes (glutationa, creatina, melatonina, melanina, e taurina), doadores metílicos, bem como fatores reguladores do metabolismo, crescimento, desenvolvimento, resposta imune, e saúde (Wu, 2009).
Grandes quantidades de glutamina e arginina são utilizados pelas células do sistema imune para a defesa do animal contra agentes infecciosos, particularmente, em resposta a desafios imunológicos, como, por exemplo, o consumo de 50% de glutamina livre e 50% de arginina livre no plasma com 1 h e 2,5 h, respectivamente (Li et. al., 2007). Em adição, 17% da arginina proveniente da dieta é utilizada para a síntese de creatina em leitões (Wu et al., 2004), e 25% da metionina dietética é utilizada por reações de metilação através da formação da S-adenosilmetionina em leitões jovens (Brosnan et al., 2009). Estas transformações metabólicas são essenciais para a reprodução, saúde e sobrevivência do suíno.
Tabela 3. Principais metabólitos nitrogenados produzidos apartir dos aminoácidos em suínos. AGGS, aspartato, glutamina, glicina e serina; BCAA, aminoácidos de cadeia longa; BET, betaína; CHO, colina; CO, monóxido de carbono; DOP, dopamina; EPN, epinefrina e noraepinefrina; GlcN-6P, glucosamina-6-fosfatase; MEL, melatonina; MH, 3-metilhistidina; NO, óxido nitrico; SAM, S-adenosilmetionina; STN, seratonina; UCA, acido urocanico (Adaptado de Wu, 2009)
Degradação de aminoácidos essenciais (AAE) da dieta para a síntese de aminoácidos não-essenciais (AANE) no intestino delgado
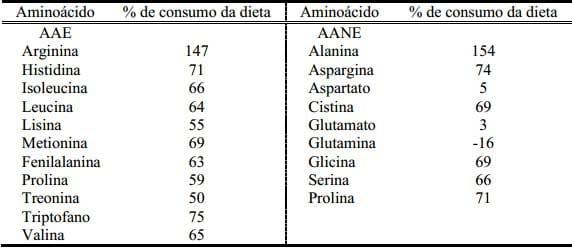
Estudos recentes têm revelado que tanto os AAE e AANE da dieta são extensivamente degradados no instetino delgado dos suínos (Wu, 1998; Stoll e Burrin, 2006). Além disso, resultados de estudos tem indicado que, aproximadamente, todo o glutamato, aspartato, 67 a 70% de glutamina, e 30 a 40% de prolina na dieta enteral são catabolizados pelo intestino delgado dos suínos (Wu et al., 2010). A taxa de degradação do glutamato na dieta enteral pelo intestino delgado é a mais alta entre os aminoácidos, seguido pela glutamina, aspartato, e prolina. A presença da bactéria no lúmen do intestino delgado pode degradar estes aminoácidos (Bergen e Wu, 2009; Dai et al., 2010). Em adição, células absortivas do epitélio no trato intestinal do neonato (enterócitos) são capazes de catabolizar extensivamente o glutamato, aspartato, glutamina e prolina (Wu e Morris, 1998). Dados do fluxo portal e visceral líquido (intestinos, pâncreas, estômago, e baço) de aminoácidos em leitões estão presentes na Tabela 4. Resultados indicam que menos de 20% dos AAE são utilizados para a síntese protéica através da mucosa intestinal (Stoll e Burrin, 2006), e mais de 80% dos AAE utilizados são, provavelmente, degradados pelos microorganismos no lúmen intestinal (Dai et al., 2010). Neste sentido, os aminoácidos da dieta desempenham um papel fundamental na regulação da composição microbiana e atividade intestinal.
O metabolismo de aminoácidos no intestino é de grande importância nutricional e fisiológica. Por exemplo, os aminoácidos desempenham um papel importante na manutenção da integridade e funcionamento do trato intestinal, regulando a síntese endógena de aminoácidos (citrulina, arginina, prolina e alanina), e modulando a disponibilidade de aminoácidos da dieta para tecidos extra-intestinais (Wu, 2009).
Tabela 4. Fluxo portal e visceral (PDV) líquido em leitões (6 – 10kg) alimentados a base de leite (Adaptado de Stoll e Burrin, 2006; e Wu et al., 2010)
Em virtude dos níveis elevados de glutamato e aspartato presentes na circulação exercerem um efeito neurotóxico (Meldrum e Garthway, 1990; Stout et al., 1998), o catabolismo deles pelo intestino delgado é essencial para a sobrevivência animal. Entretanto, perdas irreversíveis de aminoácidos da dieta (particularmente AAE) vindas do intestino, resultam na diminuição da eficiência de utilização deles para o crescimento. Contudo, inibindo a atividade microbiana através da suplementação de antibióticos ou pré-bióticos pode melhorar a entrada de aminoácidos vindos da dieta no portal circulatório (Yin et al., 2010) e, assim, aumentar o desempenho dos suínos na fase de crescimento (Kong et al., 2009).
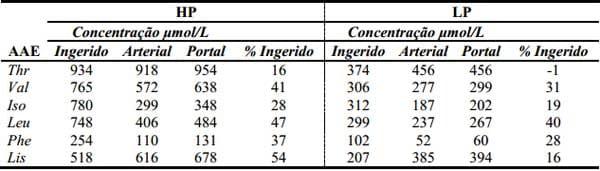
Van Goudoever et al. (2007) observaram que sob condições de restrição protéica, porém com consumo normal de energia, o fluxo portal visceral líquido mantém uma taxa elevada de metabolismo e continua a utilizar de forma desproporcional grandes quantidades de AAE (Tabela 5). Estes mesmos autores observaram que a lisina mesmo sendo catabolizada no intestino, e contribuindo com 31% de sua oxidação total-corporal, em suínos alimentados com dietas ricas em proteína, este aminoácido é fortemente suprimido quando a proteína se torna um nutriente limitante. Entretanto, os resultados indicam a importância crítica que o intestino exerce ativamente sobre a regulação do fluxo de AAE para o corpo, indicando claramente a necessidade de se considerar a biodisponibilidade de AAE nos cálculos das recomendações nutricionais.
Tabela 5. Concentrações do ingerido, arterial e portal, e o balanço líquido portal de aminoácidos essenciais em leitões em fase de creche recebendo uma dieta com alta densidade proteica (HP) ou baixa densidade proteica (LP) (Adapatdo de Van Goudoever et al., 2007)
Degradação de aminoácidos essenciais da dieta para síntese de aminoácidos nãoessenciais extra-intestinal
Grandes quantidades de arginina, prolina, aspartato, glutamina, e glicina devem ser sintetizados em suínos em crescimento. Isto também é verdadeiro para alanina em leitões durante a lactação. A síntese de alguns aminoácidos requer a degradação de AAE (cujos esqueletos de carbono não podem ser sintetizados) em suínos. Entretanto, quando as dietas não contém um balanço adequado de AANE, os AAE são catabolizados para preencher um propósito importante em suínos em crescimento. Recentes avanços na nutrição utilizando AANE tem importantes implicações para a formulação de novas dietas de suínos, que tem como objetivo reduzir o conteúdo de AAE. Por exemplo, dietas atuais contém mais AAE, e menos AANE, do que o necessário para a deposição protéica em suínos na fase de crescimento (Tabela 3). A suplementação de AANE em dietas de baixa densidade protéica podem melhorar efetivamente a eficiência das transformações metabólicas e permitir um bom desempenho de crescimento dos suínos (Wu, 2010).
Alteração na expressão gênica aumenta a eficiência de deposição muscular
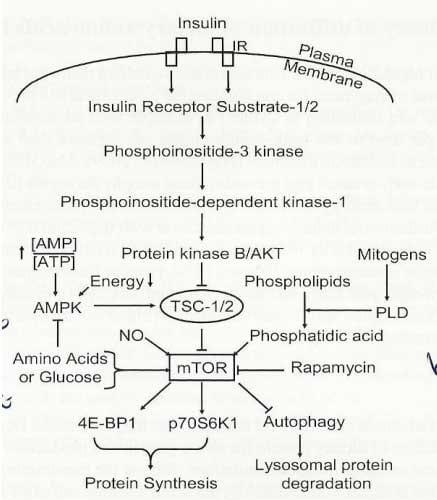
A eficiência da utilização dos aminoácidos na dieta pelos suínos depende da regulação da expressão gênica em nível celular (Wu, 2009). Aminoácidos não são somente substratos para a síntese protéica, mas também afetam uma ou mais das etapas descritas a seguir: modificação da cromatina, transcrição, modificação pós-transcriptal, transporte de RNA, degradação do mRNA, tradução, e modificações pós-tradução (Bruhat et al., 2009). O alvo da rapamicina (mTOR), uma kinase protéica para serina/treonina, é o regulador chave da deposição protéica (Figura 2; Wu et al., 2007; Shaw, 2008). Aminoácidos (Ex. glutamina, arginina, e leucina) estimulam a fosforilação do mTOR em nível celular, levando a formação do processo de iniciação do complexo de tradução gênico (Yao et. al., 2008; Davis e Fiorotto, 2009; Rhoads e Wu, 2009). Além da sinalização do mTOR, a arginina pode regular a expressão de genes e a atividade da AMPK, uma importante proteína na detecção de nutrientes que modulam a oxidação dos substratos de energia e de sensibilidade à insulina (Jobgen et. al., 2006). Em adição, a glutamina é conhecida por ativar diversos sinalizadores extracelulares (Brasse-Lagnel et al., 2009; Rhoads e Wu, 2009). O NO, CO, e o H2S,, produtos do catabolismo da arginina, glicina, e cistina, respectivamente, beneficiam a regulação de diversos processos fisiológicos e imunológicos (Li et al., 2009).
Figura 1. Ativação da sintese proteica através de aminoácidos e fatores de crescimento via mTOR (proteina kinase)(adaptado de Wu et al., 2007).
Crescentes evidências indicam que a expressão dos genes, bem como a de proteínas anti-oxidantes e regulatórias em tecidos de suínos mudam no decorrer da vida do animal (Wang et al., 2010). Notavelmente, níveis de proteína para reguladores positivos do mTOR são mais elevados em fibras musculares esqueléticas de suínos jovens do que em adultos (Suryawan et al., 2009), resultando na redução na taxa de síntese protéica com o avanço da idade (Davis e Fiorotto, 2009). Com isso, a eficiência de AAE da dieta e AANE da síntese protéica é 35% e 26% maior, respectivamente, em leitões na fase de lactação do que na fase pós-desmame (Wu et al., 2010).
Oportunidades para aumentar a eficiência de utilização dos aminoácidos da dieta para crescimento
Dados recentes sobre a expressão de genes e mecanismos sinalizadores têm permitido desenvolver novas estratégias nutricionais para reduzir as limitações bioquímicas e fisiológicas na utilização de aminoácidos em suínos. Por exemplo, a administração oral de L-glutamina (1 g/kg PV/dia) para leitões de baixo peso durante a amamentação pode melhorar sua sobrevivência e crescimento (Haynes et al., 2009). A suplementação da dieta com 1% de Lglutamina em leitões recém desmamados previne atrofia do jejuno durante a primeira semana no pós-desmame e melhora a conversão alimentar em 25% durante a segunda semana pós-desmame (Wu et al., 1996; Wang et al., 2008).
A suplementação da dieta com 0,2% e 0,4% de L-arginina para leitões melhora concentração plasmática de arginina (30% e 61%), reduzindo níveis circulantes de amônia (20% e 35%), aumentando o ganho de peso (28% e 66%) (Kim e Wu, 2004). Já a suplementação de L-arginina aumenta a capacidade antioxidante dos tecidos (Ma et al., 2010), aumentando a deposição de carne magra (Tan et al., 2009) em suínos na fase de crescimento-terminação.
Ativação do sistema imunológico
A defesa dos suínos à agentes estranhos como; vírus, bactérias, protozoários e outros parasitas ocorre devido ao trabalho fundamental do sistema imunológico dos animais. O equilíbrio entre a boa funcionalidade do sistema imune (imunocompetência) e os desafios de campo é o fator determinante para a saúde de um animal. Sempre que houver aumento da pressão de infecção ou a diminuição da capacidade imunológica em um indivíduo ocorrerá o que caracterizamos como doença.
Suínos desafiados imunologicamente são menos produtivos, e, além disso, aumentam os custos de produção por necessidade da utilização de medicamentos e intervenções veterinárias. Por outro lado, sabe-se, também, que a ativação do sistema imune demanda recursos orgânicos que podem comprometer o bom desempenho animal, isso porque, quando ativado, o sistema imune desvia parte de proteínas, vitaminas, energia e minerais para gerar a reação inflamatória e, assim diminuindo a disponibilidade destes para a deposição de proteínas. Assim, a nutrição está, diretamente, relacionada à capacidade dos suínos em apresentar resposta imunológica frente à situações de elevado desafio sanitário. Com isso, é necessário empregar níveis nutricionais que visem não só o máximo crescimento, mas que também propiciem o adequado funcionamento do sistema imunológico.
A Interação entre nutrição e imunidade é, particularmente, importante para o desenvolvimento e produtividade animal (Tabela 6). A nutrição pode modular quantitativamente e qualitativamente aspectos da resposta imune contra patógenos. Respostas do sistema imune contra patógenos influenciam a homeostase metabólica e necessidades nutricionais, entretanto, pouca atenção tem sido direcionada à eficiência da utilização deste mecanismo ou a sua significância prática.
Tabela 6. Eficiência de utilização de aminoácidos de suínos em crescimento, criados em sistema de produção convencional ou em sistema livre de agentes patogênicos (Adaptado de Visek, 1978 e Gaskins, 2009)
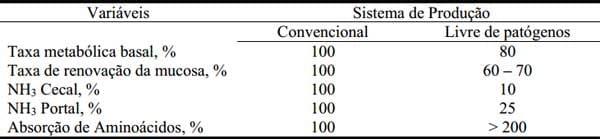
Os dados da tabela acima indicam que a eficiência de absorção de aminoácidos pela mucosa intestinal é 2 vezes superior quando o suíno é mantido em um sistema livre de agentes patogênicos ao comparar com o sistema convencional. Sendo assim, uma melhor compreensão dos processos bioquímicos e fisiológicos que limitam a eficiência de utilização dos aminoácidos no suíno para um bom crescimento intestinal e funcionamento do sistema imune torna-se fundamental para um adequado retorno econômico da atividade produtiva.
Máxima eficiência e produtividade em reprodutoras
O intenso trabalho de melhoramento genético realizado nos suínos terminadores, com o objetivo de obter uma maior eficiência alimentar e carcaças com maior teor de carne magra, também tem levado a alterações significativas nas matrizes atualmente disponíveis no mercado. As matrizes modernas são mais precoces, mais produtivas e possuem maior peso corporal, portanto, sendo nutricionalmente mais exigentes. A produtividade da fêmea suína aumentou de forma substancial nos últimos anos, devido ao manejo e avanços na seleção genética, seleção esta, baseada em parâmetros como: tamanho de leitegada, intervalo desmame estro e eficiência na lactação. É possível observar na Tabela 7 uma indicação do tipo de progresso alcançado nas 10% melhores granjas comerciais hoje na Holanda.
Tabela 7. Progresso alcançado em produtividade nas 10% melhores granjas comerciais na Holanda entre 2000 e 2009 (Fonte: TOPIGS Netherlands Annual Report 2010)
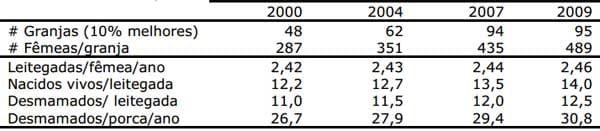
Os dados apresentados na Tabela 7 demonstram a eficiência da seleção genética balanceada, que traz associada uma maior capacidade reprodutiva das fêmeas e maior vigor e sobrevivência dos leitões, permitindo a produção de leitegadas maiores sem aumentar a mortalidade dos leitões (Figura 4). Os resultados indicam um crescimento estável de 0,35 leitões desmamados/fêmea/ano. Estes valores nos remetem a uma estimação para 2020 de 15 – 16 leitões nascidos vivos/leitegada ou 33 leitões desmamados/fêmea/ano. Neste momento não existem evidências de que este melhoramento já tenha alcançado o seu patamar máximo (e.x. raças chinesas com 17 leitões nascidos vivos).
Embora os avanços genéticos tornaram as fêmeas mais produtivas, as mesmas são mais exigentes nutricionalmente e menos resistentes aos desafios nutricionais. As necessidades nutricionais das fêmeas modernas, e a disponibilidade de nutrientes da dieta para as mesmas, são pouco conhecidas em comparação ao que se sabe em relação aos suínos em fase de crescimento e terminação.
As estimativas de energia para fêmeas gestantes foram determinadas por Noblet et al. (1997), onde os autores afirmam que mais de 60% das exigências de energia das fêmeas gestantes são representadas pela mantença, estando em torno de 0,44 MJ (ou 105 kcal) de EM/ kg de peso metabólico (PC0.75)/ dia, em condições de termoneutralidade. Este valor, segundo os mesmos autores não é significativamente influenciado pela ordem de parto, gestação e fase da gestação. Mais recentemente, Samuel et al. (2007) reavaliaram as necessidades de energia metabolizável de mantença para genótipos modernos (alta taxa de deposição de tecido magro e alta prolificidade) e observaram uma necessidade de 0,50 MJ (ou 120 kcal) de EM/ kg de peso metabólico (PC0.75)/ dia. Os mesmos autores concluiram que o valor sugerido por Noblet et al. (1997) e NRC (1998) para a atual população de fêmeas está abaixo da necessidade real em, aproximadamente, 14%. A provável explicação para as mudanças nestas necessidades estão relacionadas à queda no percentual de gordura corporal e no aumento do percentual de massa protéica, bem como o aumento das taxas de "turnover" protéico dos genótipos modernos.
Durante a gestação, as exigências protéicas de mantença têm sido estimadas com grande variabilidade, com valores entre 50 a 133 g de proteína/dia (Patience, 1996), podendo estar relacionada à massa protéica corporal. Fuller et al., (1989) e NRC (1998) estimaram a exigência diária de lisina para mantença em 36 mg para cada kg de peso metabólico (PC0,75). Recentemente, Samuel et al. (2008a) avaliaram as necessidades de lisina para mantença de fêmeas de genótipo moderno usando a oxidação de aminoácidos como indicadores. Estes autores encontraram que a necessidade de lisina é de 49 mg/ kg de peso metabólico (PC0,75); este valor excede a atual recomendação (Fuller et al., 1989; e NRC 1998) em 30%.
Existem mais informações disponíveis sobre as exigências de lisina do que de outros aminoácido essenciais. Entretanto, se aplicarmos a relação de proteína ideal utilizando a necessidade de lisina proposto por Samuel et al. (2008a), a necessidade de metionina seria 40% superior a recomendação atual. A metionina desempenha uma função essencial durante a gestação, incluindo a metilação de DNA durante o desenvolvimento embrionário/fetal, o que a torna extremamente importante para a regulação da expressão genética. Dourmad e Etienne (2002) concluíram que a necessidade de treonina durante a gestação para as fêmeas modernas é maior do que o valor proposto pelo NRC (1998), estes autores atribuem esta diferença a uma maior retenção de nitrogênio diária observada nas fêmeas modernas durante a gestação. Estes resultados corroboram para a hipótese de que as necessidades de aminoácidos dos genótipos modernos sejam maiores, em virtude de uma maior capacidade de deposição de tecido magro e "turnover" proteíco. Analisando estudos recentes com fêmeas de genótipos modernos, têm sido dada uma atenção em particular ao crescimento fetal (McPherson et al., 2004), desenvolvimento das glândulas mamárias (Ji et al., 2006), e ao crescimento materno (Ji et al., 2005). Os resultados obtidos por estes autores indicam um crescimento cúbico, tanto do tecido mamário, quanto dos fetos, principalmente, a partir dos 70 dias de gestação. Resultados estes, superiores aos observados em estudos similares nas décadas de 80 e 90.
Com base nos resultados das recentes pesquisas têm-se estimulado o estabelecimento de programas nutricionais baseados em mais de uma fase, e não mais uma única dieta durante todo o período de gestação para fêmeas nulíparas (McPherson et al., 2004) (Figura 5 e 6).
Informações atualizadas sobre a necessidade de energia para matrizes lactantes modernas são limitadas. O consumo inadequado de energia durante a lactação faz com que a matriz mobilize nutrientes de diferentes tecidos corporais, levando a uma significativa perda de peso significativa. A maioria dos trabalhos aponta para exigências energéticas de mantença semelhantes entre fêmeas gestantes e lactantes. Noblet et al. (1990) sugere diferentes valores, 0,46 (ou 110 kcal) e 0,44 (ou 105 kcal) MJ de EM/ kg de peso metabólico (PC0,75) para lactação e gestação, respectivamente. Porém estas diferenças parecem ser relativamente pequenas, da ordem de 5%. Mais recentemente, Samuel et al. (2007a, b, c, d) reestimaram a energia de mantença para fêmeas lactantes em 0,51 (ou 122 kcal) ± 0,07 (ou 16,73 kcal) MJ de EM/ kg de peso metabólico (PC0,75), 10% superior ao valor proposto por Noblet et al. (1990).
Em sistemas de manejo convencionais, leitões recém nascidos são capazes de atingir somente, uma fração do seu real potencial de crescimento durante a fase de lactação (Harrel et al., 1993). Nos últimos anos, este fato tem levado pesquisadores a focarem na importância dos nutrientes, em particular os aminoácidos, para otimizar o potencial das glândulas mamárias durante a lactação (Kim e Wu, 2008). O crescimento da glândula mamária durante esta fase afeta a quantidade de leite produzido pelas fêmeas, e por consequência, o crescimento dos leitões (Kim et al., 2000a). Desta forma, o manejo nutricional adotado durante a lactação deverá priorizar o máximo crescimento mamário. Quando fêmeas não recebem quantidades adequadas de aminoácidos na dieta, proteínas do tecido materno, particularmente, das proteínas musculares esqueléticas, são mobilizadas para atender à produção de leite. A mobilização excessiva de proteína materna, geralmente, resulta em falhas na atividade reprodutiva subsequente (Jones e Stahly, 1999).
O suíno moderno apresenta considerável potencial genético de ganho e eficiência de conversão alimentar, no entanto, para estabelecer um adequado programa de nutrição para estes animais, deve-se considerar o material genético da granja, suas necessidades nutricionais, os fatores que afetam essas necessidades, e deve-se possuir entendimento dos diversos aspectos metabólicos da interação entre o genótipo, nutrição e sanidade. Este entendimento é fundamental para que se possa alcançar, ao mesmo tempo, a máxima produtividade, longevidade e rentabilidade. Assim sendo, as dietas devem ser formuladas e ajustadas de acordo com o genótipo e cada fase da vida do animal, procurando sempre otimizar o potencial de consumo e manter o sistema imunológico equilibrado.
Literatura Citada
Ball, R.O.; R.S. Samuel and S. Moehn. 2008. Nutrient requirents of prolific sows. Advances in Pork Production. 19: 223.
Brown-Brandl, T. M., J. A. Nienaber, H. Xin, & R. S. Gates. 2004. A literature review of swine heat production. Trans. ASAE. 47(1): 259-270.
Chen, P., Baas, T.J., Mabry, J.W., Dekkers, J.C.M., Koehler, K.J., 2002. Genetic parameters and trends for lean growth rate and its components in U.S. Yorkshire, Duroc, Hampshire, and Landrace pigs. J. Anim. Sci. 80, 2062–2070
Canadian Centre for Swine Improvement. 2007. Annual report 2006/2007. http://www.ccsi.ca/meetings/annual/ann2007.pdf/
Cromwell, G.L., Davis, G.W., Morrow, W.E.M., Primo, R.A., Rozeboom, D.W., Sims, M.D., Sanisiewski, E.P., Ho, C.H., 1996. Efficacy of antimicrobial compound U-82, 127 as a growth promoter for grow-finishing pigs. J. Anim. Sci. 74, 1284–1287.
De la Llata, M., Dritz, S.S., Tokach, M.D., Goodband, R.D., Nelssen, J.L., Loughin, T.M., 2001. Effects of dietary fat on growth performance and carcass characteristics of growing–finishing pigs reared in a commercial environment. J. Anim. Sci. 79, 2643– 2650.
Dourmad, J.Y., & M. Etienne. 2002. Dietary lysine and threonine requirements of the pregnant sow estimated by nitrogen balance. J. Anim. Sci. 80: 2144-2150.
Fix, J.S., Cassady, J.P., E.van Heugten, D.J. Hanson, M.T. See. 2010. Differences in lean growth performance of pigs sampled from 1980 and 2005 commercial swine fed 1980 and 2005 representative feeding programs. Liv. Sci. 128: 108-114
Fuller, M.F.; McWilliams, R.; Wang, T.C. & Giles, L.R. 1989. The optimum dietary aminoacid pattern of growing pigs. 2. Requirements for maintenance and for tissue protein accretion. British J. Nutr., 62:225-267.
Harrell, R. J., M. J. Thomas, and R. D. Boyd. 1993. Limitations of sow milk yield on baby pig growth. Pages 156–164 in Proc. Cornell Nutr. Conf. Cornell Univ., Ithaca, NY.
Jones, D. B., and T. S. Stahly. 1999. Impact of amino acid nutrition during lactation on body nutrient mobilization and milk nutrient output in primiparous sows. J. Anim. Sci. 77:1513–1522.
Ji, F., W. L. Hurley, and S. W. Kim. 2006. Characterization of mammary gland development in pregnant gilts. J. Anim. Sci. 84:579–587.
Ji, F.; Wu, G.; Blanton, J.R. and Kim, S.W. 2005. Changes in weight and composition in various tissues of pregnant gilts and their nutritional implications. J. Anim. Sci., 83:366- 375.
Kim, S. W., and G. Wu. 2008. Regulatory role for amino acids in mammary gland growth and milk synthesis. Amino Acids doi:10.1007/s00726-008-0151-5.
Kim, S. W., W. L. Hurley, I. K. Han, and R. A. Easter. 2000a. Growth of nursing pigs related to the characteristics of nursed mammary glands. J. Anim. Sci. 78:1313–1318.
McPherson, R.L.; Ji, F.; Wu, G.; Blanton JR. J.R. and Kim, S.W. 2004. Growth and composition changes of fetal tissues in pigs. J. Anim. Sci., 82:2534-2540.
Noblet, J.; Dourmad, J.Y.; Etienne, M. & Le Dividich, J. 1997. Energy metabolism in pregnant sows and newborn pigs. J. Anim. Sci., 75:2708-2714.
Noblet, J.; Dourmad, J.Y. and Etienne, M. 1990. Energy utilization in pregnant and lactating sows: modeling of energy requirements. J. Anim. Sci., 68:562-572.
NATIONAL RESEARCH COUNCIL. – NRC. Nutrient requirements of swine. 10 ed. Washington, D.C. : National Academic Science, Committee Animal Nutrition. Subcommittee of Swine Nutrition, 1998. 189 p.
Patience, J.F. 1996. Meeting the energy and protein requirements of the high producing sow. Anim. Feed Sci. Technology, 58:49-64
Robison, O.W., Christian, L.L., Goodwin, R., Johnson, R.K., Mabry, J.W., Miller, R.K., Tokach, M.D., 2000. Effects of genetic type and protein levels on growth of swine. Proc. of the ASAS Meetings, Indianapolis, IN, pp. 1–9.
Samuel, R. S.; S. Moehn; P. B. Pencharz; and R. O. Ball. 2008a. Dietary lysine requirement for maintenance is 49 mg/kg0.75 in a population of modern, high producing sows. Advances in Pork Production. 19: A1.
Samuel, R.S.; S. Moehn; P.B. Pencharz; and R.O. Ball. 2007. Estimates of energy requirements during gestation and lactation in sows. Advances in Pork Production. 18: A9.
Topigs do Brasil. Manual de alimentação da progênie TEMPO 2010.
Witte, D.P., Ellis, M., McKeith, F.K., Wilson, E.R., 2000. Effect of dietary lysine level and environmental temperature during the finishing phase on the intramuscular fat content of pork. J. Anim. Sci. 78, 1272–1276.
Wondra, K.J., Hancock, J.D., Behnke, K.C., Hines, R.H., Stark, C.R.Stark, 1995. Effects of particle size and pelleting on growth performance, nutrient digestibility and stomach morphology in finishing swine. J. Anim. Sci. 73, 757–763.
Conteúdo do evento:
Tópicos relacionados:
Autores:
Universidade Federal de Minas Gerais - UFMG
Recomendar
Comentário
Compartilhar

16 de octubre de 2014
Esta discussão me auxiliou muito para apresentação de um trabalho na faculdade. Obrigada Professor!
Recomendar
Responder

Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.






