Eritrograma e estresse oxidativo em bovinos confinados alimentados com feno de Brachiaria sp. e suplementados com antioxidantes
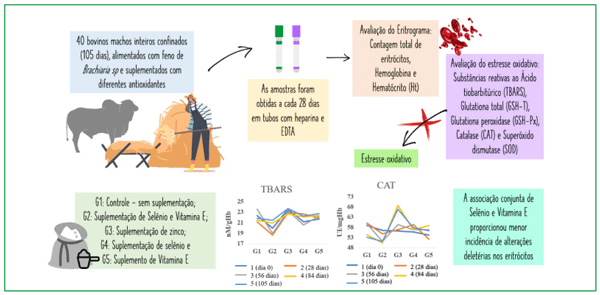
As Brachiaria sp contêm esporidesminas que podem ser oxidadas por lipoperoxidação e ocasionar estresse oxidativo. No presente estudo foram avaliados os efeitos de diferentes antioxidantes na lipoperoxidação dos eritrócitos de bovinos da raça Nelore, alimentados com feno de Brachiaria sp. O delineamento experimental foi inteiramente casualizado, em que 40 bovinos machos, inteiros, foram divididos, em cinco tratamentos (G1: controle - sem suplementação; G2: suplementação de selênio e vitamina E; G3: suplementação de zinco; G4:suplementação de selênio e G5: suplementação de vitamina E) e alocados em baias de confinamento, por 105 dias. As amostras de plasma heparinizado ou com ácido etilenodiaminotetra-acético (EDTA) foram obtidas a cada 28 dias para avaliação hematológica e de estresse oxidativo (0, 28 56, 84 e 105 dias). No eritrograma foi mensurado a contagem total de eritrócitos, a hemoglobina e o hematócrito (Ht). Para a avaliação do estresse oxidativo, com o objetivo de analisar as características da membrana do eritrócito foram determinadas assubstâncias reativas ao ácido tiobarbitúrico (TBARS), glutationa total (GSH-T), glutationa peroxidase (GSH-Px), catalase (CAT) e superóxido dismutase (SOD). Os resultados demonstraram que independente do tratamento não houve estresse oxidativo durante o períododo confinamento experimental e que a associação conjunta de selênio e vitamina E na dieta dos bovinos proporcionaram menor incidência de alterações deletérias sobre os eritrócitos.
Palavras- chaves: enzimas antioxidantes; eritrócito; espécies reativas de oxigênio (ROS); lipoperoxidação; Nelore.
Resumo gráfico: Eritrograma e estresse oxidativo em bovinos confinados alimentados com feno de Brachiaria sp. e suplementados com antioxidantes








- CEPEA 2020 - CEPAE/USP. Centro de Estudos Avançados em Economia Aplicada. Desenvolvido pela Universidade de São Paulo, 2020 [Internet]. Disponível em: https://cepea.esalq.usp.br/br/releases/cepea-retrospectivas-de-2020.aspx. Acesso em: 9 out 2021.
- Seixas JN, Pinto CA, Rodrigues A, Tokarnia CH, França TN, Graça F.S, d´Avila MS, Peixoto PV. Comparative study between Brachiaria spp. and Pithomyces chartarum poisoning in cattle. Rev. Bras. Med. Vet. 2016; 38(Supl.2):1-10. https://rbmv.org/BJVM/article/view/192
- Sordillo LM. Nutritional strategies to optimize dairy cattle im‐ munity. J. Dairy Sci. 2016; 99(6):4967-4982. https://doi.org/ 2022, Cienc. Anim. Bras., V23, e-70611P 10.3168/jds.2015-10354.
- Brasil. Ministério da Agricultura, Pecuária e Abastecimento. Projeções do Agronegócio: Brasil 2012/2013 a 2022/2023. As‐ sessoria de Gestão Estratégica, 4ª ed., Brasília, 2013. 96 p.
- Soares CO, Rosinha GMS. Segurança alimentar, sustentabilldade e produçao de proteına de origem animal. In. Vilela, E. F.; Callegaro, G. M.; Fernandes, G. W. Coord. Biomas e agricultu‐ ra: oportunidades e desafios. Rio de Janeiro: Vertente edições, 2019. p.149-162.
- Clayton MJ, Davis TZ, Knoppel EL, Stegelmeier BL. Hepa‐ totoxic Plants that Poison Livestock. Vet. Clin. North Am. Food Anim. Pract. 2020; 36(3):715-723. https://doi.org/10.1016/j.cvfa.2020.08.003.
- Motta AC, Riet-Correa Rivero G, Schild AL, Riet-Correa F, Méndez MC, Ferreira JL. Fotossensibilização hepatógena em bovinos no sul do Rio Grande do Sul. Ciênc. Rural. 2000; 30(1):143-149. https://doi.org/10.1590/S0103-84782000000100023.
- Macedo MF, Bezerra MB, Soto Blanco B. Fotossensibiliza‐ ção em animais de produção na região semi-árida do Rio Grande do Norte. Arq. Inst. Biol. 2006; 73(2):251-254. https://www.re‐searchgate.net/publication/242143971.
- Vivanco RHC, Menge FGW, Barriga PAC. Variations of the erythrocyte osmotic fragility in cattle grazing on pastures with low selenium content with or without supplement with sele‐ nium. Rev. Cient. 2006; 16(3):227-231. https://www.research‐gate.net/publication/286828714.
- Cruz C, Driemeier D, Pires VS, Schenkel EP. Experimentally induced cholangiopathy by dosing sheep with fractionated ex‐ tracts from Brachiaria decumbens. J. Vet. Diagn. Invest. 2001; 13(2):170-172. http://doi.org/10.1177/104063870101300215.
- Brum KB, Haraguchi M, Garutti MB, Nóbrega FN, Rosa B, Fioravanti MCS. Steroidal saponin concentrations in Brachiaria decumbens and B. brizantha at diferent develomental stages. Ciênc. Rural. 2009; 39(1):279-281. https://doi.org/10.1590/S0103-84782008005000034.
- Miles CO, Munday SC, Holland PT, Smith BL, Embling PP, Wilkins AL. Identification of a sapogenin glucoronide in the bile of sheep affected by Panicum dichotomiflorum toxicosis. N Z Vet J. 1991; 39(4):150-152. http://doi.org/10.1080/00480169.1991.35684.
- Santos JCA, Riet-Correa F, Simiões SV, Barros CSL. Patogê‐ nese, sinais clínicos e patologia das doenças causadas por plan‐ tas hepatotóxicas em ruminantes e equinos no Brasil. Pesqui. Vet. Bras. 2008; 28(1):1-14. https://doi.org/10.1590/S0100-736X2008000100001.
- Sies. H. 2019. Oxidative Stress: Eustress and Distress in Re‐ dox Homeostasis. In: Fink G. (Ed.) Stress: Physiology, Bio‐ chemistry, and Pathology, Handbook of Stress Series, London: Academic Press, Vol. 3, Chapter 13, p.153-163. https://doi.org/10.1016/B978-0-12-813146-6.00013-8.
- Droge W. Free radicals in the physiological control of cell function. Physiol. Rev. 2002; 82(1):47-95. https://doi.org/10.1152/physrev.00018.2001.
- Brezezinska-Slebodziska E. Species differences in the sus‐ ceptibility of erythrocytes exposed to free radicals in vitro. Vet. Res. Comm. 2003; 27(3):211-217. https://doi.org/10.1023/a:1023344607691.
- Oliveira S, Saldanha C. An overview about erythrocyte membrane. Clin. Hemorheol. Microcirc. 2010; 44(1):63-74. https://doi.org/10.3233/CH-2010-1253.
- Pandey KB, Rizvi SI. Biomarkers of oxidative stress in red blood cells. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub. 2011; 155(2):131-136. https://doi.org/10.5507/bp.2011.027.
- Florin-Christensen J, Suarez CE, Florin-Christensen M, Wainszelbaum M, Brown WC, Mcelwain TF, Palmer GH. A unique phospholipid organization in bovine erythrocyte mem‐ branes. Proc. Natl. Acad. Sci. USA. 2001; 98(14):7736-7741. https://doi.org/ 10.1073/pnas.131580998.
- Caldin M, Carli E, Furlanello T, Solano-Gallego L, Tasca S, Pa‐ tron C, Lubas G. A retrospective study of 60 cases of eccentrocy‐ tosis in the dog. Vet. Clin. Pathol. 2005; 34(3):224-231. https://doi.org/ 10.1111/j.1939-165x.2005.tb00045.x.
- Tang X, Xia Z, Yu J. An experimental study of hemolysis in‐ duced by onion (Allium cepa) poisoning in dogs. J. Vet. Pharma‐ col. Ther. 2008; 31(2):143-149. https://doi.org/ 10.1111/j.1365-2885.2007.00930.x.
- Barbosa KBF, Costa NMB, Alfenas RCG, Paula SO, Minim VPR, Bressan J. Oxidative stress: concept, implications and modulating factors. Rev. Nutr. 2010; 23(4):629-643, https://doi.org/10.1590/S1415-52732010000400013
- Cimen MY. Free radical metabolism in human erythrocytes. Clin. Chim. Acta. 2008; 390(1-2):1-11. https://doi.org/10.1016/j.cca.2007.12.025.
- Todovora I, Simeonova G, Kyuchukova D, Dinev D, Gad‐ jeva V. Reference values of oxidative stress parameters (MDA, SOD, CAT) in dogs and cats. Comp. Clin. Pathol. 2005; 13(4):190-194. https://doi.org/10.1007/s00580-005-0547-5.
- Machado LP, Watanabe MJ, Kohayagawa A, Saito ME, Da Silveira VF, Yonezawa LA. Malondialdeído eritrocitário como índice de estresse oxidativo em equinos da raça Árabe. Rev. Bras. Hematol. Hemoter. 2007; 29:237. https://doi.org/10.1590/S0103-84782010005000094.
- Ciampi F, Sordillo LM, Gandy JC, Caroprese M, Sevi A, Al‐ benzio M, Santillo A. Evaluation of natural plant extracts as an‐ tioxidants in a bovine in vitro model of oxidative stress. J. Dairy Sci. 2020; 103(10):8938-8947. https://doi.org/10.3168/jds.2020-18182.
- Spears JW, Weiss WP. Role of antioxidants and trace ele‐ ments in health and immunity of transition dairy cows, Vet J. 2008; 176(1):70-76. https://doi.org/10.1016/j.tvjl.2007.12.015.
- Mattioli GA, Rosa DE, Turic E, Picco SJ, Raggio SJ, Miner‐ vino AHH, Fazzio LE. Effects of Parenteral Supplementation with Minerals and Vitamins on Oxidative Stress and Humoral Immune Response of Weaning Calves. Animals (Basel). 2020; 10(8):1298. https://doi.org/10.3390/ani10081298.
- NRC - NATIONAL RESEARCH COUNCIL. Nutrient re‐ quirements of beef cattle. 7.ed. Washington: National Academy Press, 1996. 242p.
- Jain NC. Essentials of veterinary hematology. 4. ed. Philadel‐ phia: Lea & Febiger, 1993. 407p.
- Esterbauer H, Cheeseman KH. Determination of aldehydic lipid peroxidation products: malonaldehyde and 4-hydrox‐ ynonenal. Methods Enzymol. 1990; 186:407-21. https://doi.org/10.1016/0076-6879(90)86134-h.
- Tietze F. Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione: applica‐ tions to mammalian blood and other tissues. Anal. Biochem. 1969; 27(3):502-22. https://doi.org/ 10.1016/0003-2697(69)90064-5.
- Bayoumi RA, Rosalki SB. Evaluation of methods of coen‐ zyme activation of erythrocyte enzymes for detection of defi‐ ciency of vitamins B1, B2, and B6. Clin. Chem. 1976; 22(3):327-335.
- Beutler E. Superoxide dismutase. In: Beutler E (Editor), Red Cell Metabolism. A Manual of Biochemical Methods. Philadel‐ phia: Grune & Stratton, 1984. p.83-85.
- Aebi H. Catalase in vitro. Methods Enzymol. 1984; 105:121- 126. https://doi.org/10.1016/s0076-6879(84)05016-3.
- Fagliari JJ, Santana AE, Lucas FA, Campos Filho E, Curi PR. Constituintes sanguíneos de bovinos lactantes, desmamados e adultos das raças Nelore (Bos indicus) e Holandesa (Bos tau‐ rus), e de bubalinos (Bubalus bubalis) da raça Murrah. Arq. Bras. Med. Vet. Zootec. 1998; 50(3):263-271. https://repositori‐o.unesp.br/handle/11449/38249.
- Machado LP, Kohayagawa A, Saito ME, Da Silveira VF, Yo‐ nezawa LA. Lesão oxidativa eritrocitária e mecanismos antioxi‐ dantes de interesse na Medicina Veterinária. Rev. Ciênc. Agro‐ vet. 2009; 8(1):84-94. https://www.revistas.udesc.br/index.php/agroveterinaria/article/view/5317/3523
- Sharma N, Singh NK, Singh OP, Pandey V, Verma PK. Ox‐ idative stress and antioxidant status during transition period in dairy cows. Asian-Aust. J. Anim. Sci. 2011; 24(4):479-484. https://doi.org/ 10.5713/ajas.2011.10220.
- Calamari L, Petrera F, Abeni F, Bertin G. Metabolic and hematological profiles in heat stressed lactating dairy cowsfed diets supplemented with different selenium sources and doses. Livest. Sci. 2011; 142(1-3):128-137. https://doi.org/10.1016/j.livsci.2011.07.005.
- Kouryi JC, Donangelo CM. Zinco, estresse oxidativo e ativi‐ dade física. Rev. Nutr. 2003; 16(4):433-441. https://doi.org/10.1590/S1415-52732003000400007.
- Bian X, Teng T, Zhao H, Qin J, Qiao Z, Sun Y, Liun Z, Xu Z. Zinc prevents mitochondrial superoxide generation by inducing mitophagy in the setting of hypoxia/reoxygenation in cardiac cells. Free Radic. Res. 2018; 52(1):80-91. https://doi.org/10.1080/10715762.2017.1414949.
- Kloubert V, Rink L. Zinc as a micronutrient and its preven‐ tive role of oxidative damage in cells. Food Funct. 2015;6(10):3195-3204. https://doi.org/ 10.1039/c5fo00630a.
- Oteiza PI. Zinc and the modulation of redox homeosta- sis. Free Radic. Biol. Med. 2012; 53(9):1748-1759. https://doi.org/10.1016/j.freeradbiomed.2012.08.568.
- Draper HH, Hadley M. Malondialdehyde determination as index of lipid peroxidation. Methods Enzymol. 1990; 186:421-431. https://doi.org/10.1016/0076-6879(90)86135-i.
- Liu ZL, Yang P, Chen P, Dong WX, Wang DM. Supplemen‐ tation with selenium an vitamin E improves milk fat depression an fatty acid composition in dairy cows fed fat diet. Asian-Aust. J. Anim. Sci. 2008; 21(6): 38-844. https://doi.org/10.5713/ajas.2008.70618.
- Križanović D, Sušić V, Božić P, Štoković I, Ekert-Kabalin A. Changes of bovine blood lipid peroxides and some antioxidants in the course of growth. Veterinarski Arhiv. 2008; 78 (4):269-278. https://hrcak.srce.hr/26534.
- Chandra G, Aggarwal A, Singh K, Kumar M, Upadhyay RC. Effect of vitamin E and zinc supplementation on energy metab‐ olites, lipid peroxidation, and milk production in peripartum sahiwal cows. Asian-Aust. J. Anim. Sci. 2013; 26(11):1569-1576. https://doi.org/10.5713/ajas.2012.12682.
- Castillo C, Hernandez J, Bravo A, Lopez-Alonso M, Pereira V, Benedito JL. Oxidative status during late pregnancy and early lactation in dairy cows. Vet J. 2005; 169(2):286-292. https://doi.org/10.1016/j.tvjl.2004.02.001.
- Castillo C, Hernandez J, Valverde I, Pereira V. Plasma mal‐ onaldehyde (MDA) and total antioxidant status (TAS) during lactation in dairy cows. Res. Vet. Sci. 2006; 80(2):133-139. http‐s://doi.org/10.1016/j.rvsc.2005.06.003.
- Kumar A, Gyanendra Singh BV, Meur SK. Modulation of antioxidant status and lipid peroxidation in erythrocyte by di‐ etary supplementation during heat stress in buffaloes. Livest. Sci. 2011; 138(1-3):299-303. https://doi.org/10.1016/j.livsci.2010.12.021.
- Halliwell B, Gutteridge JMC. Free radicals in biology and medicine. Oxford: Clarendon Press, 2007, 543p.
- Ma X, Deng D, Chen W. Inhibitors and Activators of SOD, GSH-Px, and CAT. In: Murat Senturk. Enzyme inhibitors and activators. 1nd ed. Croatia: IntechOpen; 2017. Chapter 9. https://doi.org/ 10.5772/65936.
- Machefer G, Groussard C, Ranou-Bekono F, Zouhal H, Faure H, Vicent S, Cillard J, Gratas-Delamarche A. Extreme running competition decrease blood antioxidant defense capac‐ ity. J. Am. Coll. Nutr. 2004; 23(4):358-364. https://doi.org/10.1080/07315724.2004.10719379.
- Abd Ellah MR, Okada K, Goryo M, Oishi A, Yasuda J. Su‐ peroxide dismutase activity as a measure of hepatic oxidative stress in cattle following ethionine administration. Vet. J. 2009; 182(2):336-341. https://doi.org/10.1016/j.tvjl.2008.05.013.
- Dobbelaar P, Bouwstra RJ, Goselink RMA, Jorritsma R, Van Den Borne JJGC, Jansen EHJM. Effects of vitamin e supple‐ mentation on and the association of body condition score with changes in peroxidative biomarkers and antioxidants around calving in dairy heifers. J. Dairy Sci. 2010;
- Felton GW, Summers CB. Antioxidant systems in insects. Arch. Insect Biochem. Physiol. 1995; 29(2):187-197. https://doi.org/10.1002/arch.940290208.
- Linke A, Adams V, Schulze PC, Erbs S, Gielen S, Fiehn E. Antioxidative effects of exercise training patients with chronic heart failure increase in radical scavenger enzyme activity in skeletal muscle. Circulation. 2005; 111(14):1763-1770. https://doi.org/10.1161/01.CIR.0000165503.08661.E5.




