Carboidrases exógenas e a saúde intestinal de aves
A maior parte dos ingredientes destinados a alimentação de animais não ruminantes se constituem de origem vegetal e podem conter, em sua composição, níveis variáveis de polissacarídeos não amiláceos (PNAs). Estes são conhecidos por comprometerem, a depender dos níveis de inclusão do ingrediente, concentrações e tipos nos alimentos, o desempenho e a saúde intestinal de suínos e aves. As carboidrases são enzimas que degradam carboidratos e tem sido utilizada como alternativas para melhorias no aproveitamento de fontes alimentares que contenham grandes quantidades de PNAs, com resultados positivos sobre aproveitamento energético da dieta e diminuindo os efeitos negativos desses compostos. Celulases, xilanases, betaglucases, amilases, galactosidades, dentre outras tem sido suplementadas nas rações desses animais e têm mostrado serem afetivas em melhorar as características morfométricas, estado imunológico e microbiano do intestino, com impactos positivos sobre a saúde intestinal e desempenho. Logo, estre trabalho teve por objetivo revisar os efeitos da utilização e enzimas carboidrases na dieta de aves e seus efeitos sobre a saúde intestinal.
Palavras-chave: Aditivos; Enzimas; Ingredientes; Saúde intestinal.
Abreu, J. A. D. C. (2017). Dissertação de Mestrado. Adição combinada de carboidrases e óleos essenciais em dietas de novilhos confinados.
Adeola, O. & Bedford, M. R. (2004). Exogenous dietary xylanase ameliorates viscosity-induced anti-nutritional effects in wheat-based diets for White Pekin ducks (Anas platyrinchos domesticus). British Journal of Nutrition, 92 (1), 87-94.
Anwar, M. I., Muhammad, F., Awais, M. M., & Akhtar, M. (2017). A review of β-glucans as a growth promoter and antibiotic alternative against enteric pathogens in poultry. World’s Poultry Science Journal, 73 (3), 651–661.
Apajalahti, J. & Vienola, K. (2016). Interaction between chicken intestinal microbiota and protein digestion. Animal Feed Science and Technology, 221 (2016), 323-330.
Apperson, K. D. & Cherian, G. (2017). Effect of whole flax seed and carbohydrase enzymes on gastrointestinal morphology, muscle fatty acids, and production performance in broiler chickens. Poultry Science, 96 (5), 1228-1234.
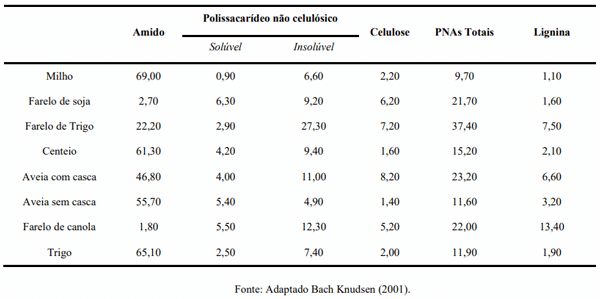
Bach Knudsen, K.E. (2001). The nutritional significance of “dietary fibre” analysis. Animal Feed Science and Technology, 90 (1-2), 3-20.
Bach Knudsen, K. E. (2014). Fiber and nonstarch polysaccharide content and variation in common crops used in broiler diets. Poultry Science, 93 (9), 2380- 2393.
Baurhoo, B., Phillip, L. & Ruiz-Feria, C. A. (2007). Effects of purified lignin and mannan oligosaccharides on intestinal integrity and microbial populations in the ceca and litter of broiler chickens. Poultry Science, 86 (6), 1070-1078.
Bederska-Łojewska, D., Swiątkiewicz, S., Arczewska-Włosek, A. & Schwarz, T. (2017). Rye non-starch polysaccharides: their impact on poultry intestinal physiology, nutrients digestibility and performance indices–a review. Annals of Animal Science, 17 (2), 351-369.
Bedford, M. R. (1995). Mechanism of action and potential environmental benefits from the use of feed enzymes. Animal Feed Science and Technology, 53 (2), 145-155.
Bedford, M. & Cowieson, A. J. (2012). Exogenous enzymes and their effects on intestinal microbiology. Animal Feed Science and Technology, 173(1-2), 76- 85.
Biswas, A. & Kobayashi, K. S. Regulation of intestinal microbiota by the NLR protein family. International Immunology, 25 (4), 207-214.
Bozkurt, M., Aysul, N., Küçükyilmaz, K., Aypak, S., Ege, G., Catli, A. U. & Çinar, M. Efficacy of in-feed preparations of an anticoccidial, multienzyme, prebiotic, probiotic, and herbal essential oil mixture in healthy and Eimeria spp.-infected broilers. Poultry Science, 93 (2), 389-399.
Carré, B. Causes for variation in digestibility of starch among feedstuffs. Poultry Science, v.60 (1), 76-89.
Caspary, W.F. 1992. Physiology and pathophysiology of intestinal absorption. The American Journal of Clinical Nutrition, 55 (2) 299–308.
Cheng, Y., Chen, Y., Li, J., Qu, H., Zhao, Y., Wen, C. & Zhou, Y. Dietary β-Sitosterol improves growth performance, meat quality, antioxidant status, and mitochondrial biogenesis of breast muscle in broilers. Animals, 9 (3), 71-83.
Choct, M., Hughes, R. J., Wang, J., Bedford, M. R., Morgan, A. J. & Annison, G. Increased small intestinal fermentation is partly responsible for the anti‐nutritive activity of non‐starch polysaccharides in chickens. British Poultry Science, 37 (3), 609-621.
Choct, M. Feed non-starch polysaccharides: chemical structures and nutritional significance. Feed Milling International, 191 (6), 13-26.
Choct, M, Hughes, R. J. & Bedford, M. R. Effects of a xylanase on individual bird variation, starch digestion throughout the intestine, and ileal and caecal volatile fatty acid production in chickens fed wheat. British Poultry Science, 40 (3), 419-422.
Choct, M. 2001. Enzyme supplementation of poultry diets based on viscous cereals. Enzymes in Farm Animal Nutrition. Book.
Choct, M., Kocher, A., Waters, D. L. E., Pettersson, D. & Ross, G. A comparison of three xylanases on the nutritive value of two wheats for broiler chickens. British Journal of Nutrition, v.92 (1), 53-61.
Choct, M. Feed polysaccharides: nutritional roles and effect of enzymes. 2010. In: IV Congresso Latino Americano de Nutrição Animal - IV CLANA, 65-78.
Cowieson, A. J., Wilcock, P., & Bedford, M. R. Super-dosing effects of phytase in poultry and other monogastrics. World’s Poultry Science Journal, 67 (2), 225–236.
Craig, A. D., Khattak, F., Hastie, P., Bedford, M. R. & Olukosi, O. A. The similarity of the effect of carbohydrase or prebiotic supplementation in broilers aged 21 days, fed mixed cereal diets and challenged with coccidiosis infection. Plos One, 15 (2), e0229281.
Cummings, D. E. & Overduin, J. V. Gastrointestinal regulation of food intake. The Journal of Clinical Investigation, 117 (1), 13-23.
Delmaschio, I. Enzimas na alimentação de animais monogástricos-revisão de literatura. Revista Científica de Medicina Veterinária-UNORP, 2 (1), 6-20.
Dittoe, D. K., Ricke, S. C. & Kiess, A. S. Organic acids and potential for modifying the avian gastrointestinal tract and reducing pathogens and disease. Frontiers in Veterinary Science, v.5 (1), 216-228.
Dworkin, L. D., Levine, G. M., Farber, N. J. & Spector, M. H. Small intestinal mass of the rat is partially determined by indirect effects of intraluminal nutrition. Gastroenterology, 71 (4), 626-630.
Engberg, R. M., Hedemann, M. S., Steenfeldt, S. & Jensen, B. B. Influence of whole wheat and xylanase on broiler performance and microbial composition and activity in the digestive tract. Poultry Science, 83 (6), 925-938.
Ferreira, C. B., Geraldo, A., Vieira Filho, J. A., Brito, J. Á. G. D., Bertechini, A. G. & Pinheiro, S. R. F. Associação de carboidrases e fitase em dietas valorizadas e seus efeitos sobre desempenho e qualidade dos ovos de poedeiras leves. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 67 (1), 249- 254.
Ferrer, C., Pedragosa, E., Torras-Llort, M., Parcerisa, X., Rafecas, M., Ferrer, R. & Moreto, M. Dietary lipids modify brush border membrane composition and nutrient transport in chicken small intestine. The Journal of Nutrition, 133 (4), 1147-1153.
Fireman, F. A. T. & Fireman, A. K. B. A. T. Enzimas na alimentação de suínos. Ciência Rural, 28 (1), 173-178.
Fortes, B. D. A., Café, M. B., Stringhini, J. H., Brito, J. Á. G., Rezende, P. L. D. P. & Silva, R. D. Avaliação de programas nutricionais com a utilização de carboidrases e fitase em rações de frangos de corte. Ciência Animal Brasileira, 13 (1), 24-32.
Furlan, R. L., Macari, M. & Sugeta, S. M. (2002). Fisiologia aviária aplicada a frangos de corte. Book.
Grecco, E. T., Marcato, S. M., Oliveira, T. M. M., Stanquevis, C. E., Grieser, D. O., Perine, T. P. & Benites, M. I. Effects of the Dietary Inclusion of Xylanase on the Performance and Jejunum Morphometry of Meat-Type Quails. Brazilian Journal of Poultry Science, 21 (4), 1-8.
Grecco, É. T., Marcato, S. M., Oliveira-Bruxel, T. M. D., Stanquevis, C. E., Grieser, D. D. O., Finco, E. M. & Ferreira, M. F. Z. Xylanase for meat-type quails from 15 to 35 days old. Revista Brasileira de Zootecnia, 48 (1), e20180252.
Guo, S., Liu, D., Zhang, B., Li, Z., Li, Y., Ding, B. & Guo, Y. Two Lactobacillus species inhibit the growth and α-toxin production of Clostridium perfringens and induced proinflammatory factors in chicken intestinal epithelial cells in vitro. Frontiers in Microbiology, 8 (1), 2081-2093.
Huntley, N. F., Nyachoti, C. M. & Patience, J. F. Lipopolysaccharide immune stimulation but not β-mannanase supplementation affects maintenance energy requirements in young weaned pigs. Journal of Animal Science and Biotechnology, 9 (1), 47-61.
Jasim, M. S., Fadel, G. Y. Effect of feed supplementation of probiotic and digestive enzymes in production performance and intestinal biometrics of laying hens. Plant Archives, 20 (1), 1773-1781.
Jha, R. & Berrocoso, J. D. Dietary fiber utilization and its effects on physiological functions and gut health of swine. Animal, 9 (9), 1441-1452.
Jia, W., Slominski, B. A., Bruce, H. L., Blank, G., Crow, G., & Jones, O. Effects of diet type and enzyme addition on growth performance and gut health of broiler chickens during subclinical Clostridium perfringens challenge. Poultry Science, 88(1), 132-140.
Khattak, F. M., Pasha, T. N., Hayat, Z. & Mahmud, A. Enzymes in poultry nutrition. Journal of Animal Poultry Science, 16 (1-2), 1-7.
Kiarie, E., Nyachoti, C. M., Slominski, B. A. & Blank, G. Growth performance, gastrointestinal microbial activity, and nutrient digestibility in early-weaned pigs fed diets containing flaxseed and carbohydrase enzyme. Journal of Animal Science, 85 (11), 2982-2993.
Klein, B. G. (2015). Cunningham Tratado de Fisiologia Veterinária. Book. Koblitz, M. G. B. (2013). Bioquímica de alimentos: teoria e aplicações práticas. Book. Kogut, M. H. 2019. The effect of microbiome modulation on the intestinal health of poultry. Animal Feed Science and Technology, 250 (2019), 32-40.
Lee, S. A., Wiseman, J., Masey O’Neill, H. V., Scholey, D. V., Burton, E. J. & Hill, S. E. Understanding the direct and indirect mechanisms of xylanase action on starch digestion in broilers. Journal of World's Poultry Research, 7 (2), 35-47.
Lei, X. J., Lee, K. Y. & Kim, I. H. Performance, egg quality, nutrient digestibility, and excreta microbiota shedding in laying hens fed corn-soybean-mealwheat-based diets supplemented with xylanase. Poultry Science, 97(6), 2071-2077.
Li, K., Bihan, M.,, Yooseph, S., & Methe, B. A. . Analyses of the microbial diversity across the human microbiome. Plos One, 7 (6), e32118.
Liu, D., Guo, Y., Wang, Z. & Yuan, J. Exogenous lysozyme influences Clostridium perfringens colonization and intestinal barrier function in broiler chickens. Avian Pathology, 39 (1), 17-24.
Liu, D., Guo, S., & Guo, Y. Xylanase supplementation to a wheat-based diet alleviated the intestinal mucosal barrier impairment of broiler chickens challenged by Clostridium perfringens. Avian Pathology, 41 (3), 291-298.
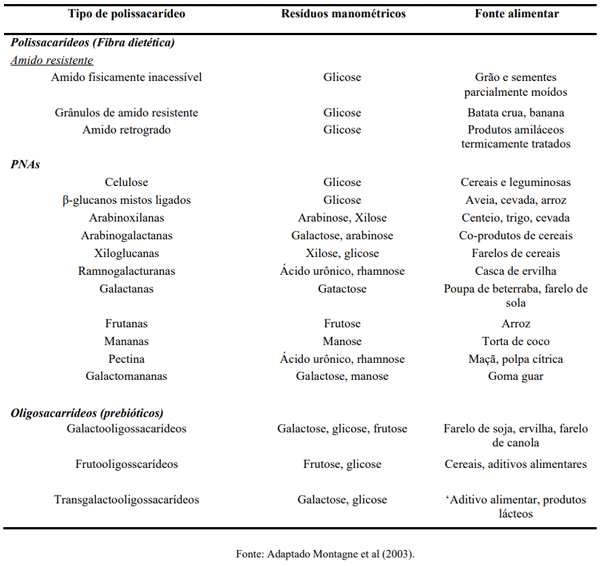
Montagne, L., Pluske, J. R. & Hampson, D. J. A review of interactions between dietary fibre and the intestinal mucosa, and their consequences on digestive health in young non-ruminant animals. Animal Feed Science and Technology, 108 (1-4), 95-117.
Munyaka, P. M., Nandha, N. K., Kiarie, E., Nyachoti, C. M. & Khafipour, E. Impact of combined β-glucanase and xylanase enzymes on growth performance, nutrients utilization and gut microbiota in broiler chickens fed corn or wheat-based diets. Poultry Science, 95(3), 528-540.
Nishio, J., Honda, K. Immunoregulation by the gut microbiota. Cellular and Molecular Life Sciences, 69 (21), 3635-3650.
Nitrayová, S., Heger, J., Patráš, P., Kluge, H. & Brož, J. Effect of xylanase on apparent ileal and total tract digestibility of nutrients and energy of rye in young pigs. Archives of Animal Nutrition, 63 (4), 281-291.
Opalinski, M., Maiorka, A., Cunha, F. D., Rocha, C. D. & Borges, S. A. Adição de complexo enzimático e da granulometria da soja integral desativada melhora desempenho de frangos de corte. Ciência Rural, 40 (3), 628-632.
Paloheimo, M., Bedford, M.R. & Partridge, G.G. (2011). Xylanases and Cellulases as Feed Additives Enzymes in Farm Animal Nutricion. Book. Pariza, M. W. & Cook, M. Determining the safety of enzymes used in animal feed. Regulatory Toxicology and Pharmacology, 56 (3), 332-342.
Pineda-Quiroga, C., Atxaerandio, R., Zubiria, I., gonzalez-pozuelo, I., Hurtado, A., Ruiz, R. & Garcia-Rodriguez, A. Productive performance and cecal microbial counts of floor housed laying hens supplemented with dry whey powder alone or combined with Pediococcus acidilactici in the late phase of production. Livestock Science, 195 (1), 9-12.
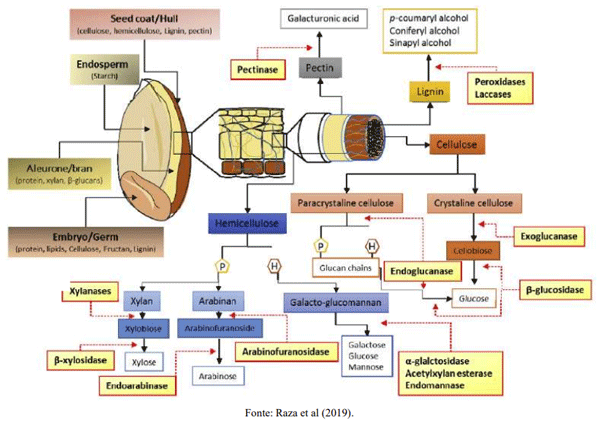
Raza, A., Bashir, S. & Tabassum, R. An update on carbohydrases: growth performance and intestinal health of poultry. Heliyon, 5 (4), e01437, 2019.
Romero, L. F., Parsons, C. M., Utterback, P. L., Plumstead, P. W. & Ravindran, V. Comparative effects of dietary carbohydrases without or with protease on the ileal digestibility of energy and amino acids and AMEn in young broilers. Animal Feed Science and Technology, 181 (1-4), 35-44.
Roofchaei, A., Rezaeipour, V., Vatandour, S. & Zaefarian, F. Influence of dietary carbohydrases, individually or in combination with phytase or an acidifier, on performance, gut morphology and microbial population in broiler chickens fed a wheat-based diet. Animal Nutrition, 5 (1), 63-67.
Santin, E., Maiorka, A., Macari, M., Grecco, M., Sanchez, J. C., Okada, T. M. & Myasaka, A. M. Performance and intestinal mucosa development of broiler chickens fed diets containing Saccharomyces cerevisiae cell wall. Journal of Applied Poultry Research, 10 (3), 236-244.
Silva, D. M., Rodrigues, D. R., Gouveia, A. B. V. S., Mesquita, S. A., Santos, F. R. & Minafra, C. S. Carboidrases em rações de frangos de corte. PUBVET, v.10 (11), 795-872.
Silva, S. A. A., De Paulo, L. M., Silva, N. G. D., Gouveia, A. B. V. S., Sampaio, S. A., Santos, F. R. & Minafra, C. S. (2018). Dehydrated Orange pomace and carbohydrates in the diet of Japanese quails on the biometrics of the gastrointestinal tract. In 55ª Reunião Anual da Sociedade Brasileira de Zootecnia, 28º Congresso Brasileiro de Zootecnia. Abstract.
Smith, A. L., Powers, C. & Beal, R. K. (2014) The avian enteric immune system in health and disease. Avian Immunology. Book.
Smits, C. H. & Annison, G. Non-starch plant polysaccharides in broiler nutrition–towards a physiologically valid approach to their determination. World's Poultry Science Journal, 52 (2), 203-221.
Tahir, M., Saleh, F., Ohtsuka, A. & Hayashi, K. An effective combination of carbohydrases that enables reduction of dietary protein in broilers: Importance of hemicellulase. Poultry Science, 87 (4), 713-718.
Tavernari, F. C., Carvalho, T. A., Assis, A. P. & Lima, H. J. D. Polissacarídeos não-amiláceo solúvel na dieta de suínos e aves. Revista eletrônica Nutritime, 5 (5), 673-689.
Uni, Z., Zaiger, G., Gal-Garber, O., Pines, M., Rozenboim, I. & Reifen, R. Vitamin A deficiency interferes with proliferation and maturation of cells in the chicken small intestine. British Poultry Science, 41 (4), 410-415.
Uni, Z. (2006). Early development of small intestinal function. Avian Gut Function in Health and Fisease. Book. Vahjen, W., Osswald, T., Schäfer, K. & Simon, O. Comparison of a xylanase and a complex of non starch polysaccharide-degrading enzymes with regard to performance and bacterial metabolism in weaned piglets. Archives of Animal Nutrition, 61 (2), 90-102.
Van Soest, P. J., Robertson, J. B. & Lewis, B. A. Methods for dietary fiber, neutral detergent fiber and nonstarch polysaccharides in relation to animal nutrition. Journal of Dairy Science, v.74 (10), 3583-3597.
Vargas, R. C., Geraldo, A., Rocha, T. C., Silva, I. M., Teles, S. P., Nogueira, F. S. & Gonçalves, R. A. (2017). Multi-enzyme complex in laying hens diet. Revista de Ciências Agroveterinárias, 16 (1), 61-69.
Wagner, D. D. & Thomas, O. P. Influence of diets containing rye or pectin on the intestinal flora of chicks. Poultry Science, 57 (4), 971-975.
Wanders, A. J., Van Den Borne, J. J., De Graaf, C., HulshoF, T., Jonathan, M. C., Kristensen, M. & Feskens, E. J. Effects of dietary fibre on subjective appetite, energy intake and body weight: a systematic review of randomized controlled trials. Obesity Reviews, 12 (9), 724-739.
Wang, Z. R., Qiao, S. Y., Lu, W. Q. & Li, D. F. Effects of enzyme supplementation on performance, nutrient digestibility, gastrointestinal morphology, and volatile fatty acid profiles in the hindgut of broilers fed wheat-based diets. Poultry Science, 84 (6), 875-881.
Warpechowski, M. B. (1996). Dissertação de Mestrado. Efeito da fibra insolúvel da dieta sobre a passagem no trato gastrintestinal de aves intactas, cecectomizadas e fistuladas no íleo terminal.
Westbrook, L. A. & Cherian, G. Egg quality, fatty-acid composition and gastrointestinal morphology of layer hens fed whole flaxseed with enzyme supplementation. British Poultry Science, 60 (2), 146-153.
Williams, R. B. Intercurrent coccidiosis and necrotic enteritis of chickens: rational, integrated disease management by maintenance of gut integrity. Avian Pathology, 34 (3), 159-180.
Wilson, J., Tice, G., Brash, M. L. & Hilaire, S. S. Manifestations of Clostridium perfringens and related bacterial enteritides in broiler chickens. World's Poultry Science Journal, 61 (3), 435-449.
Woyengo, T. A. & Nyachoti, C. M. Supplementation of phytase and carbohydrases to diets for poultry. Canadian Journal of Animal Science, 91 (2), 177-192.
Xu, Z. R., Hu, C. H., Xia, M. S., Zhan, X. A. & Wang, M. Q. Effects of dietary fructooligosaccharide on digestive enzyme activities, intestinal microflora and morphology of male broilers. Poultry Science, 82 (6), 1030-1036.
Yan, F., Dibner, J. J., Knight, C. D. & Vazquez-Anon, M. Effect of carbohydrase and protease on growth performance and gut health of young broilers fed diets containing rye, wheat, and feather meal. Poultry Science, 96 (4), 817-828.
Yason, C. V., Summers, B. A. & Schat, K. A. Pathogenesis of rotavirus infection in various age groups of chickens and turkeys. Pathology. American Journal of Veterinary Research, 48 (6), 927-938.
Zlotowski, P., Driemeier D. & Barcellos, D. E. S. Patogenia das diarréias dos suínos: modelos e exemplos. Acta Scientiae Veterinariae. 36 (1), 81-86.







