Introdução:
A produção de ovos, na maioria das granjas de matrizes de frangos de corte é feita em ninhos, face ao elevado custo de implantação de um sistema de coleta de ovos em ninhos mecânicos disponíveis no mercado. Associa-se a este custo, uma menor aceitação pelas galinhas, com aumento da postura de ovos na cama. Ovos de cama requerem maior mão de obra e geram custos de coleta e limpeza, com menor eclodibilidade e pintos de qualidade inferior. Outro fator a ser considerado é a evolução das linhagens produtoras de pintos de um dia, que selecionadas geneticamente para a maior deposição de musculatura na região do peito, tem apresentado alguma dificuldade para subirem nos ninhos, demandando a uma diminuição da altura dos ninhos.
Assim, na produção de ovos para incubação, se busca práticas para melhorar a qualidade e manejo dos ninhos, e conseqüentemente, a presença de ovos livres de sujidades reduzindo-se a produção de ovos de cama. Tanto o manejo dos ninhos como as coletas diárias, contribuem para a obtenção de ovos limpos e com menor grau de contaminação. Uma das práticas empregadas na obtenção de ninhos de melhor qualidade é o uso de sanitizantes visando à menor contaminação dos ovos (DEMASI, 1991).
No Brasil, os ninhos são preparados com maravalha e cavacos de madeira ou cascas de arroz. O material de cama utilizado deve proporcionar conforto e higiene às aves, evitando-se a presença de contaminantes, microorganismos e materiais estranhos, de tal forma que evite lesões de coxim plantar, celulites e enterites (CONY, 2007).
O objetivo deste estudo foi avaliar a eficiência de uma mistura de óleos essenciais e ácidos não ionizáveis na redução de patógenos em ninhos de aves comparativamente a um controle e um produto comercial existente no mercado.
Revisão da literatura
Aves de reprodução de modo geral recebem monitoramente e controle para garantir a qualidade dos ovos destinados a produção de pintos de 1 dia. A grande maioria dos ovos é estéril internamente com relação à contaminação microbiana. As contaminações em geral decorrem da exposição a sujidades ou fezes no primeiro contato já após a postura (SILVA et al , 1997; SEIBEL, 2005). Entretanto, as condições manejo inadequado e falta de sanitização dos ninhos, pode levar a produção de ovos de baixa qualidade com contaminação elevada na casca e grande contagem inicial de colônias (SOUZA-SOARES & SIEWERDT, 2005; CONY, 2007).
Bactérias e fungos são os principais microrganismos responsáveis pelas alterações físico/químicas observadas no ovo após a postura. Os principais patógenos associados na contaminação do ovo são Salmonella spp,; Staphylococcus, Campylobacter jejuni, Listeria monocytogenes e Yersinia enterocolítica (STRINGHINI, 2008). Dentre os coliformes encontrados em ninhos, a E. coli representa 95% das bactérias sendo a mais conhecida. Ainda, pesquisas referem que ovos podem ser contaminados com diferentes espécies de enterobactérias, tais como Enterobacter spp. (3,3%), Klebsiella spp. (1,6%), Serratia spp. (1,6%), Proteuss pp. (2,2%), Pseudomonas spp. (1,1%), Acinetobacter spp. (0,5%), Alcaligenes spp. (0,5%) e 6,0 % de outras enterobactérias. (SOARES & MESA, 2009; ADESIYUN et al. 2006). Também os fungos, são apontados como microrganismos responsáveis pelas alterações físicas ou químicas observadas no ovo já após a postura (STRINGHINI et al., 2009). As contaminações decorrentes de fungos são principalmente das espécies e gêneros Penecillium, Sporotrichum, Mucor, Cladosporium e Alternaria (CARDOSO, et al., 2001).
Os óleos essenciais constituem-se em complexas misturas de substâncias voláteis, geralmente lipofílicas (SIMÕES & SPITZER, 1999), cujos componentes incluem hidrocarbonetos terpênicos, alcoóis simples, aldeídos, cetonas, fenóis, ésteres, ácidos orgânicos fixos, em diferentes concentrações, nos quais, um composto farmacologicamente ativo é majoritário. A maior ou menor atividade biológica dos óleos essenciais tem se mostrado dependente da composição de seus constituintes químicos como citral, pineno, cineol, cariofileno, furanodieno, limoneno, eugenol, eucaliptol, carvacrol e outros. Estes constituintes são responsáveis pelas propriedades antissépticas, antibacterianas, antifúngicas e antiparasitárias (CRAVEIRO ET AL., 1981; SOUZA ET AL.; 2005). Estudos demonstram que aproximadamente de 60% dos óleos essenciais possuem propriedades antifúngicas e 35% têm atividade antibacteriana (BHAVANANI & BALLOW, 1992).
FUKAIAMA (2005) refere que a maioria dos fenóis age sobre a membrana celular bacteriana, dificultando sua divisão mitótica, causando desidratação nas células e impedindo a sobrevivência de bactérias patogênicas, apresentando grande efeito como agente antimicrobiano. Destes, os mais efetivos, são o carvacrol e timol que atuam em leveduras, fungos e microorganismos Gram (+) e Gram (-), com amplo espectro anti-bacteriano. O Timol tem uma estrutura bastante similar ao carvacrol diferindo apenas no grupo hidroxila com diferente localização no anel fenólico (ULTEE, et al 1999). O carvacrol e o timol agem contra os microorganismos através de uma ação lipofílica na membrana celular dispersando as cadeias de polipeptídeos que irão constituir a matriz da membrana celular (NOSTRO et al, 2004). Atuam provocando mudanças na permeabilidade e atividade da membrana celular das bactérias, alterações na atividade dos canais de cálcio, perturbando o equilíbrio iônico com perda de ions K+. Estes danos ao sistema enzimático dos microrganismos estão relacionados à produção de energia e síntese de componentes estruturais, dificultando a condução e transporte do ATP intracelular. (KNOWLES et al, 2005; NOSTRO et al, 2004).
ROLLER (2003) em amplo estudo com Staphylococcus e Salmonellas, cita que o carvacrol tem mais eficiência nos estágios iniciais de formação da membrana celular, impedindo o crescimento e multiplicação das bactérias. Diminuindo o crescimento bacteriano faz com que as bactérias produtoras de toxinas usem a energia para se manterem viáveis, sobrando pouca ou nenhuma energia para a produção de toxinas, e ocasionalmente quando as toxinas são ativadas não existe ATP suficiente para exportar estas das células bacterianas, desta forma, inibem a produção de toxinas bacterianas (ULTEE 1999). O timol tem maior efeito inibidor sobre microorganismos em pH levemente ácido, sendo efetivo no pH 5.5 e menos efetivo no pH 6.5. Isto porque em pH ácido a molécula de timol não é dissociada, exercendo melhora a sua ação junto às proteínas hidrofóbicas. Neste pH o timol solubiliza melhor os lipídios e proteínas com ação sanitizante.
O uso de misturas de ácidos orgânicos e inorgânicos é comum como ferramenta auxiliar na digestão do filme proteico-lipídico em ninhos, controlando a proliferação bacteriana intestinal (RISLEY et al., 1991; AUMAITRE et al., 1995; GABERT et al., 1999). O uso de acidificantes em aves objetiva a ação antimicrobiana e fúngica, melhorando a eclosão, esses ácidos podem penetrar passivamente na célula microbiana, onde liberam prótons e ânions, o que resulta em redução do pH intracelular, inibindo a ação de enzimas e levando o microrganismo à morte. A ação antimicrobiana, entretanto, pode depender também do acúmulo de ânions no conteúdo intracelular (Russel, 1992).
Material e métodos
O experimento foi realizado utilizando as instalações do laboratório da empresa GRASP®, no período de janeiro a abril de 2011. Foi utilizado como material de ninho a casca de arroz. Os ninhos foram fornecidos por uma granja produtora de pintos de um dia.
Avaliação e identificação da contaminação dos ninhos de casca de arroz.
Foram pesados 5 g dos ninhos coletados aleatoriamente e repassados para placas de Petri estéreis a fim de avaliar a concentração de microrganismos existentes e ou contaminantes dos ninhos. Em cada placa contendo amostra foi acrescido 45 ml de água peptonada estéril, equivalente a diluição 1:10. Após homogeneização, foram realizadas novas diluições: 1:100 e 1:1.000. Alíquotas de 500 µL de cada diluição foram coletadas e semeadas em placas contendo o ágar TSA (Tripticaseína de Soja) e placas contendo o ágar SDA (Sabouraud Dextrose) e depois incubadas por 24 horas a 37oC. Após este período foram realizadas análises de contagem de bactérias aeróbias. Para a análise de fungos, placas foram deixadas em temperatura ambiente por 5 a 7 dias, respectivamente. Para a análise de coliformes totais, alíquotas de 1.000 µL da diluição 1:10 foram coletadas e semeadas em placas contendo o ágar VRBA (Cristal Violeta Vermelho Neutro Bile) e incubadas a 37ºC por 24h. Após as amostras serem incubadas em estufa, foi realizada a contagem de colônias.
Avaliação da eficácia dos produtos frente a um controle.
Foram pesados 5 g de ninho de casca de arroz considerados positivos e distribuído de forma homogênea em placas de Petri estéreis. Os tratamentos foram distribuídos conforme descrito a seguir:
- T1. Controle: ninho sem adição de produto.
- T2.: 1,02g de uma mistura de óleos essenciais e ácidos orgânicos (Vitasan), acrescidos em placas de Petri contendo ninho.
- T3.: 1,02g testemunha (produto comercial) acrescidos em placas de Petri contendo ninho.
Os produtos foram dispersos de forma homogênea nas placas de Petri e acrescidos em cada placa de 45 ml de água peptonada estéril, equivalente a diluição 1:10 , sendo então realizada a diluição de 1:1.000. Alíquotas de 500 µL de cada diluição foram coletadas e semeadas em placas contendo o ágar TSA (Tripticaseína de Soja) e placas contendo o ágar SDA (Sabouraud Dextrose) e incubadas por 24 horas a 37oC para as análises de contagem bactérias aeróbias. Para a análise de fungos, as placas foram deixadas em temperatura ambiente por cinco a sete dias procedendo-se então a contagem. Para a análise de coliformes totais foi utilizado alíquotas de 1.000 µL da diluição 1:10 foi coletada e semeada em placas contendo o ágar VRBA (Cristal Violeta Vermelho Neutro Bile) e após incubadas a 37ºC por 24h.
Após incubação em estufa, realizou-se a contagem das colônias. As demais análises foram realizadas de acordo com o tempo de exposição do produto (24h, 72h, 120h e 168h). Os testes foram realizados seguindo as normas preconizadas pela Resolução Normativa nº. 62, de 26 de agosto de 2003 do Ministério da Agricultura, Pecuária e Abastecimento. Os resultados submetidos à análise de variância e as médias comparadas pelo teste de Tukey à probabilidade de 0,05% pelo programa Statistix 9.
Resultado e discussão
Após a constatação da efetiva contaminação dos ninhos de casca de arroz, aplicaram-se os testes com os diferentes tratamentos. Os resultados dos testes foram realizados pelas médias da diluição 1:1.000. As tabelas e gráficos a seguir demonstram os resultados encontrados para bactérias aeróbias, coliformes totais e colônias de fungos.
c-1) Bactérias Aeróbias
A tabela 1 resume os resultados de contagem de colônias e poder de inibição da mistura de óleos essenciais e ácidos orgânicos sobre as bactérias aeróbias.
Tabela 1: Resultados das análises de contagem de Bactérias Aeróbias.
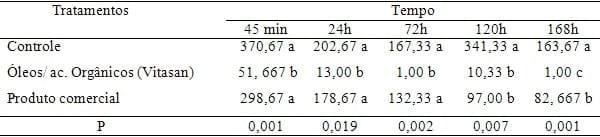
Observa-se que para a contagem de colônias de bactérias aeróbias, após 45 minutos já foram encontradas diferenças significativas (p< 0,05) entre o tratamento controle, produto comercial e mistura de óleos essenciais e ácidos orgânicos. A redução do crescimento bacteriano foi nitidamente superior com o mistura de óleos essenciais e ácidos orgânicos; ainda, constatou se que quanto maior o tempo de contato do produto com o ninho, menor é a formação de UFC, ou seja, menor a contaminação. Isso se deve ao fato dos óleos essenciais voláteis e ácidos orgânicos quando associados apresentarem um grande poder antibacteriano (BONATO et al , 2008) . O tempo para que o produto exerça a sua ação é fundamental para a conservação dos ovos, e à medida que este transcorre aumenta significativamente a contaminação. Segundo BRAUN & FEHLHABER (1995), o tempo de migração de uma bactéria da casca para o conteúdo depende da temperatura de armazenamento e do grau de contaminação, sendo que a 30oC foi de um dia e, a 7oC, somente após 14 dias. WANG & SLAVIK (1998) também verificaram que o intervalo de tempo entre uma contaminação bacteriana experimental na casca e seu isolamento no conteúdo dos ovos foi de, aproximadamente, três dias quando os mesmos foram armazenados a 15oC.
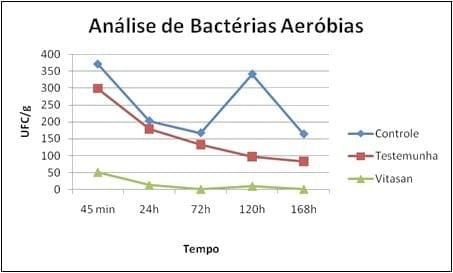
Figura 1 - Comparação dos tratamentos com o controle em relação às análises de bactérias aeróbicas.
c-2) Coliformes totais
Os resultados da contagem de coliformes totais estão demonstrados na tabela e figura 2. Observa-se que em relação ao controle e ao tratamento com o produto testemunha, a mistura de óleos essenciais e ácidos orgânicos (Vitasan) proporcionou uma inibição do crescimento de colônias, superior aos demais.
Tabela 2: Resultados quantitativos das análises de contagem de coliformes totais.
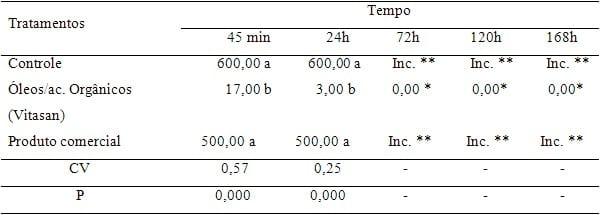 *
* Médias iguais, por isso não houve estatística.
** Colônias incontáveis.
Resultados de inibição de crescimento de enterobactérias com diferentes misturas de óleos essenciais tem sido constatado por pesquisadores. BORSOI, (2009) testou a mistura de ácidos orgânicos e óleos essenciais no controle de excreção fecal de Salmonella Enteritidis (SE), observou que a mistura foi eficaz na redução da excreção fecal (SE), quando os ácidos estão na forma não dissociada (não-ionizados) podem atravessar a membrana semipermeável do microorganismo por difusão passiva e atingir o citoplasma. Em contato com o pH mais alcalino do meio intracelular, o ácido se dissocia iberando íons de hidrogênio e reduzindo o pH interno das bactérias. Esta queda de pH provoca a desnaturação da enzima citoplasmática, interferindo nos sistemas de transporte de energia e desacoplando bombas de ATP (adenosina trifosfato), ocasiando a morte da célula bacteriana. Os óleos essenciais atuam sinergicamente com os ácidos orgânicos, aumentando a permeabilidade da membrana das bactérias para a entrada dos ácidos ( SOUZA et al 2005).
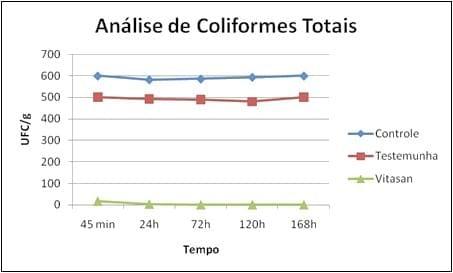
Figura 3: Comparação dos tratamentos com o controle em relação às análises de coliformes totais.
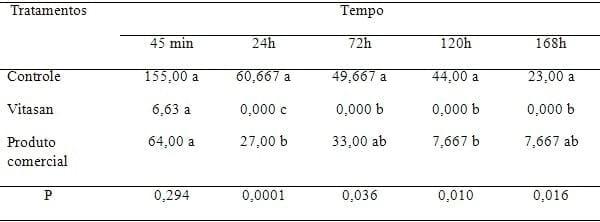
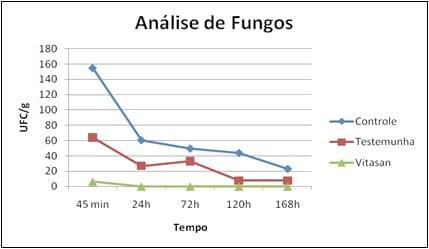
c-3) Colonias de Fungos
A observação dos resultados na tabela e figura 3 demonstra que o tratamento com Vitasan® é mais eficiente em relação ao controle e o tratamento com o produto comercial (testemunha), sendo que a partir de 24 horas não ocorria mais crescimento fúngico. Nota-se que com 24h, a mistura de óleos essenciais e ácidos não ionizáveis (Vitasan) inibiu significativamente o crescimento das colônias de fungos.
Tabela 4: Resultados dos fungos.
CLEFF (2008) cita que associações de princípios ativos de óleos essenciais têm um efeito sinérgico e positivo na inibição do crescimento de diferentes espécies de fungos. LIMA ET AL. (2006) observou a atividade antifúngica dos óleos essenciais frente a espécies de Candida, inibindo em 58% o crescimento das cepas estudadas. SANTOS ET AL. (2010), observaram uma atividade positiva dos óleos essenciais frente a fungos de diferentes espécies, comprovando estatisticamente a inibição do crescimento do halo em diferentes diluições dos óleos.
Figura 2 - Comparação dos tratamentos com o controle em relação às análises de fungos.
A inibição do crescimento fúngico nas condições do teste foi total a partir de 72h de tratamento. Resultados similares foram constatados por BONATO et al (2008) ao utilizando uma associação de uma mistura de ácidos orgânicos e extratos vegetais. Estes pesquisadores constataram também não ocorrer alterações na qualidade dos ovos quando do fornecimento dos produtos de forma isolada ou associada. Em ampla pesquisa SOLIMAN & BADEAA (2002) constaram a inibição do crescimento de várias cepas de fungos aos cinco e sete dias quando usaram diferentes misturas de óleos essenciais.
Conclusões
Nas condições em que foi desenvolvido o experimento, e mediante os resultados obtidos pode-se concluir que:
a) A mistura de óleos essenciais e ácidos orgânicos (Vitasan) foi eficaz na sanitização de ninhos de casca de arroz usados por poedeiras produtoras de ovos para a produção de pintos de 1 dia.
b) Os resultados demonstram efeitos positivos (p<0,05), reduzindo o número de colônias de bactérias aeróbicas, fungos e coliformes.
Referências bibliográficas
ADESIYUN, A.; OFFIAH, N.; SEEPERSADSINGH, N.; RODRIGO, S.;LASHLEY, V.; MUSAI, L. Frequency and antimicrobial resistance of entericbacteria with spoilage potential isolated from table eggs. Food ResearchInternational., v. 39, p. 212–219, 2006.
AUMAITRE, A.; PEINIAU, J.; MADEC, F. Digestive adaptation after weaning and nutritional consequences in the piglet. Pig News and Information, v.16, p.73N-79N, 1995.
BONATO, M.A.; et AL. efeito de acidificantes e extratos vegetais sobre o desempenho e qualidade de ovos de poedeiras comerciais ARS VETERINARIA, Jaboticabal, SP ,v.24, n.3, 186-192, 2008.
BORSOI, ANDERLISE. Inoculação Salmonella Heidelberg e Salmonella Enteritidis em pintos de corte para a avaliação da morfometria cecal, invasibilidade, persitência de excreção fecal e o uso de ácidos orgânicos e óleos essenciais no controle de Salmonella Enteritidis. Tese (Doutor em Ciências Veterinária), Universidade Federal do Rio Grande do Sul, 2009.
BHAVANANI SM, BALLOW CH. New agents for Gram-positive bacteria. Curr Opin Microbiol. 13: 528-534, 1992.
BRAUN, P., FEHLHABER, K. Migration of Salmonella Enteritidis from thealbumen into the egg yolk. International Journal of Food Microbiology, 1 Amsterdam, v. 25, p. 95-99, 1995.
CARDOSO, A. L. S. P; TESSARI, E. N. C; CASTRO, A. G. M;KANASHIRO, M. I; GAMA, N. M. S. Q. Pesquisa de coliformes totais ecoliformes fecais analisados em ovos comerciais no laboratório de patologiaavícola de descalvado. Arquivos do Instituto Biológico. v. 68, n.1, p. 19-22,2001.
CRAVEIRO AA, FERNANDES AG, ANDRADE CHS, MATOS FJA, ALENCAR JW, MACHADO MIL. Óleos essenciais de Plantas do Nordeste. Fortaleza: Editora UFC, 1981.
CONY. Métodos de desinfecção e princípios ativos desinfetantes e a contaminação, mortalidadeembrionária e eclodibilidade de ovos e embriões de aves . Dissertação de mestrado. 88p. Porta Alegre .2007.
CLEFF, M.B. Atividade em vitro do óleo essencial e Origanum vulgare frente à Sporothrix Schenckii. Arq. Bras. Med. Vet. Zootec., v.60, n.2, p.513-516, 2008.
DEMASE,M. Antisepticos , desinfetantes e esterelizantes . In : VALE, L.B.S. et al. Fundamentos da Farmacologia Terapeutica . São Paulo. Ateneu. 1991. P 176- 606.
FUKAYAMA, E. H. Extrato de orégano como aditivo para rações de frango de corte. Revista Brasileira de Zootecnia. v.34, n.6, p.2316-2326, 2005
GABERT, V.M.; SAUER, W.C.; SCHMITZ, M. et al. The effect of formic acid and buffering capacity on the ileal digestibilities of amino acids and bacterial metabolites in the small intestine of wealing pigs fed semipurified fish meal diets. Canadian Journal of Animal Science, v.75, p.615-623. 1995.
JESUS, J. S. Utilização de prebióticos, ácidos orgânicos e óleos essenciais na alimentação de frangos de corte. Dissertação de mestrado. 41p. Cruz das Almas - Ba., 2010.
MAPA (Ministério da Agricultura, Abastecimento e Pecuária). 2003. Diária oficial da União. Instrução Normativa, SDA Nº 62 de 26 de agosto de 2003.
LIMA ET AL. Atividade antifúngica de óleos essenciais sobre espécies de Candida. Rev. Bras. Farmacogn. Vol. 16, Nº 2, p. 197-201, Abr/Jun. 2006.
RISLEY, C.R.; KORNEGAY, E.T.; LINDEMANN, M.D. et al. Effects of organic acids with and without a microbial culture on performance and gastrointestinal tract measurements of weanling pigs. Animal Feed Science and Technology, v.35, p.259-270, 1991
SIMÕES, C.M.O.; SPITZER, V. Óleos voláteis. In: SIMÕES, C.M.O. et AL. Farmacognosia: da planta ao medicamento. Porto Alegre: UFRGS, 1999.
SOUZA EL, LIMA EO, FREIRE KRL, SOUZA CP. Inhibitory action of some essential oils and phytochemicals on the growth of moulds isolated from foods. Braz Arch Biol Technol 48: 245-250, 2005.
SANTURIO, J.M. Atividade antimicrobiana dos óleos essenciais de orégano, tomilho e canela frente à Sorovares e Salmonella enterica de origem avícola. Ciência Rural, Santa Maria, v.37, n.3, p.803-808, mai-jun, 2007.
SANTOS ET AL. Efeito fungicida dos óleos essenciais de Schinus molle L. e Shinus terebinthifolius Raddi, Anacardiaceae, Rio Grande do Sul. Rev. Bras. Farmacogn. Vol. 20, Nº 2. Apr/May 2010.
SOLIMAN, KM; R.I. BADEAA. Effect of oil extracted from some medicinal plants on different mycotoxigenic fungi. Food and Chemical Toxicology 40 1669–1675. 2002.
STRINGHINI, M. L. F. Perfil socioeconômico e microbiológico de manipuladores e qualidade de ovos de granjas de produção comercial. Influência da contaminação experimental por Pseudomonas aeruginosa sobre a qualidade de ovos não-lavados e lavados. 2008. 142 f. Tese (Doutorado em Ciência Animal). Faculdade de Medicina Veterinária, Universidade Federal de Goiás, Goiânia.
WANG, H., SLAVIK, M. F. Bacterial penetration into eggs washed wit various chemicals and stored at different temperatures and times. Journal ofFood Protection, Ames, v. 61, p.276-279, 1998.
SEIBEL, N. Preservação e conservação de ovos. Aves e ovos. p. 91– 110 2005.
SOUZA-SOARES, L. A.; SIEWERDT, F. Aves e ovos. Pelotas: Ed UFPEL, 2005.
138 p.60. SCOTT, T. A.; SILVERSIDES, F. G. The effect of storage and strain of hen on egg quality. Poultry Science, Champaign, v. 79, p. 1725-1729, 2000.61. 62.
SILVA, E. N. Mitos e realidade no controle de Salmonella enteritidis em matrizes. In: CONFERÊNCIA APINCO DE CIÊNCIA E TECNOLOGIA AVÍCOLAS, 1997, Campinas. Anais… Campinas: FACTA, 1997. p.97-108.


 * Médias iguais, por isso não houve estatística.
* Médias iguais, por isso não houve estatística.








.jpg&w=3840&q=75)