Introdução
A qualidade de uma forrageira é geralmente determinada por meio de análises químicas de seus caules e de suas folhas, as quais identificam grupos químicos que podem interferir na digestibilidade do vegetal no animal. Alguns destes grupos são também denominados de metabólitos secundários, sendo possível destacar, dentre estes, os terpenóides, fenóis e compostos nitrogenados e alcaloides (Demirtaş et al., 2018). Neste contexto, a presente revisão tem como objetivo esclarecer aspectos pertinentes dos fatores anti-nutricionais na dieta dos animais.
Fatores anti-nutricionais
Os fatores anti-nutricionais propriamente ditos são substâncias que, mesmo em estado vestigial, reduzem ou impedem totalmente a utilização de um elemento nutritivo, seja no nível digestivo, seja no nível metabólico (Jayasena & Jo, 2013). Estes fatores anti-nutricionais, em sua maioria são metabólitos secundários (Patra & Saxena, 2009, 2010). Estes metabólitos secundários das plantas podem ser definidos como compostos que não têm papel reconhecido na manutenção de processos vitais fundamentais (crescimento, desenvolvimento e reprodução) que os sintetizam, em contrapartida, têm um papel importante na interação da planta com seu meio ambiente. A produção destes compostos é frequentemente baixa (menos de 1% de peso seco) e depende muito do estágio fisiológico e de desenvolvimento da planta (Namdeo, 2007).
Um dos papéis da nutrição animal é a transformação de fontes alimentares de menor valor nutricional em alimentos com melhor valor biológico para o consumo humano e animal. Para isso, é necessário o desenvolvimento dos conhecimentos envolvendo os alimentos e o organismo animal. Muitos alimentos, apesar de apresentarem alto valor nutricional, como sorgo, soja, algodão, mamona e café, quando analisados bromatologicamente ainda possuem baixa biodisponibilidade, ou seja, o valor destes alimentos como forma de precursores para reações metabólicas, digestão e absorção é baixa. Assim, o valor nutricional de uma matéria-prima ou alimento processado e pronto não se limita a sua composição química (Patra & Saxena, 2009, 2010). Fatores anti-nutricionais são elementos produzidos somente por vegetais. Eles servem para que as plantas possam se defender contra predadores, seja por meio da inibição da digestão ou absorção de nutrientes, por causar efeitos adversos, e até mesmo danosos, ao trato gastrointestinal.
Porque as plantas produzem fatores anti-nutricionais
A resistência da planta hospedeira a um patógeno pode ser definida, sob o aspecto fisiológico, como a capacidade da planta em atrasar ou evitar a entrada e/ou a atividade do organismo patógeno em seus tecidos. O sistema de defesa vegetal é multicomponente, atuando de maneira dinâmica e coordenada no momento e local apropriados e com magnitude adequada (Stangarlin et al., 2011). Para entendê-los melhor, é preciso conhecer uma de suas principais funções: a defesa das plantas. Como todos os seres vivos, as plantas vivem para se reproduzir e perpetuar a espécie (Hosni et al., 2013; Labbe et al., 1986; Patra & Saxena, 2010). Entretanto, as plantas são sésseis, ou seja, não são capazes de lutar pela sobrevivência de maneira “ativa”, não podem correr, lutar ou emitir sons. Por isso, as plantas desenvolveram formas alternativas de se protegerem, como por meio da produção dos tais fatores anti-nutricionais (Benchaar et al., 2008; Hess et al., 2003). Essa complexidade funcional, espacial e temporal inicia-se com o reconhecimento, pelo hospedeiro, de sinais exógenos provenientes do patógeno, continua com os mecanismos de transdução desses sinais e resulta em extensa reprogramação do metabolismo celular vegetal, envolvendo mudanças na atividade gênica (Stangarlin et al., 2011). Os mecanismos de defesa de uma planta podem ser estruturais e bioquímicos, ambos pré e/ou pós-formados em relação à tentativa de penetração do patógeno no hospedeiro. Os estruturais constituem-se em barreiras físicas à penetração e/ou colonização do patógeno, enquanto que os mecanismos bioquímicos englobam substâncias capazes de inibir o desenvolvimento do patógeno ou gerar condições adversas para a sobrevivência nos tecidos do hospedeiro, devendo estar presentes em concentração adequada nas partes invadidas e em forma acessível ao patógeno (Stangarlin et al., 2011). Este fatores bioquímicos são os chamados, fatores anti-nutricionais, que nada mais são que ações evolutivas da planta, para frear a herbivoria sofrida (Carneiro & Fernandes, 1996).
Nos mecanismos bioquímicos pré-formados, as substâncias estão presentes na planta em altas concentrações nos tecidos sadios antes do contato com o patógeno ou podem se converter em substâncias altamente tóxicas com o início da infecção ou herbivoria (Carneiro & Fernandes, 1996). Nos mecanismos pós-formados, as substâncias encontram-se ausentes ou presentes em baixos níveis antes da infecção, sendo ativadas em resposta à presença do patógeno ou produzidas a partir de um precursor. Os mecanismos de resistência podem ser: Pré-formados (passivos ou constitutivos): a) estruturais: cutícula, tricomas, estômatos, fibras/vasos condutores; b) bioquímicos: fenóis, alcaloides glicosídicos, lactonas insaturadas, glicosídeos fenólicos e cianogênicos, inibidores proteicos, quitinases e β-1,3 glucanases. Pós-formados (ativos ou induzíveis): a) estruturais: papilas, halos, lignificação, glicoproteínas ricas nos aminoácidos hidroxiprolina (HRGP) e glicina (GRP), camadas de cortiça, camadas de abscisão, tiloses; b) bioquímicos: fitoalexinas, proteínas relacionadas à patogênese e espécies ativas de oxigênio (Stangarlin et al., 2011). Estes fatores bioquímicos ou anti-nutricionais normalmente não são vistos com bons olhos. Apesar de a denominação fatores anti-nutricionais remeter apenas às características “ruins” dessas substâncias, vale lembrar que elas não são responsáveis apenas por gerar efeitos adversos. Pelo contrário, praticamente todas elas, senão todas são capazes de conferir, também, possíveis efeitos benéficos ao organismo animal.
Principais Substâncias Anti-nutricionais
Compostos Fenólicos
Na química orgânica, compostos fenólicos são uma classe de compostos químicos que consistem em um grupo hidroxilo ligado diretamente a um grupo hidrocarboneto aromático. O mais simples é a classe de fenol, que também é chamado ácido carbólico. Os compostos fenólicos são classificados como fenóis simples ou polifenóis, com base no número de unidades de fenol na molécula (Mueller‐Harvey, 2006). Compostos fenólicos são bem conhecidos como substâncias fungitóxicas, antibacterianas e antiviróticas (Shahidi & Ambigaipalan, 2015). O efeito inibitório de compostos fenólicos na germinação de esporos, crescimento micelial e produção/atividade de enzimas microbianas variam entre os diferentes grupos de fenóis. Dessa forma, os compostos fenólicos estão envolvidos nos mecanismos bioquímicos e estruturais de resistência em plantas (Stangarlin et al., 2011). As substâncias fenólicas são de ocorrência muito generaliza nos tecidos de origem vegetal e assumem importância na alimentação. Os ácidos fenólicos, cumarinas e flavonoides, pertencem a uma classe de metabólitos secundários, largamente distribuídos em plantas (Pansera et al., 2003; Santos et al., 2011b; Silva & Silva, 1999). Apesar de generalizado por muito tempo, que os compostos fenólicos são tóxicos ou reduzem o desempenho de animais de produção (Makkar, 2003; Mueller‐Harvey, 2006), atualmente reconhece-se que a depender de sua concentração e natureza (Goel & Makkar, 2012) estes compostos fenólicos podem ter efeitos, favoráveis e adversos (Aerts et al., 1999). O que irá definir seu possível efeito prejudicial, inócuo ou benéfico serão o tipo e estrutura química, a espécie vegetal advinda, a quantidade ingerida, espécie e particularidade de cada animal (Makkar, 2003; Mueller‐Harvey, 2006). Compostos fenólicos em alimentos geralmente pertencem a ácidos fenólicos, flavonoides, lignanas, estilbenos, cumarinas e taninos (Shahidi, 2000; Shahidi & Ambigaipalan, 2015). A seguir serão discutidos alguns compostos fenólicos de maior representatividade na alimentação animal, como; taninos, ligninas e gossipol.
Ligninas
A palavra lignina vem do latim “lignum”, que significa madeira. Trata-se de um dos principais componentes dos tecidos de gimnospermas e angiospermas, ocorrendo em vegetais e tecidos vasculares. A lignina tem um importante papel no transporte de água, nutrientes e metabólitos, sendo responsável pela resistência mecânica de vegetais, além de proteger os tecidos contra o ataque de microrganismos (Saliba et al., 2001). A lignina é formada por precursores fenólicos, que, ao se ligar quimicamente com os carboidratos da parede celular, constituem-se no principal obstáculo à digestão da fibra. Mesmo que algumas análises químicas indiquem boa digestibilidade da forragem, principalmente considerando apenas o teor de lignina, ela pode não ter boa aceitação pelo animal, por apresentar estruturas e barreiras físicas que prejudicam sua degradação (Cannas et al., 2003; Maeda et al., 2012). As ligninas são o terceiro constituinte mais abundante nas plantas, após celulose, e hemicelulose. De todos os estudos realizados sobre lignina, muitos pontos relativos principalmente à sua estrutura, permanecem em dúvida. Isto decorre da grande diversidade da estrutura das ligninas quando se passa de uma espécie vegetal para outra ou, até mesmo, dentro da mesma espécie, quando são analisadas partes diferentes do vegetal, ou as diferentes condições de solo e de clima (Fahey & Jung, 1983; Saliba et al., 2001).
Citoplasmas em degeneração ou células danificadas pela tentativa de penetração de determinado patógeno ou herbívoro, especialmente fungos, levam a aumento da biossíntese de lignina, no intuito de reforçar as paredes celulares ou mesmo a formação de lignina ao redor das estruturas do patógeno, como hifas, isolando-o do citoplasma e paralisando seu avanço. A lignificação de uma célula torna as paredes mais resistentes à penetração e exige do invasor a expressão de enzimas específicas que degradam lignina para continuar o avanço da colonização (Stangarlin et al., 2011). Assim, a lignina tem dupla função contra herbivoría, pois age quimicamente como bloqueio enzimático e fisicamente, proporcionando rigidez à parede celular (Cannas et al., 2003; Maeda et al., 2012). A lignina é o fator isolado mais limitante da digestibilidade de uma forragem. A indegradabilidade da fração fibrosa da forragem expressa como o resíduo em fibra detergente neutro, chega a ser estimada pela relação de menos 2,4 unidades percentuais de degradabilidade para cada unidade de lignina determinada pelo método de digestão com ácido sulfúrico (Cannas et al., 2003; Maeda et al., 2012)
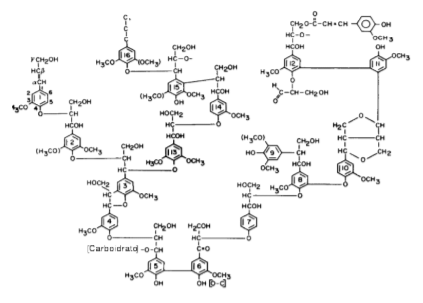
Quimicamente a lignina é um polímero derivado de unidades fenilpropanóides denominadas C6C3 ou, simplesmente, unidades C9, repetidas de forma irregular, que têm sua origem na polimerização desidrogenativa do álcool coniferílico (Figura 1) (Saliba et al., 2001) (coniferil, comaril ou no álcool sinapil), que são sintetizados via fenilalanina (Cannas et al., 2003; Maeda et al., 2012).
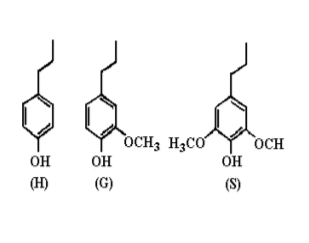
Buxton et al. (1996) definiu a lignina em core e não core, com base em sua susceptibilidade relativa à hidrólise. A “lignina não core” consiste em compostos fenólicos de baixo peso molecular, liberados da parede celular por hidrólise suave, que é representada por ácidos phidroxicinâmico éster-ligados. Já a “lignina core” é constituída de polímeros fenilpropanóides da parede celular, altamente condensados e muito resistentes à degradação. Eles são compostos de unidades p-hidroxifenila (H), guaiacila (G) e siringila (S) (Figura 2), em proporções diferentes, de acordo com sua origem.
A quantidade relativa da fração molar de aldeídos produzidos pela reação de oxidação com nitrobenzeno é um indicador da abundância relativa das unidades C9 (H, G e S) (Buxton et al., 1996). Deste modo, numa classificação inicial de ligninas segundo a presença dessas unidades, tem-se que: ligninas angiospermas (de madeiras duras) são formadas principalmente de unidades G e S; ligninas de gimnospermas (madeiras moles) são formadas fundamentalmente de unidades G, já ligninas de gramíneas compreendem G-S-H. Porém, existem ligninas de certas espécies de gimnospermas e de gramíneas que apresentam abundância de G e S (Buxton et al., 1996). Em plantas herbáceas, a lignina não pode ser definida apenas como proveniente de derivados ácidos fenólicos. Deve-se trabalhar com as definições core e não core para descrever o material residual e os componentes ácidos hidrocinâmicos liberados durante a hidrólise, respectivamente. Assim, essas definições, são convenientes para investigações dentro do aspecto nutricional das forragens, bem como para comparar a composição das plantas, pois esta terminologia discute aspectos moleculares da estrutura da lignina (Buxton et al., 1996). Onde, somente derivados do ácido hidrocinâmico, que estão covalentemente ligados aos polímeros da parede celular, são liberados durante a hidrólise, constituindo a lignina não core. E consequentemente, derivados de ácidos hidrocinâmicos que compõem a lignina através de ligações inter-resistentes a hidrólise, constituem as ligninas core (Alonso-Díaz et al., 2012; Saliba et al., 2001).
Figura 1. estrutura esquemática da lignina. Fonte: Kirk & Farrell (1987)
Figura 2. Liginina frações core e não core. Fonte: Buxton et al. (1996).
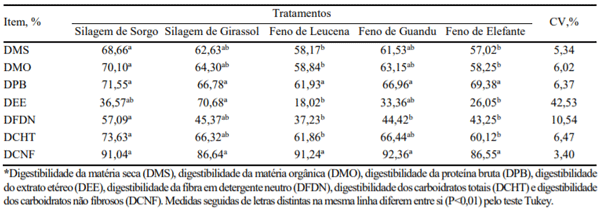
Lima Júnior et al. (2010) avaliando o efeito das silagens de sorgo e girassol e os fenos de leucena, feijão guandu e capim-elefante em associação com a palma forrageira sobre o consumo e digestibilidade aparente dos nutrientes, amônia e pH ruminais e ovinos, encontraram diferença na digestibilidade da matéria seca para a dieta com silagem de sorgo foi superior quando comparada às com fenos de leucena e capim elefante, porém semelhante à silagem de girassol e ao feno de guandu. Essa diferença pode ser justificada, em parte, pelos maiores níveis de lignina e fibra em detergente ácido, componentes tipicamente mais relacionados com a digestibilidade, presentes nos fenos.
A lignina é um constituinte da célula vegetal de baixa ou digestibilidade nula e apresenta influência sobre a digestibilidade da MS, da fibra bruta, da celulose e hemicelulose. Considerada como o principal fator limitante da digestibilidade em forragens (Launchbaugh et al., 2001).
Tabela 1. Coeficiente de digestibilidade aparente dos nutrientes em função dos tratamentos
Taninos
A palavra tanino vem do termo “tanning” em inglês que significa curtimento e refere-se a fontes de taninos utilizados no curtimento de peles de animais em couro, entretanto, o termo é largamente aplicado a qualquer composto fenólico contendo hidoxils suficientes e outro grupo adequado para formar complexos fortes com proteínas e outras macromoléculas (Bele et al., 2010). Os taninos são o quarto constituinte mais abundante nas plantas, após celulose, hemicelulose e lignina. Como metabólitos secundários, os taninos são compostos fenólicos de grande interesse econômico e ecológico. Estando presente na maioria das plantas (Monteiro et al., 2005; Shahidi, 2000). Taninos acumulam-se em níveis relativamente altos nas plantas e possuem uma série de funções suplementares no ciclo de vida da planta, em geral estão envolvidos em estratégia de defesa dos vegetais contra herbívoros e patógenos (Aerts et al., 1999) incluindo, tecidos de proteção, envolvimento em estratégias de defesa como atração para polinizadores e animais dispersadores de sementes e proteção contra raios ultravioleta, protegendo os cloroplastos da foto degradação (Duarte-Almeida et al., 2011; Singh et al., 2013) antes da maturação da semente.
Os taninos que ocorrem comumente são tradicionalmente divididos em duas categorias: hidrolisável e taninos condensados, cujas estruturas são distintas (Naumann et al., 2017). Os taninos hidrolisáveis por hidrólise ácida liberam ácidos fenólicos: gálico, caféico, elágico e um açúcar. O ácido tânico é um típico tanino hidrolisável, o qual é quebrado por enzimas ou de forma espontânea (Silva & Silva, 1999). Os taninos condensados são polímeros dos flavonoides, presentes em maior quantidade nos alimentos, normalmente, constituindo o lenho dos vegetais. Em geral, a produção de altos níveis de fenóis na planta está relacionada com o processo de cicatrização. Próximo a “injúria”, os fenóis são oxidados pela polifenoloxidase, quinonas e complexos polímeros fitomelanina marrom, que são frequentemente mais tóxicos aos invasores do que os fenóis (Silva & Silva, 1999). Os taninos condensados estão presentes na fração fibra alimentar de diferentes alimentos e podem ser considerados indigeríveis ou parcialmente digeríveis. Em leguminosas e cereais os taninos têm recebido considerável atenção, por causa de seus efeitos adversos na cor, sabor e qualidade nutricional (Silva & Silva, 1999). Pode ser encontrado em folhas e cascas o tanino pode ser empregado medicinalmente como composto antidiarreico, homeostático e antibacteriano na medicina popular humana (Bele et al., 2010).
Os taninos têm sido caracterizados predominantemente com base na sua capacidade de se ligarem às proteínas, relatos que datam de 1930 descrevem taninos com base no “seu sabor adstringente” e pelas suas muitas reações de precipitação com cal, chumbo, acetato, alcaloides, gelatina, albumina e outras proteínas, e também por suas reações de cor com sais de ferro (Naumann et al., 2017). Por sua capacidade de se combinar com proteínas da pele animal inibe o processo de putrefação, mais conhecido como processo de curtimento do couro, processo que caracteriza os taninos. Também são considerados potentes inibidores de enzimas devido a sua complexação com proteínas enzimáticas (Silva & Silva, 1999). A capacidade dos taninos de formar complexos com proteínas é ao mesmo tempo, benéfica e maléfica. Onde, pela grande tendência dos taninos para formar complexos com proteínas ao invés de carboidratos e outros polímeros, pode explicar a baixa digestibilidade das proteínas de leguminosa, inibição do crescimento e aumento da excreção de nitrogênio fecal em animais (Silva & Silva, 1999). Ao passo que o principal benefício vem de seu efeito sobre a digestão de proteínas. Alguns taninos podem reduzir a quantidade de proteína que é digerida no rúmen e aumentar a quantidade de proteína disponível para a digestão no intestino delgado, esta mudança no local de digestão de proteínas tem sido referida como 'proteína de escape ruminal’ ou ‘proteína by pass’ (Mueller‐Harvey, 2006). Min et al. (2005) em revisão revela que o efeito do tanino condensado sobre o valor nutritivo de forragens temperadas e na saúde dos ruminantes em sistema de pastejo, em concentrações moderadas podem promover o aumento da eficiência da digestão da proteína microbiana e consequentemente das condições sanitárias do rebanho. Taninos podem produzir inúmeros benefícios aos ruminantes, como: melhor utilização da proteína dietética, maiores taxas de crescimento (peso vivo, lã, produção de leite), aumento da fertilidade e melhoria do bem-estar animal e da saúde, através da prevenção do timpanismo e redução da carga parasitária (Mueller‐Harvey, 2006).
Além disso, a utilização de leguminosas taniníferas influenciam positivamente a qualidade da carne. Em diferentes forrageiras, o tanino condensado, inibe a proliferação de microrganismos ruminais em ovinos, particularmente Butyvibrio fibrisolvens, que entre outras coisas é responsável pela biohidrogenação dos ácidos graxos, podendo afetar a composição dos mesmos (Monteiro et al., 2005). O tanino hidrolisável presente no ácido tânico é composto principalmente por ácido gálico. A toxicidade que o ácido gálico exerce sobre os mamíferos foram sistematicamente estudados por Shi et al. (2013) que em revisão relataram que para ingestão oral aguda, não ocorreram efeitos adversos evidentes a 5g/kg/pv ácido gálico para camundongos albinos suíços e 1g/kg/pv para ratos sem raça definida, respectivamente. Shi et al. (2013) relatam ainda que tais efeitos foram dinâmicos e dose dependentes, onde, os efeitos do ácido gálico foram maiores no fígado do que em outros órgãos e não completamente recuperáveis dentro de 144 h. Deste modo, é concebível que a ingestão de ácido gálico possa afetar o metabolismo endógeno dos mamíferos, mesmo quando a dosagem está abaixo da que causa efeitos adversos evidentes.
Gossipol
O gossipol é um pigmento fenólico de coloração amarelada, produzido pelas glândulas de pigmentos encontradas nas raízes, partes aéreas e sementes de algodão. Seu nome surgiu da associação entre o nome científico do gênero do algodão (Gossypium) com a terminação “ol” oriunda de fenol. Há pelo menos outros quinze compostos fenólicos produzidos pelas glândulas de pigmento do algodão, mas estes compostos são de pouca importância toxicológica, pois estão presentes em concentrações muito menores do que a encontrada pelo gossipol (Gadelha et al., 2011). Segundo Prado et al. (1995) e Prado et al. (1995) o gossipol pode estar presente nas sementes sob duas formas, livre e a conjugada. A livre é considerada a mais tóxica, por esta ser a forma biologicamente ativa. A variação na proporção entre estas duas formas nos diferentes cultivares é determinada geneticamente (Gadelha et al., 2011). O gossipol conjugado não apresenta importância toxicológica, sendo considerado fisiologicamente inativo. O gossipol livre (não conjugado) é o que apresenta importância toxicológica. O grupamento formil do gossipol se liga aos grupamentos amino epsilon da lisina e da arginina, reação esta conhecida como reação de Maillard ou browing. Também pode haver ligação com o grupamento tiol da cisteína (Gadelha et al., 2011). A forma conjugada é obtida durante a produção do farelo, onde devido às condições de aquecimento, uma porção do gossipol livre liga-se a proteínas e ao grupo amino livre de aminoácidos essenciais como a lisina, desenvolvendo um complexo indigestível chamado lisina-gossipol, causando uma diminuição da digestibilidade da proteína. Quando o gossipol livre se liga ao ferro, formando o complexo ferro-gossipol, também é considerado prejudicial ao organismo animal, acarretando problemas hepáticos, na taxa de respiração e na capacidade de transporte do oxigênio pelos eritrócitos, permitindo o surgimento de anemias e ataque cardíaco (Araújo et al., 2003).
O Gossipol livre é um composto tóxico e sua utilização pode trazer sérios problemas aos animais como perda de apetite, edemas pulmonares e fígado hipertrofiado, necrose muscular cardíaca e problemas reprodutivos. O aumento na fragilidade dos eritrócitos tem sido relacionado ao consumo de gossipol. Em alguns casos o acúmulo de gossipol no organismo pode levar o animal à morte (Lima Júnior et al., 2010). A intensidade de seu efeito tóxico varia de acordo com o nível de consumo, o período de consumo, a idade do animal e das condições de estresse desse animal. Todavia, aspectos patológicos derivados da administração de alimentos com gossipol são raros. Isto pode derivar da capacidade de ligação do gossipol com as proteínas solúveis do rúmen (Lima Júnior et al., 2010).
A fórmula química geral do gossipol é C30H30O8, com peso molecular de 518,6 daltons e fórmula química estrutural 8,8’-dicarboxaldeído- 1,1’,6,6’,7,7’-hexahidroxi-5, 5’-diisopropil-3,3, - dimetil-2,2’-binaftaleno. Há duas formas isoméricas nas quais o gossipol pode ser encontrado, (+)- e (-)-gossipol. O isômero (-)-gossipol é considerado o mais tóxico (Gadelha et al., 2011). Foi constatado que há variação na proporção entre estas duas formas nos diferentes cultivares, sendo esta variação determinada geneticamente. A função do gossipol para a planta que o produz é limitar a predação por insetos, incrementando a sobrevivência do vegetal (Gadelha et al., 2011)
O algodoeiro (Gossypium spp) é cultivado para produção de fibra e óleo (Araújo et al., 2003). Como subproduto do algodão, o farelo representa mundialmente a segunda mais importante fonte ou suplemento proteico disponível para a alimentação animal, ultrapassada apenas pela soja. Este farelo é o resíduo da obtenção do óleo, que pode ser feita tanto pelo esmagamento mecânico do caroço como pelo uso de solventes. Ele fornece inúmeros subprodutos, torta e farelo, ricos em proteína de boa qualidade e bastante utilizados no preparo de rações (Gadelha et al., 2011). Os farelos, como fonte proteica, apresentam teores de proteína bruta (PB) de 34,3 a 48,9% e, como fonte de energia, teores de energia digestível (ED) de 3,22 a 3,44 Mcal/kg. O caroço de algodão, além de teores de PB de 22 a 25% e de fibras em detergente neutro (FDN) entre 37 e 44%, possui de 4,12 a 5,30 Mcal/kg de ED. Uma das fontes de gordura mais utilizadas em propriedades especializadas em produção leiteira é o caroço de algodão, que contém 2,22 Mcal/kg de ELL (Energia líquida de lactação), 23% de proteína bruta, 44% de FDN e 34% de FDA (NRC, 2000; Valadares Filho, 2006). São também importantes fontes de fibra, com teores de fibra bruta (FB) de 17,2 a 28% (NRC, 2000; Valadares Filho, 2006).
Gadelha et al. (2011) afirmam que o gossipol é tóxico para espécies não ruminantes e ruminantes, quando alimentados em concentrações elevadas. A intoxicação natural por este pigmento tipicamente ocorre por meio da ingestão prolongada, uma vez que os níveis desta substância no algodão não são suficientemente altos para poder promover intoxicação aguda. Os efeitos do gossipol são cumulativos, e podem surgir abruptamente após um período variável de ingestão. Os efeitos tóxicos do gossipol são muito maiores para não ruminantes, como suínos e aves, que são bastante suscetíveis à toxicidade de gossipol, assim como os pré-ruminantes, podendo reduzir a capacidade carreadora de oxigênio no sangue, resultando em respirações curtas e edemas pulmonares. O conteúdo de gossipol livre nas sementes íntegras de algodão é de cerca de 0,5%. Estes níveis variam de 0,1 a 0,5% quando é feita a extração do óleo por solventes. Já nos processos mecânicos de extração envolvendo pressão e tratamento térmico, esta redução é para cerca de 0,05%. Ainda, a extração por solventes pode produzir farelos com menor concentração de gossipol livre (0,05%) quando se realiza extrusão ou expansão antes da extração. Portanto, os sinais de intoxicação aguda pelo gossipol em não ruminantes, pré-ruminantes e ruminantes machos são semelhantes e incluem dificuldade respiração, dispneia, diminuição da taxa de crescimento, anorexia, fraqueza, apatia e morte depois de vários dias. Além disto, a ocorrência de morte súbita promovida pelo gossipol foi relatada em bezerros. Achados post-mortem incluem derrames pleural e abdominal, necrose centrolobular do fígado, edema generalizado, congestão dos pulmões e do fígado e degeneração das fibras cardíacas (Gadelha et al., 2011)
Os ruminantes adultos apresentam menor sensibilidade ao gossipol por haver ligação desta substância a proteínas do fluido ruminal. A ingestão de gossipol em quantidades superiores à capacidade de detoxificação ruminal permite a absorção de gossipol livre. Vacas intoxicadas apresentam taquipnéia e anemia caracterizada por redução na concentração de hemoglobina, aumento na concentração de proteínas plasmáticas totais e na fragilidade eritrocitária; ocasionalmente ocorrem mortes (Gadelha et al., 2011)
Saponinas
As saponinas são compostos glicosilados amplamente distribuídos nas plantas e que podem ser divididos em três grupos, dependendo da estrutura da aglicona: triterpenóides, esteróides e glicoalcalóides (Stangarlin et al., 2011). Saponinas são substâncias derivadas do metabolismo secundário das plantas, relacionados, principalmente, com o sistema de defesa. São encontradas nos tecidos que são mais vulneráveis ao ataque fúngico, bacteriano ou predatório dos insetos, considerando-se parte do sistema da defesa das plantas e indicadas como “fitoprotetoras” (Monteiro et al., 2005; Patra & Saxena, 2010; Silva & Silva, 1999).
A palavra “saponina” é derivada do latim ‘sapo’, que significa sabão, e tradicionalmente plantas que continham saponinas eram usadas para limpeza. As saponinas são produzidas principalmente em plantas como: alfafa, soja, leucena, trevo, quilaia e yucca e também em menores quantidades em animais marinhos como; pepino do mar e estrela do mar (Das et al., 2012). Sua estrutura tem caráter anfifílico, ou seja, uma parte possui característica lipofílica (triterpeno ou esteróide) e outra hidrofílica (açúcares) (Das et al., 2012; Goel & Makkar, 2012). Com uma variedade de agentes hipocolesterolêmicos, a saponina chamou a atenção por suas atividades de redução do colesterol durante as últimas décadas. Saponinas que são amplamente distribuídas na natureza, formam um grupo heterogêneo de glicósidos triterpenoides e esteróides. Tem atividades anti-carinogênicas, anti-inflamatórias e antioxidantes. Por suas propriedades surfactantes podem reduzir a tensão superficial em torno das membranas celulares e podem ajudar a absorção de nutrientes (Afrose et al., 2011). São usadas na indústria na preparação de emulsões para filmes fotográficos e na indústria de cosméticos em batons e xampus. São usadas na indústria alimentícia como flavorizante e agente espumante (Monteiro et al., 2005; Patra & Saxena, 2010; Silva & Silva, 1999).
Os extratos vegetais mais utilizados comercialmente são extraídos da Yucca schidigera (Eryavuz & Dehority, 2004; Wang et al., 1998) ou da Quillaja saponária (Nasri et al., 2012; Patra & Yu, 2014). As saponinas da Quillaja saponaria são amplamente utilizadas como adjuvantes em vacinas orais e injetáveis melhorando a eficácia das vacinas orais e facilitando a absorção intestinal de grandes moléculas. Isto ocorre, provavelmente, pela interação com o colesterol das membranas dos microvilos que causam lesões estruturais e consequente alteração da permeabilidade. A Yucca schidigera e a Quillaja saponaria são as maiores fontes de saponinas utilizadas como aditivos em rações. Os principaisobjetivos são a melhoria do desempenho e a redução da produção de amônia e o odor de fezes de animais domésticos. Seu mecanismo de ação ainda não é completamente conhecido, mas sabe-se que as saponinas alteram a microbiota intestinal, atuam no metabolismo do nitrogênio, aumentam a permeabilidade de células da mucosa intestinal e a taxa de absorção intestinal (Monteiro et al., 2005; Patra & Saxena, 2010; Silva & Silva, 1999). Gee et al. (1997) afirmaram que as saponinas alteram a absorção intestinal, o que pode trazer consequências negativas, uma vez que substâncias presentes nas dietas que normalmente não seriam absorvidas podem aumentar o risco de sensibilização por antígenos da dieta. Saponinas também são referidas como causadoras de despolarização da membrana intestinal, o que também, altera o padrão de permeabilidade. Pela sua propriedade surfactante, possuem atividade antiprotozoária, pois formam complexos com o colesterol das membranas celulares dos protozoários, causando a lise celular (Monteiro et al., 2005; Patra & Saxena, 2010; Silva & Silva, 1999). O uso de saponinas na dieta nos últimos dez dias de gestação e na lactação de porcas, resultou em melhor escore corporal no final da lactação às fêmeas, e leitegadas mais pesadas ao nascer e ao desmame. As fezes das fêmeas que receberam as saponinas foram 11% mais duras em relação ao grupo não tratado (Monteiro et al., 2005; Patra & Saxena, 2010; Silva & Silva, 1999). Santos et al. (2011a) testaram a inclusão de Yucca schidigera e não foram observados efeitos adversos na saúde e na digestibilidade ou aceitação degatos em relação à dieta, sendo indicado seu uso.
Os extratos de Yucca e Quillaja estão sendo pesquisados para cães, gatos, suínos, aves, ruminantes e equinos. Os principais benefícios estudados são adiminuição do odor das excretas, redução da prevalência de artrite e melhoria no desempenho dos animais. Outra ação das saponinas é a inibição do crescimento in vitro de Escherichia coli (Arabski et al., 2012). No caso específico de suínos, as saponinas reduzem a mortalidade pré e pós-natal, melhoram as respostas imunológicas dos leitões quando fornecidas na dieta de porcas gestantes e lactantes (Hauptli & Lovatto, 2006). Hauptli & Lovatto (2006) avaliaram o desempenho de porcas e suas leitegadas alimentadas com dietas que continham saponinas. Onde utilizaram, 30 porcas geneticamente homogêneas distribuídas em 2 tratamentos (dieta testemunha e dieta testemunha com adição de 160 ppm de fontes de saponinas). As porcas alimentadas nos últimos 10 dias de gestação e na lactação com dietas contendo 160ppm de extratos em pó como fontes de saponinas têm melhor escore corporal ao final da lactação e suas leitegadas são mais pesadas ao nascer e ao desmame.
Em seu trabalho com frangos de corte, Su et al. (2016) avaliaram os efeitos do extrato de yucca na eficiência alimentar, função imune e antioxidativa. Foram formuladas dietas adicionando 0, 100, 200 e 300 mg/kg de extrato de yucca à dieta basal e observou-se que as dietas suplementadas com 100 e 200 mg/kg de extrato de yucca aumentaram os níveis médios de ganho de peso corporal, eficiência alimentar, IgG, IgM, T-AOC, CAT e SOD e têm efeitos positivos na indução da maturação dos órgãos imunológicos. Entretanto, o tratamento com 100 mg melhorou principalmente a eficiência alimentar, enquanto o tratamento com 200 mg atuou principalmente sobre imunidade e anti-oxidação. Alagawany et al. (2016), em seu trabalho com galinhas poedeiras, avaliaram o efeito do extrato de Yucca schidigera sobre o desempenho produtivo, qualidade do ovo, metabolitos sanguíneos, função imune e parâmetros antioxidantes, e observou que a suplementação até 100 mg / kg de extrato de Yucca pode ser utilizada como aditivo alimentar efetivo para melhorar o desempenho produtivo, perfil sanguíneo e atividades enzimáticas antioxidantes nas galinhas poedeiras. Canul-Solis et al. (2014) avaliando a suplementação com Yucca schidigera em dietas a base de Pennisetum purpureum sobre ingestão voluntária, fermentação ruminal e produção de metano (CH4) em ovinos, notaram que a suplementação de até 6 g por dia de saponinas da Yucca schidigera para ovinos alimentados com pastagem de Pennisetumpurpureum não tem efeito sobre a produção de metano ruminal devido à ausência de efeito na ingestãoe digestibilidade dos nutrientes na dieta, e os padrões de fermentação no rúmen. Os efeitos adversos das saponinas são diminuição do crescimento, consumo e produção de ovos, redução da motilidade intestinal e da digestibilidade da proteína, sabor adstringente e irritante.
Hauptli & Lovatto (2006) avaliaram o desempenho de porcas e suas leitegadas alimentadas com dietas que continham saponinas. Onde utilizaram, 30 porcas geneticamente homogêneas distribuídas em 2 tratamentos, dieta testemunha e dieta testemunha com adição de 160 ppm de fontes de saponinas, em blocos ao acaso. As porcas alimentadas nos últimos 10 dias de gestação e na lactação com dietas contendo 160ppm de extratos em pó como fontes de saponinas têm melhor escore corporal no final da lactação e suas leitegadas são mais pesadas ao nascer e ao desmame.
Mimosinas
A mimosina é um aminoácido tóxico para animais ruminantes e monogástricos, esse aminoácido é degradado via bactérias ruminais e do ceco do coelho a 3,4 dihidroxipiridona (Dominguez-Bello & Stewart, 1990; Scapinello et al., 2003) A leucena (Leucaena leucocephala) é uma leguminosa arbórea/arbustiva utilizada como alternativa às leguminosas herbáceas (Ramos et al., 1997; Salviano, 1983). É uma planta altamente nutritiva, palatável e de boa digestibilidade e que apresenta menor variação no valor nutritivo ao longo do ciclo produtivo em relação às gramíneas e compara-se, quimicamente, em termos de proteína e de minerais à alfafa (Valadares Filho, 2006). Entretanto, o uso da leucena em dietas animais apresenta limitações devido à presença da mimosina (Gupta & Atreja, 1998; Rincón et al., 1998; Scapinello et al., 2003). Mas sua utilização como forrageira tem sido limitada por seu teor em mimosina, a qual possui efeitos tóxicos caracterizados por alopecia e menos frequentemente, catarata, atrofia de gengiva, ulcerações da língua e esôfago, bócio, infertilidade e menores ganho de peso para ruminantes e não ruminantes (Almeida et al., 2006). Almeida et al. (2006) avaliar o efeito tóxico da planta Leucaena leucocephala para ovinos. A planta foi administrada a duas ovelhas adultas e seis cordeiros divididos em sete tratamentos. Os autores observaram que os cordeiros de 4-5 meses se mostraram sensíveis à toxicidade de L. leucocephala, apresentando acentuada queda de lã por volta de seis dias após o início do consumo da planta; porém, ganharam peso no decorrer do experimento. As ovelhas adultas não apresentaram sinais clínicos da intoxicação e também ganharam peso no decorrer do experimento. A idade dos ovinos neste experimento sugere certa resistência dos adultos e susceptibilidade dos jovens à intoxicação por L. leucocephala. A adição de 1% de ração na dieta não interferiu nos efeitos tóxicos da planta em cordeiros de 4-5 meses.
Fitato
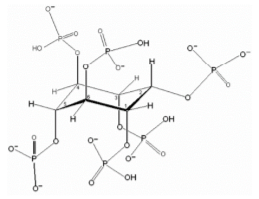
O fitato, não está diretamente ligado à defesa da planta, sendo um componente dos vegetais com a função de armazenamento de nutrientes. Em todo o caso, percebe-se novamente que é um elemento natural à fisiologia desses seres (Stech et al., 2010). Os fitatos são derivados do ácido fítico ou ácido hexafosfórico mioinositol, com habilidade de formar quelantes com íons divalentes, tais como o cálcio e o magnésio, formando complexos solúveis resistentes à ação do trato intestinal, que diminuem a disponibilidade desses minerais (Kumar et al., 2012; Snow et al., 2004). Embora esse seja seu maior efeito, os fitatos também interagem com resíduos básicos das proteínas, participando da inibição de enzimas digestivas como a pepsina, pancreatina e a α-amilase (Silva & Silva, 1999). O fitato é a principal forma de armazenamento de fósforo nas sementes dos vegetais, representando até 80% do conteúdo total desse mineral (Figura 3). A estrutura dessa molécula é adaptada a se ligar a minerais como cálcio, magnésio, ferro, zinco etc. No interior das sementes das plantas, funciona como forma de armazenamento de tais nutrientes, além do fósforo previamente mencionado. Quando se encontra ligada a minerais ou outras substâncias, a molécula recebe o nome de fitato; em sua forma “livre”, entretanto, é denominada de ácido fítico (Stech et al., 2010). Como pode ser visto na figura 3, o fitato é uma molécula com carga negativa, devido aos inúmeros grupamentos fosfato que ela possui.
Aqui está um resumo do conteúdo de fitato nos alimentos, considerando aqueles mais consumidos nas populações ocidentais. O conteúdo de fitato nas oleaginosas (nozes e castanhas) é, de maneira geral, superior ao encontrado nos cereais e leguminosas. Entretanto, o seu consumo total é consideravelmente inferior na população em geral, principalmente porque as oleaginosas são alimentos mais caros e normalmente consumidos em pequenas quantidades. Outra menção importante é o conteúdo de fitato na soja concentrada como nos “sucos” ou “leites” de soja, além da proteína isolada de soja ou proteína texturizada de soja; hoje em dia, cada vez mais pessoas fazem o consumo de produtos ricos em soja concentrada (Stech et al., 2010). Assim, como é capaz de se ligar aos minerais no interior das células vegetais (para o armazenamento desses nutrientes), o fitato também pode se ligar aos minerais ingeridos através da dieta. Essa capacidade de ligação do fitato se dá justamente em função de sua carga negativa, que atrai os minerais com valência positiva, como cálcio, ferro, zinco e magnésio. De forma semelhante, mas a princípio de maneira mais branda, o fitato presente nos alimentos principalmente em cereais e leguminosas é capaz de reduzir também a digestibilidade de proteínas e aminoácidos em até 10% (Silva & Silva, 1999).
Figura 3- Estrutura molecular do fitato
Embora o interesse nutricional na ação do fitato tenha sido primordialmente enfatizado em seu efeito adverso na absorção de minerais, ocasionado pela formação de quelatos com íons metálicos como o cálcio, ferro e zinco, esta mesma habilidade em ligar- se a minerais tem sido estudada com relação aos efeitos benéficos para o organismo humano. Os dados sobre fitato e prevenção de câncer e cálculos renais embora sejam ainda limitados, sugerem uma nova visão da ação do fitato no organismo humano (Silva & Silva, 1999).
Lecitinas
As lecitinas podem ser classificadas como “proteínas ou glicoproteínas, de origem não imunológica, capazes de formar ligações reversíveis a moléculas de sacarídeos”. Simplificando: são substâncias capazes de se ligar a alguns tipos de açúcares. Não pense nos açúcares ingeridos pela alimentação; claro, as lecitinas podem se ligar aos açúcares da dieta, mas sim nas moléculas de açúcares contidas nas membranas celulares dos mais diversos tipos de tecidos, seja no corpo humano ou no organismo de outros animais (Benevides et al., 2011).
O valor nutricional da soja é limitado pela presença de diversos fatores anti-nutricionais como os inibidores das proteases tripsina e quimiotripsina, as hemaglutininas (lecitinas), os compostos fenólicos (taninos), que afetam a digestão e fisiologia dos animais (Prado et al., 1989a; Prado et al., 1989b; Prado et al., 1988). Os inibidores de tripsina da soja, que podem representar até 2% do conteúdo proteico, impedem a completa utilização de suas proteínas pelo organismo dos monogástricos, paralisando a ação da tripsina, responsável pela digestão das proteínas. A presença destes no trato intestinal de monogástricos leva ao aumento na produção de enzimas pelo pâncreas e a hipertrofia deste órgão e eles têm sido relacionados à diminuição da digestibilidade da proteína em peixes (Benevides et al., 2011; Stech et al., 2010). Assim, como no caso do fitato, as lecitinas concentram-se primariamente na semente dos vegetais, mas podem também ser encontradas em menor quantidade nas raízes, folhas, caules, rizomas etc. Apesar de abundante nos vegetais, as lecitinas podem ser produzidas por outros seres vivos, incluindo os animais e, também, os seres humanos (Benevides et al., 2011). Devido à sua presença em praticamente todos os tecidos dos vegetais, e em especial nas sementes, sugere-se que as lecitinas tenham importantes funções fisiológicas para as plantas. Entre elas, destaca-se a função de proteção. Já foi demonstrado em diversos seres vivos como bactérias, fungos, nematódeos e insetos que as lecitinas podem ser extremamente tóxicas, levando-os à morte e, por conseguinte, à salvaguarda dos vegetais. Apesar de mais concentradas em cereais e leguminosas, as lecitinas estão presentes em praticamente todos os vegetais, e por isso a exposição humana a esses componentes é constante e relativamente elevada. As fito-hemaglutininas (PHA, do inglês phytohemagglutinin), seguida da aglutinina do gérmen de trigo (WGA, do inglês wheat germ agglutinin), são as lecitinas mais estudadas. Os feijões são a principal fonte de PHA, enquanto o trigo – mais especificamente o gérmen – é rico em WGA. Ao sabermos que ingerimos lecitinas diariamente em diversos alimentos, e que essas mesmas lecitinas podem ser extremamente tóxicas a bactérias, fungos, nematódeos e insetos (Stech et al., 2010).
Entretanto, é muito importante ressaltar que, tanto em humanos como em animais, os efeitos tóxicos das lecitinas só são observados quando os alimentos ricos nesses componentes são ingeridos crus ou mal cozidos; mesmo assim, nem sempre as lecitinas provenientes de alimentos crus causam toxicidade. Além disso, é evidente que todas as leguminosas, e praticamente todos os cereais, precisam ser cozidos – e bem cozidos, principalmente no caso das leguminosas – para que se tornem comestíveis (Benevides et al., 2011).
Inibidores de protease
As enzimas proteolíticas executam uma grande variedade de funções fisiológicas complexas. Sua importância em conduzir as funções metabólicas e regulatórias essenciais é evidente, devido à sua ocorrência em todas as formas de organismos vivos (Stangarlin et al. 2011). Entre todos os inibidores encontrados nos alimentos de origem vegetal, os inibidores de enzimas proteolíticas (tripsina, quimiotripsina) e amilolítica (α-amilase) são os mais importantes, sendo estas produzidas pelo pâncreas. Como o nome sugere, tais componentes são capazes de inibir as enzimas tripsina e quimotripsina, respectivamente. Essas duas enzimas são proteases, ou seja, têm a função de digerir proteínas (Benevides et al., 2011).
Em microrganismos, os processos fisiológicos que mais requerem a participação de proteases são turnover de proteína, esporulação e germinação de esporos, modificação enzimática, nutrição eregulação da expressão gênica. Inibidores de proteases são proteínas capazes de evitar ou reduzir a atuação de enzimas que degradam proteínas animais e microbianas, mas não as vegetais. De forma geral, são sintetizadas e estocadas em sementes e tubérculos, enquanto crescem como proteção contra predação (Stangarlin et al., 2011).
Em leguminosas, os inibidores de tripsina e lecitinas são conhecidos como Aglutinina de Soja (SBA). A SBA, na soja in natura é resistente às enzimas digestivas no trato gastrintestinal (GI) e se liga ao epitélio intestinal afetando as vilosidades, o que faz com que estas proteínas sejam detrimentais nos processos de digestão, absorção e utilização de nutrientes (Benevides et al., 2011). De forma, semelhante ao observado para as lecitinas, os inibidores de proteína possuem uma função semelhante: prevenir que a semente da planta, que contém seu embrião, seja consumida. Assim, inibindo a digestão da semente pelo predador, o vegetal possui maior probabilidade de sobrevivência. Quanto maior a ingestão de inibidores de protease, menor é a digestibilidade, a absorção e, consequentemente, o aproveitamento das proteínas que são ingeridas através da alimentação. Os inibidores de enzimas digestivas são encontrados com bastante frequência nos alimentos (Benevides et al., 2011; Prado et al., 1989a; Prado et al., 1989b; Prado et al., 1988).
Os inibidores de proteases na soja são constituídos pelo inibidor de tripsina Kunitz e pelo inibidor de tripsina e quimiotripsina Bowman-Birk. São classificados em duas principais categorias: os de alto peso molecular (cerca de 20.000 kDa), que apresentam duas pontes dissulfeto, 181 resíduos de aminoácidos e possuem especificidade primária para tripsina e os de peso molecular entre 6.000 e 10.000 kDa com alta proporção de ligações dissulfeto, 71 resíduos de aminoácidos e capacidade para inibir tripsina e quimiotripsina em sítios de ligações independentes. Cerca de 80% da inibição da atividade tríptica de grãos de soja é causada pela ação do inibidor de tripsina Kunitz. Estes anti-nutrientes apresentam especificidade de inibir as enzimas proteolíticas e, consequentemente, reduzem a digestão proteica de alimentos, proporcionando diminuição no ganho de peso e crescimento dos animais (Benevides et al., 2011; Prado et al., 1989a; Prado et al., 1989b; Prado et al., 1988; Prado & Von Tiesenhauser, 1987).
Glicosídeos cianogênicos
Mais de 2.000 espécies de plantas são conhecidas por serem cianogênicas e capazes de formar gás cianeto de hidrogênio ou ácido cianídrico (HCN), distribuídas em 250 gêneros e 80 famílias, além de ocorrer também em animais do filo Artropoda, em alguns fungos e bactérias (Galindo et al., 2017; Stangarlin et al., 2011). A exposição aguda ou crônica ao HCN pode levar à intoxicação, leve a grave e, em casos extremos, até a morte em humanos e animais, porque o HCN inibe a atividade de metalo-enzimas, principalmente citocromo c oxidase, a enzima final na cadeia de transporte de elétrons respiratórios. A hidrólise de glicosídeos cianogênicos resulta na liberação concomitante de compostos carbonílicos que podem aumentar ainda mais os efeitos tóxicos e repelentes do HCN (Gleadow & Møller, 2014). O HCN é um dos “venenos” de ação mais rápida que se conhece para mamíferos. Trata-se de um composto com odor de amêndoas amargas, volátil a temperatura ambiente e que nas plantas se encontra combinado a outras substâncias, principalmente a açúcares, formando os glicosídeos cianogênicos (Galindo et al., 2017). Os glicosídeos são metabólitos secundários das plantas, fitotoxinas com função de defesa contra herbívoros, fitopatógenos, insetos e moluscos. São substâncias estáveis e inócuas, que só se tornam perigosas ao sofrerem desdobramento (hidrólise) na presença de enzimas específicas (Galindo et al., 2017). A liberação do HCN é devido à degradação de precursores, principalmente de glicosídeos cianogênicos, por enzimas hidrolíticas da planta. A hidrólise dos glicosídeos cianogênicos inicia-se pela hidrólise de carboidratos por -glicosilhidrolase, originando um composto intermediário (α-hidroxinitrila) que é convertido, espontaneamente ou por ação enzimática (α-hidroxinitrila liase), o HCN e a um aldeído ou cetona. As plantas cianogênicas mantêm o ácido cianogênico compartimentalizado em vacúolos das células de raízes, ramos, folhas, flores e frutos, ficando assim isolado dos efeitos da enzima que catalisa a liberação do HCN. Estas plantas podem também, por detoxificação, evitar os efeitos tóxicos do HCN (Stangarlin et al., 2011). A concentração dos glicosídeos cianogênicos é variável nas diferentes espécies de plantas e numa mesma espécie varia dependendo do clima e outras condições que influenciam o crescimento da planta como adubação nitrogenada, deficiência de água e idade da planta, pois quanto mais nova e de crescimento rápido, maior será o teor em glicosídeos cianogênicos (Benevides et al., 2011). Cerca de 300 glicosídeos cianogênicos já foram identificados, dentre os encontrados naturalmente em alimentos, tem-se a amigdalina, encontrada nas sementes de frutos da família das Rosáceas (pera, maçã, pêssego, cereja); a linamarina e lotaustralina, encontrados na mandioca e linhaça e a durrina, encontrada nos grãos jovens de sorgo, glicosídeos que já foram bem estudados (Benevides et al., 2011; Stangarlin et al., 2011). O aminoácido precursor do glicosídeo durrina é a tirosina, a valina para a linamarina e isoleucina para a lotaustralina (Galindo et al., 2017).
Plantas cianogênicas, como a mandioca, apresentam compostos ciânicos e enzimas distribuídas em concentrações variáveis nas suas diferentes partes. Pela ruptura da estrutura celular da raiz, as enzimas presentes (linamarase; β-glicosidase), degradam estes compostos, liberando o HCN, que é o princípio tóxico da mandioca e cuja ingestão ou mesmo inalação, representa sério perigo à saúde, podendo advir sintomas de intoxicação a depender da quantidade e tipo de alimento ingerido, podendo ocorrer casos extremos de envenenamento (Benevides et al., 2011). (Benevides et al., 2011) relatam ainda que o consumo de significativas doses de cianeto, advindas de alimentos ricos em glicosídeos cianogênicos e pobremente processados, pode resultar em intoxicações crônicas e agudas, causando anomalias tais como a doença de Konzo. O cianeto também apresenta notável poder tóxico pelo fato de ser um potente inibidor da citocromo oxidase, o que resulta no bloqueio da cadeia de transporte de elétrons durante o processo de respiração celular.
A dose mínima de HCN capaz de levar a morte de bovinos e ovinos é de cerca de 2 mg/kg de peso vivo (PV), quando ingerido na forma de glicosídeo. Entretanto, existem diferenças na sensibilidade entre as espécies animais e variação na concentração dos glicosídeos cianogênicos, que é maior em plantas jovens, após períodos de pouco crescimento seguidos de chuvas e em solos com alto teor de nitrogênio. Cabe ressaltar que, invariavelmente, a ocorrência da intoxicação depende da rápida ingestão do vegetal cianogênico (Galindo et al., 2017). Além disso, o risco de intoxicação pode ser minimizado a partir da utilização de processos como; cozimento, maceração e secagem, que reduzem o teor desse composto no alimento. Esse efeito benéfico é resultante da remoção de glicosídeos cianogênicos, da inativação das β-glicosidases, ou de ambos (Benevides et al., 2011). Em função do teor de HCN apresentado, as mandiocas são classificadas quanto à toxicidade em: mansas (menos de 50 mg HCN/Kg de raiz fresca sem casca); moderadamente venenosa (50 a 100 mg HCN/Kg de raiz fresca sem casca) e venenosa ou brava (acima de 100 mg HCN/Kg de raiz fresca sem casca). O conhecimento da toxicidade da planta limita o seu emprego, tanto na alimentação humana como na nutrição animal. As técnicas de processamento industrial para diminuição do princípio tóxico baseiam- se na dissolução em água ou na volatilização, envolvendo processos como a maceração, remolho em água, fervura, torrefação ou fermentação das raízes de mandioca, ou ainda, a combinação desses processos (Benevides et al., 2011). As implicações das intoxicações crônicas por glicosídeos cianogênicos presentes na mandioca são diversas. Quando envolve o sistema nervoso é chamada Neuropatia Atáxica Tropical (TAN), que é representada por mielopatia, atrofia óptica bilateral, surdez bilateral e polineuropatia (Benevides et al., 2011). Galindo et al. (2017) relatam que após o consumo, o HCN é prontamente absorvido no tubo digestivo e distribuído pelo corpo através do sangue. Os ruminantes são mais propensos a intoxicação que os não ruminantes, em razão do baixo pH do estômago dos monogástricos que interrompe a hidrólise dos glicosídeos cianogênicos. As condições do rúmen e a proporção de microrganismos envolvidos na digestão, hidrólise e detoxificação são os fatores primários que interagem para a liberação do HCN nos ruminantes. Pelo menos 30 cepas de bactérias ruminais são capazes de hidrolisar os glicosídeos cianogênicos e as maiores taxas de produção de HCN foram observadas em bovinos em jejum por 24 horas e em pH ruminal entre 5 e 6, que é favorecido por uma dieta a base de forragem de alta qualidade.
A patofisiologia da intoxicação por HCN envolve a forte ligação deste com a enzima citocromo c oxidase (CcOX) heme a3-CuB que, sob condições normais, reduz o O2 a H20 e direciona a síntese de ATP (trifosfato de adenosina). Assim, a transferência de oxigênio das hemácias para as células somáticas é interrompida e o passo final da fosforilação oxidativa é bloqueado, de modo que há menor quantidade de energia disponível para manter a homeostase do organismo (Galindo et al., 2017). Além disso, Gleadow & Møller (2014) revelam que em geral, as plantas abastecidas com altos níveis de fertilizantes nitrogenados (amônia ou nitrato) têm um conteúdo aumentado de glicosídeos cianogênicos. Onde, campos altamente fertilizados de sorgo forrageiro, por exemplo, às vezes podem se tornar tóxicos para o gado (potencial de cianeto > 600 ppm). Em alguns estágios da planta, como no estágio de plântula, o potencial de cianeto é provavelmente transcricionalmente regulado, enquanto em outros estágios a regulação pode ser controlada em múltiplos níveis. Também foi observada uma ligação entre o suprimento de nitrogênio e a implantação de glicosídeos cianogênicos em leguminosas, onde a taxa de colonização por rizóbio com fixação de nitrogênio tem sido associada a concentrações mais altas de linamarina e lotaustralina e diminuiu a herbivoria no trevo e feijão.
Considerações finais
É possível perceber que os fatores anti-nutricionais, na verdade, não são tão “anti-nutricionais” assim. Lecitinas e inibidores de protease, apesar de poderem causar efeitos gastrointestinais adversos e atrapalhar a digestão de proteínas, respectivamente, são inativados por métodos de cocção convencionais. O fitato, apesar de praticamente não ser afetado pelo calor, não se configura como um problema real na absorção e aproveitamento de nutrientes, desde que a alimentação seja variada, balanceada e rica em alimentos de verdade.
O consumo de cereais e leguminosas pode apresentar vantagens e desvantagens. Uma das principais “desvantagens” é que, devido à presença de fitato, é mais fácil você obter maior quantidade de minerais – e outros nutrientes – a partir de fontes vegetais distintas, como hortaliças, raízes e tubérculos. Por outro lado, uma “vantagem” é que cereais e leguminosas são, em geral, alimentos mais baratos que outras opções de alimentos vegetais, facilitando seu acesso.
Entretanto, vale sempre ressaltar que em populações cuja alimentação é muito dependente de cereais e leguminosas, como é o caso de muitos países subdesenvolvidos e em desenvolvimento, além dos veganos, o excesso de fitato proveniente da dieta pode representar um risco relativamente elevado de deficiências de alguns minerais, como ferro e zinco.
Os “fatores anti-nutricionais” nada mais são do que componentes naturais responsáveis por exercerem funções fisiológicas nos vegetais. Isso não necessariamente quer dizer que eles não poderiam ter efeitos deletérios em humanos; entretanto, com as evidências que atualmente temos disponíveis, não é possível afirmar que, nas quantidades normalmente ingeridas, seu consumo seria capaz de causar problemas. Ao contrário, é bem possível que eles tragam mais benefícios do que prejuízos, e, até por isso, há muito tempo sugere-se que o termo "anti-nutricional" seja revisto.
O gossipol afeta a gametogênese masculina e feminina, além de promover lesões nos embriões. Apesar das vantagens econômicas e nutricionais dos subprodutos do algodão para alimentação dos ruminantes, as condições de segurança para o uso deste alimento em matrizes ainda não foram estabelecidas no Brasil.
As saponinas estão sendo recentemente estudadas, comparado aos taninos, principalmente pela dificuldade de isolamento e identificação desses compostos. Portanto, as descobertas de usos vêm acompanhadas da evolução das técnicas de farmacognosia. Os principais estudos feitos são na imunologia como adjuvante em vacinas. Na nutrição animal, o uso é bastante promissor. Tanto para bovinos como manipuladores da fermentação ruminal, quanto em monogástricos como substitutivos aos antibióticos promotores de crescimento.












.jpg&w=3840&q=75)