Introdução
A alta produtividade observada na exploração avícola depende, dentre outros fatores, principalmente da obtenção adequada de nutrientes pelo organismo. Para tanto dietas específicas para cada fase da vida, linhagem e diferentes climas têm sido exaustivamente pesquisadas e utilizadas. Todo este aporte nutricional faz com que a nutrição das aves represente de 70% a 80% dos custos de produção.
Entretanto, para que estas dietas sejam devidamente processadas (digeridas e absorvidas) a mucosa intestinal deve apresentar características estruturais morfo fisiológicas adequadas. Os processos de absorção são dependentes de mecanismos de transporte que ocorrem na membrana das células epiteliais da mucosa, sendo dessa forma, a integridade destas de vital importância, já que é a via de entrada dos nutrientes para o desenvolvimento da ave.
Apesar disso, pouca atenção tem sido dispensada para o controle ou manipulação da absorção de nutrientes, a fim de reduzir a demanda metabólica associada a esses processos. Buscando entender a influência desses aspectos sobre o desempenho dos animais e a viabilidade da produção avícola, discutiremos a importância da manutenção da integridade celular com enfoque na maximização da absorção dos nutrientes.
Organização Estrutural da Mucosa Intestinal
O intestino delgado é a porção mais longa do sistema digestório, responsável pela digestão final do alimento e absorção dos nutrientes (Boleli et al., 2002). A mucosa intestinal apresenta projeções microscópicas denominadas de vilos, que são constituídos pôr três tipos de células, funcionalmente distintas: enterócitos, células caliciformes e as células enteroendócrinas.
Os Enterócitos são células que respondem pela digestão final do alimento e pelo transporte transepitelial dos nutrientes a partir do lúmen. Estas células apresentam um processo de maturação que ocorre durante o processo de migração da cripta (base) para o ápice do vilo. Esta maturação está na dependência da síntese de proteínas estruturais, as quais são codificadas pelo genoma das células intestinais.
As Células Caliciformes são secretoras de glicoproteínas, que tem a função de proteger o epitélio intestinal da ação de enzimas digestivas e efeitos abrasivos da digesta.
As Células Enteroendócrinas são produtoras de hormônios peptídicos (gastrina, secretina e colecistoquinina) e monoaminas biogênicas, substâncias essas que participam na regulação da digestão, absorção e utilização dos nutrientes.
Quanto maior o número de células, maior o tamanho do vilo, e pôr conseqüência, maior a área de absorção de nutrientes. Yamauchi & Isshiki (1991) mostraram que a densidade de vilos/área era reduzida com o aumento da idade dos frangos, este resultado evidencia que com o aumento da idade do frango ocorre aumento do tamanho do vilo (Tabela 1).
Outro fator relevante para a absorção dos nutrientes na membrana luminal é a quantidade de microvilos existentes nos enterócitos. Os microvilos atuam como um amplificador de área para a absorção dos nutrientes, e são projeções da membrana luminal do enterócito.
Tabela 1. Número de vilos/segmento no intestino delgado de frangos. Cada resultado representa valores obtidos em 830 µc2.
Estruturas secundária e determinados compostos também exercem papel importante no processo de digestão, absorção de nutrientes e proteção do trato gastrintestinal (TGI) destes animais, como glicocálix e o muco.
Glicocálix são prolongamentos de polissacarídeos do enterócito que penetram no lúmen intestinal. Estas estruturas tem funções importantes, sendo uma delas a manutenção da camada aquosa próxima à mucosa intestinal, em pH neutro, que permite a ação de enzimas de membrana. Outra função do glicocálix está associada à presença de receptores que são capazes de ligar-se à bactérias patogênicas e não patogênicas e neste sentido manter a sanidade da mucosa intestinal (Boleli et al., 2002).
O Muco é uma glicoproteína insolúvel em água, com função protetora relacionada, basicamente, contra a ação mecânica. Devido a grande aderência à superfície, o muco não é totalmente removido, mesmo durante a ação de forças mecânicas vigorosas que ocorrem durante a digestão, protegendo o epitélio durante a passagem de alimento, e com ação lubrificante sobre alimentos sólidos.
A camada de muco, tem papel importante, também, na proteção contra infecções, pois funciona como barreira protetora que impede o contato direto de microorganismos com as células epiteliais. O muco do intestino delgado e ceco contém uma rica população de bactérias e protozoários, as quais ligam-se às glicoproteínas e não aderem à mucosa. Os componentes da mucina, funcionam como falsos receptores para os microorganismos, fazendo com que os mesmos sejam envoltos pela camada de muco, não expressando sua capacidade patogênica. A espessura da camada de muco é variável de espécie para espécie, mas tem sido relatado espessura entre 160 a 650 µc. Situações como jejum ou alterações de dieta, podem ocasionar redução da camada protetora de muco e, propiciar a ação de bactérias e protozoários patogênicos e consequentemente o desencadeamento de processos lesivos na mucosa.
Quando a mucosa sofre processo de agressão ocorre aumento do número de células caliciformes nos vilos, estas aumentam suas descargas e depletam-se de secreção durante um processo infeccioso no intestino delgado. Esta atividade aumentada parece ser devido a ação de enterotoxinas que estimulam a atividade secretória das células caliciformes.
A viscosidade do conteúdo intestinal também possui papel de extrema importância para manutenção da integridade das células epiteliais do intestino, por impedir rupturas na camada de muco.
Maturação Funcional da Mucosa Intestinal
Os mecanismos indutores do desenvolvimento intestinal estão na dependência de fatores intrínsecos e extrínsecos. A mucosa intestinal tem crescimento contínuo, sendo afetada tanto pelos nutrientes da dieta (características físicas e químicas), como pelos níveis de hormônios circulantes (insulina, tiroxina, triiodotironina, IGF-I, colecistoquinina, entre outros). Estas informações são altamente relevantes, pois o entendimento da regulação do crescimento, e funcionamento da mucosa intestinal que as técnicas de manejo serão adotadas, tanto para crescimento, manutenção e reparo da mucosa, frente a diferentes dietas, ou lesões induzidas por agentes mecânicos ou patógenos.
Na eclosão, o TGI das aves está anatomicamente completo, mas sua capacidade funcional, de digestão está imatura, se comparada à de aves adultas. O TGI sofre então um processo de maturação que envolve adaptações morfo e fisiológicas. O intestino delgado aumenta em peso mais rapidamente que a musculatura corporal. Este processo de rápido crescimento em relação ao peso corporal é verificado desde o terço final da incubação (Maiorka et al. 2000 b), alcançando máximo desenvolvimento relativo do 6o ao 8o dia em perus e do 4o ao 8o dia em frangos (Noy & Sklan, 1998). Isto fortalece a premissa de que a adequada alimentação na primeira semana de idade do pinto tem papel relevante no desempenho do frango.
Microflora Intestinal
O número e composição dos microorganismos da microflora intestinal das aves varia consideravelmente ao longo do TGI. No duodeno, o pH é neutro e os microorganismos colonizam este segmento, bem como o jejuno e íleo. O ceco é reconhecido como o segmento de maior colonização de microorganismos, sendo que grande número de bactérias Gram positivas e negativas estão presentes neste local.
As bactérias no TGI podem encontrar-se, tanto associadas intimamente com o epitélio, ou livres na luz intestinal. As bactérias livres devem multiplicar-se rapidamente para compensar a eliminação pelo peristaltismo intestinal ou ainda agregar-se às demais bactérias que encontram-se aderidas na mucosa intestinal.
Esta variada composição da microflora intestinal pode ser benéfica ou maléfica para o hospedeiro, dependendo da natureza e da quantidade de microorganismos. Os efeitos maléficos seriam: diarréia, infecções, distúrbios hepáticos, carcinogênese, putrefação intestinal, redução da digestão e absorção de nutrientes. Já os benefícios, estariam vinculados à inibição do crescimento de bactérias patogênicas, estímulos ao sistema imune, síntese de vitaminas, redução da produção de gases e melhor digestão e absorção dos nutrientes.
A concepção de que o desenvolvimento de microflora poderia levar a prejuízos em lotes de frangos, seja pela concorrência pelo alimento ou devido a lesões provocadas diretamente na mucosa intestinal pelas bactérias patogênicas, levou a utilização de antibióticos, os quais foram erroneamente denominados de promotores de crescimento, tendo como principal função a redução da carga microbiana no TGI.
Entretanto, com a preocupação de que estes aditivos possam induzir resistência a patógenos importantes para os seres humanos, a legislação de muitos países tem proibido a utilização dos mesmos em ração animal. Assim, um novo conceito visando promover o equilíbrio da microbiota intestinal dos animais, a fim de obter um bom desempenho produtivo, sem riscos para a saúde humana vem sendo empregado.
Aderência das Bactérias à Mucosa Intestinal
As bactérias têm capacidade de aderir tenazmente à superfícies mais diversas, desde o esmalte dos dentes, pulmões, intestino e até a uma rocha submersa em um rio. Este processo de aderência é feito através de polissacarídeos (moléculas de açúcares ramificados) que se projetam da parede externa da bactéria formando uma estrutura denominada fímbria. A aderência das bactérias mediadas pela fímbria é que determina a localização das mesmas nos diferentes ambientes e é o maior determinante para o início de processos patológicos bateríamos. É interessante salientar que a fímbria pode sofrer alterações, em função da sua composição de polissacarídeos e com isto ter sua capacidade de aderência modificada.
Considerando que os enterócitos no intestino delgado apresentam seu glicocálix também composto por polissacarídeos, a colonização por bactérias nos diferentes segmentos parece estar na dependência da aderência da fímbria de uma bactéria com o glicocálix do enterócito. Este mecanismo parece ser o que regula todo o processo de colonização das bactérias no intestino delgado e ceco das aves, na fase pós -eclosão. Em muitos casos o elo de ligação entre estas estruturas, pode ser uma proteína denominada de lectina, a qual se liga especificamente a um polissacarídeo com estrutura molecular peculiar.
A aderência à mucosa intestinal parece, portanto, o mecanismo chave da colonização das bactérias patogênicas, e seus efeitos nocivos sobre a saúde intestinal (Macari & Maiorka). Assim, processos que possam prevenir a aderência das bactérias são eficazes em reduzir a colonização por patógenos, nos segmentos do TGI. Três procedimentos são propostos para reduzir a aderência bacteriana:
- Promover a quebra dos mecanismos que sintetizam a fímbria, principalmente pela inibição da polimerase bacteriana que estabelece os elos de ligação dos açúcares no polissacarídeo;
- Desenvolver compostos que ocupem e bloqueiem o loco ativo de ação da lectina, que liga a fímbria da bactéria com o glicocálix do enterócito;
- Estabelecer bloqueio dos receptores nas células hospedeiras, evitando assim a ligação da fímbria bacteriana com o glicocálix do enterócito.
Fatores que Causam Injúrias a Mucosa Intestinal
Inúmeros agentes infecciosos ou não infecciosos podem lesar a mucosa intestinal, além de, comprometer os processos digestórios. Na tabela 2 estão apresentados as principais injúrias que afetam a mucosa intestinal e os agentes precursores destas.
Tabela 2. Principais injúrias que acometem a mucosa intestinal e seus respectivos agentes.
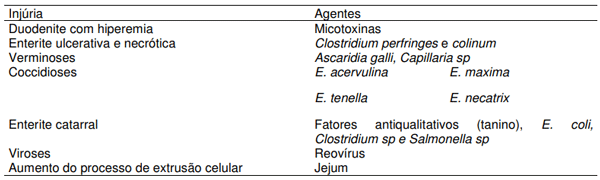
Um aspecto de manejo que pode comprometer seriamente a mucosa intestinal esta ligada ao fornecimento de água e ração logo após a eclosão. Em estudo realizado (Maiorka et al., 2003) foi observado que o jejum de 24h de água e/ou ração afetou negativamente o desenvolvimento da mucosa intestinal de pintos recém eclodidos. Sob microscopia eletrônica de varredura foi possível observar que o atraso na ingestão de água e/ou ração logo após a eclosão aumentou a quantidade de muco e a extrusão celular nas células do intestino delgado. Estes dados nos levam a especular que esta injúria provocada pelo jejum logo após a eclosão pode trazer prejuízos por todo ciclo de produção do animal, visto que este é o período de maior desenvolvimento da mucosa intestinal. Ademais, deve -se recordar que mucosa faz parte do sistema imune do animal funcionando como uma barreira de defesa contra a invasão de microorganismos patogênicos passíveis de causar septicemias, que ocasionam a mortalidade precoce destes animais, bem como tornando-os imunologicamente menos eficientes.
Por outro lado, a mucosa intestinal de aves adultas também pode ser afetada negativamente pelo consumo de determinados alimentos. Alguns ingredientes da dieta podem possuir compostos, denominados fatores antiqualitativos (antinutricionais), capazes de alterar a estrutura da mucosa e consequentemente a absorção de nutrientes e o desempenho dos animais. Oliveira et al., (2000) observaram que frangos de corte submetidos a dietas com Leucena proporcionaram um aumento no número de células caliciformes e piora no ganho de peso e conversão alimentar. Este aumento de células caliciformes pode ser atribuído como uma resposta fisiológica aos fatores antiqualitativos (alcalóides) presentes na Leucena. Da mesma forma outros fatores antiqualitativos como os inibidores de proteases presentes na soja e o tanino presente no sorgo podem causar alterações estruturais na mucosa intestinal.
Apesar de poucas informações de pesquisa sobre a influência da viscosidade do conteúdo intestinal sobre a manutenção da integridade da mucosa, parece-nos obvio que alterações causadas pela ingestão de determinados alimentos que modificam a viscosidade podem trazer problemas, uma vez que esta tem papel importante na manutenção da camada de muco. Na prática, a dificuldade de utilizar determinados carboidratos de origem não amilácea como as pentosanas e os β-glucanos, é devido a estes compostos aumentarem a viscosidade da digesta. Isto afeta o valor nutricional dos alimentos, seja por falta de enzimas endógenas (possuem ligações do tipo β 1,3 e 1,4, que não são hidrolizadas pelas enzimas endógenas) ou devido ao muco criar uma barreira para a ação das enzimas digestivas. Em adição, também podem aumentar a quantidade de substrato para o desenvolvimento de microorganismos e, com isto, afetar o equilíbrio da microbiota intestinal. Desta forma, com a necessidade de utilização de alimentos alternativos como por exemplo o trigo (ricos nestes compostos), o emprego de enzimas exógenas em dietas de aves vem se tornando mais importantes.
Adaptação Molecular da Mucosa Intestinal
Após a perda de grandes áreas na mucosa intestinal responsáveis pela digestão e absorção de nutrientes, seja por ressecção de parte do intestino delgado ou pela ação de agentes patogênicos, o epitélio remanescente torna-se hiperplásico com maior altura de vilo e profundidade da cripta (Dowling, 1992; Porus, 1965). A produção de células na cripta aumenta e o mesmo ocorre com o número de células que compõem o vilo, sendo que este processo apresenta velocidade considerável. Assim, devido ao aumento da mucosa intestinal, o intestino como um todo apresenta maior capacidade de absorção de nutrientes (Dowling, 1992; Dowling & Booth, 1967; Williamson et al., 1978a,b).
No entanto, trabalhos têm sugerido que a proliferação celular na cripta determina o aparecimento de enterócitos imaturos, que apresentam baixa capacidade absortiva, bem como reduzida atividade das enzimas (Buts et al., 1987; Gleeson et al., 1972; Menge & Robinson, 1978). Outros pesquisadores já evidenciaram que a resposta dos novos enterócitos à ressecção ou lesão da mucosa é mais complexa (Albert & Young, 1992; Chaves et al., 1987; Dowling, 1992), ocorrendo, por exemplo, aumento da atividade de certas enzimas de membrana nestas células (Dowling, 1992).
Estudos recentes mostram mecanismos moleculares da adaptação dos enterócitos. Após 48 horas da ressecção de parte do intestino delgado, a porção remanescente já apresenta aumento de até três vezes na expressão de genes responsáveis pelos mecanismos absortivos nos enterócitos, ou seja, aumento do mRNA de FABP (proteina carreadora de ácidos graxos) e apolipoproteina A-I (Apo A-I) (Rubin et al., 1996). Estes achados moleculares evidenciam que os enterócitos são capazes de responder de forma aguda às transformações no intestino delgado, em especial a redução da superfície absortiva, através da expressão de genes que codificam a síntese de proteínas de transporte de nutrientes.
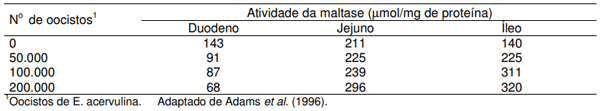
O trabalho de Adams et al. (1996) evidencia a adaptação molecular da mucosa intestinal quando da afecção com Eimeria acervulina, no que concerne a atividade enzimática. Estes pesquisadores mostraram que ocorre um aumento da atividade da maltase na membrana das células epiteliais do jejuno e íleo de frangos de corte experimentalmente infectados (Tabela 3). A redução da atividade no duodeno, onde ocorre a lesão, foi compensada pelo aumento da atividade da enzima no jejuno e íleo (regiões com ausência de lesão). Este mecanismo compensatório parece ser induzido pela presença do alimento que ativa genes que transcrevem a síntese da enzima.
Tabela 3. Efeito da infecção com E. acervulina sobre a atividade da maltase na membrana da mucosa intestinal de frangos.
Custo Energético da Absorção de Nutrientes e Reparo da Mucosa Intestinal
Trabalhos tem mostrado a importância do desenvolvimento da mucosa, bem como a manutenção de sua integridade, sobre o desempenho produtivo das aves, e várias são as pesquisas que oferecem alternativas de manejo para a proteção da mucosa, pois distúrbios dos processos de digestão e absorção levam a queda do desempenho. Considerando que a mucosa intestinal tem crescimento contínuo, devido à descamação das células para o lúmen intestinal, fica evidente que a reposição celular se faça às custas de consumo de nutrientes, os quais são provenientes das reservas energéticas do organismo da ave e da ração ingerida.
McBride & Kelly (1990) estimaram que, a manutenção do epitélio intestinal e estruturas anexas de suporte, tem custo de 20% da energia bruta consumida pelo animal. Com base nestas informações é importante estar alerta para o fato de que parte da energia ingerida pelas aves fica destinada para a manutenção da mucosa, e quanto maior a necessidade de reparo da mesma, menor será a energia líquida de produção.
Bird et al. (1994) analisando a absorção de um derivado da glicose (3-0-metil-D-glicose) em função da quantidade de energia gasta (estimada pelo consumo de oxigênio/unidade de glicose absorvida), concluíram que a mucosa consumia entre 80 a 90% de toda a energia utilizada pelo TGI, sendo que os processos sódio-dependentes (bomba de Na+-K+) eram responsáveis por 50 a 90% do consumo energético total da mucosa.
Dessa forma a manutenção da mucosa intestinal, em condições fisiológicas normais, tem custo energético elevado para as aves. Quando ocorrem lesões, além da redução da quantidade de substrato digerido e absorvido, há ainda o custo para renovação deste tecido. A energia conservada pelo reduzido “turnover” de células no epitélio intestinal poderá ser utilizada para desenvolvimento de outros tecidos como por exemplo massa muscular. Assim, o rendimento econômico do lote estará seriamente comprometido quando da existência de afecções na mucosa do TGI.
Agentes Tróficos
Agente trófico é aquele que estimula o desenvolvimento da mucosa intestinal, acelerando o processo mitótico na região cripta-vilo, e provocando como conseqüência aumento no número de células e tamanho do vilo.
Vários agentes parecem ter ação trófica sobre a mucosa intestinal, dentre eles encontram-se alguns aminoácidos (glutamina), ácidos graxos de cadeia curta (acético) e prebióticos (mananoligossacarideos e frutoligossacarideos). Muitos destes agentes são indutores de mecanismos de transcrição gênica pela ativação de enzimas importantes no processo mitótico na região cripta-vilo. Pôr exemplo, a indução da enzima ODC (ornitina-descarboxilase), que é uma enzima importante no processo de proliferação celular, parece ocorrer quando da presença de glutamina. Outros têm ação indireta, ou seja, favorecem os mecanismos de manutenção da integridade epitelial pôr permitir maior sanidade na mucosa intestinal, através de processos que promovam o equilibrio da microbiota intestinal.
A glutaminaé o aminoácido em maior quantidade no tecido muscular e no plasma, tendo sido observado importantes efeitos deste aminoácido sobre a reconstituição da mucosa intestinal, uma vez que é o principal substrato para os
enterócitos. A oxidação da glutamina estimula a troca de sódio/hidrogênio (Na+/H+) na membrana luminal do enterócito, levando a maior absorção iônica (Rhoads et al., 1997). Outro mecanismo sugerido para a ação trófica da glutamina é o aumento da atividade da proteína quinase, a qual ativa a mitogênese (Blikslager et al., 1997). A adição de 1% de L-glutamina na dieta de frangos, a base de milho e farelo de soja, foi capaz de aumentar o tamanho dos vilos, no duodeno e íleo (Tabela 4), quando avaliados nos primeiros 7 dias de idade (Maiorka et al., 2000a).
Ácidos graxos de cadeia curta – acético, propiônico e butírico. Estes agentes além de atuarem reduzindo o pH, com efeitos fungicida, bacteriostático e bactericida têm importante função metabólica, pois têm sido mostrado que os mesmos são metabólitos primários dos colonócitos, ou seja, células que compõem a mucosa do cólon. Talvez em frangos, este efeito seja mais evidente nos cecos. Estudos com ratos tratados com ácidos graxos de cadeia curta, mostraram aumento da quantidade de DNA da mucosa do colon, sugerindo hiperplasia acentuada neste segmento do TGI. Por outro lado, foi encontrado aumento da proliferação celular na mucosa do jejuno (Blikslager et al., 1997).
Tabela 4. Altura de vilo (µm) no duodeno, jejuno e íleo de frangos de corte aos 7 dias de idade.
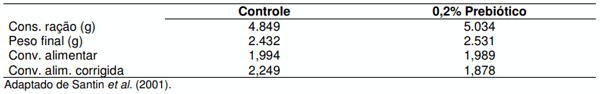
Prebióticos são produtos contendo carboidratos que não são digeridos na porção proximal do TGI de monogástricos e podem ser usados para reduzir a colonização por bactérias enteropatogênicas (Gibson & Roberfroid, 1995). São representados principalmente por mananoligossacarideos e frutoligossacarídeos; Estas substâncias atuam mantendo ou restabelecendo as condições de equilíbrio da microbiota no TGI. Santin et al., (2001) mostraram os efeitos da adição de parede celular de S. cerevisiae, a qual é constituída de mananoligossacarídeos sobre o desenvolvimento da mucosa intestinal de frangos (Tabela 5).
Tabela 5. Altura de vilo (µm) no duodeno, jejuno e íleo de frangos de corte aos 7 dias de idade.
Os resultados mostram que a adição deste prebiótico na ração de frangos tem efeito sobre o desenvolvimento da mucosa intestinal, com aumento da altura dos vilos, sendo este efeito mais acentuado na primeira semana de vida do frango. Tendo como conseqüência um pronunciado aumento no ganho de peso das aves que receberam o prebiótico aos 42 dias de idade (Tabela 6). Estes resultados foram também evidenciados em um estudo realizado em granja comercial, onde a adição de mananoligossacarídeo na dieta de frangos proporcionou melhora no ganho de peso e na conversão alimentar (Tabela 7).
Tabela 6. Consumo de ração (g), ganho de peso (g) e conversão alimentar (g/g) de frangos de corte aos 42 dias de idade.
Tabela 7. Consumo de ração (g), peso final (g), conversão alimentar (g/g) e conversão alimentar corrigida (g/2.500g) aos 45 dias.
Implicações Práticas da Manutenção da Integridade da Mucosa Intestinal
A maioria dos técnicos não avaliam a importância de manter a integridade deste tecido, pois consideram que mecanismos de digestão e absorção são inerentes aos mecanismos fisiológicos do TGI da ave, não podendo ser manipulados. Um aspecto relevante que deve ser considerado é o tempo de “turnover” celular, que oscila entre 90 a 96 horas. Este período de tempo parece curto; contudo, considerando o tempo de criação do frango representa nada menos do que 9% do tempo de vida da ave. Desta forma, fatores que afetam a integridade da mucosa e aumentam o “turnover” celular vão aumentar também o gasto energético de manutenção das aves. Na prática isto resulta em pior conversão alimentar já que parte dos nutrientes ingeridos são destinados a processos metabólicos envolvidos com o reparo da mucosa intestinal além da menor eficiência absortiva observada.
Com isso podemos especular que todo o manejo voltado a diminuição do desequilíbrio funcional entero -gástrico (controle de patógenos intestinais e micotoxicoses, fornecimento de alimento logo após a eclosão, aporte correto de nutrientes e uso de aditivos promotores da saúde intestinal) pode proporcionar um melhor desempenho dos animais com menor custo de produção.
Esse artigo foi originalmente publicado em V SIMPÓSIO BRASIL SUL DE AVICULTURA 05 a 07 de abril de 2004 – Chapecó, SC - Brasil | http://www.cnpsa.embrapa.br/sgc/sgc_publicacoes/anais_V_bsa_Alex.pdf. Este trabalho está licenciado sob uma licença Creative Commons Attribution 4.0 International License.












.jpg&w=3840&q=75)