1 INTRODUÇÃO
O Brasil é produtor e exportador de alimentos, incluindo produtos avícolas. Durante décadas o Brasil inseriu nas composições das dietas de aves, os aditivos antibióticos, com função promotora de crescimento, que por meio de exclusão competitiva mantém o equilíbrio da microbiota intestinal, aumentando a eficiência produtiva com consequente diminuição dos índices de mortalidade (ALVES, 2017; CASTANON, 2007).
De maneira geral, define-se por aditivos, substância, microrganismos ou produto formulado, adicionados intencionalmente às rações em pequenas quantidades, seguindo determinadas normas de uso, que possuí função profilática e pró-nutricional, que não venha trazer prejuízos ao animal, e nem mesmo ao ser humano, sem deixar resíduos em seus produtos finais, seja carne, ovos ou leite, que seguirão para consumo (BRASIL, 2004).
Os aditivos podem ser divididos em três grupos, sendo estes classificados de acordo com o seu modo de ação ou característica funcional (ALVES, 2017; BRASIL, 2004). São eles:
1- Profiláticos: Têm a finalidade de prevenir possíveis enfermidades causadas por agentes patogênicos, e perdas de vitaminas por oxidação.
2- Coadjuvantes: Atuam sobre as características físicas dos ingredientes das rações, podendo alterar a cor, consistência, odor, conservação, entre outros.
3- Pró-nutriente: Favorecem a atuação de nutrientes dietéticos pelos animais, aumentando a eficiência produtiva.
É inquestionável a favorável relação custo: benefício com a inclusão de antibióticos nas rações. Porém, o mercado consumidor de produtos de origem animal tem intensificado as exigências para produtos sem o uso de antibióticos. Em razão disso, a indústria produtora busca de forma constante, alternativas por produtos similares, sem que os desempenhos das aves sejam afetados de forma significativas. Com isso, produtos alternativos têm surgido de forma constante e entre estes tem-se os probióticos, prebióticos, simbióticos, óleos essenciais e mais recentemente o extrato pirolenhoso ou vinagre de madeira. Assim, objetiva-se com o presente, fazer abordagem geral sobre o extrato pirolenhoso, antibióticos, probióticos, prebióticos e óleos essenciais.
2 EXTRATO PIROLENHOSO
O extrato pirolenhoso (EPL) é uma substância líquida, aquosa, de caráter ácido (WEI; MA; DONG, 2010) e tonalidade castanho avermelhada (MATHEW; ZAKARIA, 2015). É derivado da pirólise de materiais lenhosos (WEI; MA; DONG, 2010), sendo a carbonização da madeira sua principal fonte. Também é conhecido como ácido pirolenhoso, líquido pirolenhoso, vinagre de madeira, licor pirolenhoso, fumaça líquida ou bioóleo (CAMPOS, 2007).
Durante a queima de material lenhoso, vapores orgânicos condensáveis são resfriados e condensam, formando o EPL, cuja fração é rica em água e compostos oxigenados enquanto que os vapores não condensáveis deixam o sistema na forma gasosa (MATHEW; ZAKARIA, 2015). Sua produção é obtida a partir da indústria em que utiliza a madeira como combustíveis para os processos térmicos. No entanto, além da madeira, outros produtos podem ser utilizados, para a sua produção, como bambu, espigas de milho, pinhas, caroços e cascas de frutos, como coco e noz (WEI; MA; DONG, 2010).
O material utilizado na produção do extrato pirolenhoso influencia diretamente na sua qualidade e composição. Desta forma, deve-se evitar o uso de madeiras tratadas com pesticidas ou provenientes de plantas tóxicas, o que poderia inviabilizar o extrato pirolenhoso devido sua composição provavelmente tóxica. No Brasil, a maior parte da madeira destinada a produção do extrato pirolenhoso é originada de plantações de eucalipto, pinus e bambu (CAMPOS, 2007). A obtenção do produto com garantia de qualidade deve seguir orientações quanto aos níveis de alcatrão e outros compostos tóxicos que poderão inviabilizar o produto. O alcatrão é poluente e contém componentes cancerígenos (ROCHA et al., 2022).
A maioria dos trabalhos atuais relacionados a produção e aplicação do extrato pirolenhoso ocorrem em países como Japão, Coreia do Sul, e China. Os relatos de fabricação e utilização do extrato pirolenhoso são muito antigos. Pesquisadores de diversas áreas principalmente na indústria agrícola e alimentícia tem sido atraído por este produto que possui inúmeras trabalhos comprovando a eficiência do seu uso em diversas culturas, como controle de praga (CAMPOS, 2007). No Brasil a sua utilização para fins diversos é recente (PETTER et al., 2013).
É um produto que tem sido aplicado para fins diversos, tanto na agricultura como na pecuária, principalmente as relacionadas a produção animal (THEAPPARAT et al., 2014). Atualmente, pesquisas em diversas áreas do conhecimento buscam avaliar seu potencial como aditivo bactericida/fungicida contra patógenos vegetais; pesticida/praguicida em plantações e promotor de crescimento (CHU et al., 2013) e antimicrobiano (WANG et al., 2012) para aves e suínos.
Diante da possibilidade de tantos efeitos benéficos relacionados ao seu uso, o extrato pirolenhoso vem despertando a curiosidade de pesquisadores e técnicos de várias áreas, principalmente daquelas relacionadas a produção de alimentos de origem vegetal e animal, podendo, num futuro próximo, tornar-se uma alternativa aos aditivos convencionais utilizados na pecuária.
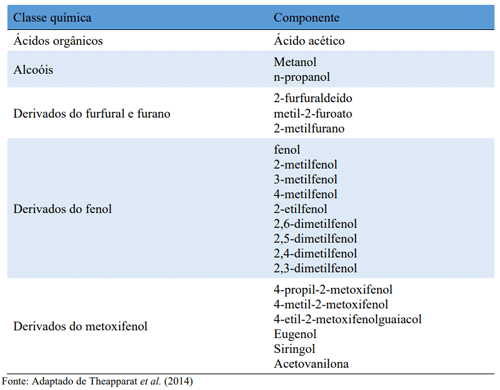
Theapparat et al. (2014) verificaram a composição de oito extratos pirolenhosos oriundos da madeira de cinco espécies de plantas distintas e encontraram que o ácido acético é a molécula em maior concentração, seguida por compostos fenólicos, ácidos orgânicos, álcoois, derivados de furfural e furano e derivados de fenol e metoxifenol (Tabela 1). Assim, extratos pirolenhosos de origens distintas podem conter diferentes concentrações e tipos de substâncias orgânicas, inclusive de componentes que apresentem alguma atividade biológica (WEI; MA; DONG, 2010).
Tabela 1 – Componente fenólicos e não fenólicos e fenólicos identificados no extrato pirolenhoso (EPL) de diferentes fontes de biomassa vegetal.
Na produção do EPL, pode-se encontrar três estados físicos: sólida – produto resultante é o carvão vegetal; gasosa – gases não condensáveis e líquida - fração pirolenhosa (CAMPOS, 2007), sendo que, as proporções obtidas em cada etapa pode variar de acordo com a tecnificação/equipamento utilizado para obtenção do produto, temperatura e tipo de madeira utilizada na queima, sendo a madeira não tratada, a mais indicada para este processo.
Em termos numéricos, em 100% da madeira queimada (eucalipto), obtém-se em termos de matéria seca, 49,90% de carvão vegetal, 17,10% gases condensáveis e 33% perdas e gases não condensáveis (VIEIRA et al., 2014).
Para obtenção do EPL, a fumaça ocasionada pela queima é resfriada, ao condensar passa para o estado líquido, apresentando tonalidades de cores que vão do marrom, marrom-amarelo claro, castanho e castanho-avermelhado. Além da cor, o odor é bem característico, sendo o odor de defumado bem proeminente. Por ser uma solução ácida, o EPL apresenta pH em torno de 2,3-3,0, e densidade de 1,010 a 1,020 na temperatura de 15ºC, o que também são características de garantia de qualidade do produto (CAMPOS, 2007).
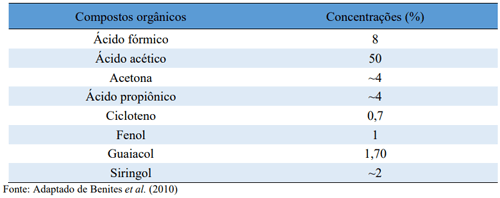
Após a extração, o líquido deve ser mantido em repouso por período superior a 100 dias até que todas as reações de polimerização cessem e seus componentes estejam estabilizados. Este processo é fundamental, pois determina a decantação e posterior eliminação de impurezas e do alcatrão do EPL. Na decantação, o líquido apresenta três camadas distintas (CAMPOS, 2007; MATHEW; ZAKARIA, 2015; MIYASAKA, 2001;) e com diferentes compostos orgânicos (Tabela 2) (BENITES et al., 2010):
1ª – 10%: Predominância de água (80-90%) e óleos vegetais;
2ª – 60 a 75%: Fração ou líquido pirolenhoso;
3ª – 20 a 30%: Alcatrão (fração tóxica).
Tabela 2 - Compostos orgânicos encontrados no EPL e suas respectivas concentrações
É importante salientar, que o tipo de madeira influencia na qualidade do EPL, sendo o indicado para fabricação e as mais utilizadas nas carvoarias brasileiras, o eucalipto, pinus e bambu. Madeiras de mata nativa não são indicadas, uma vez que há espécies consideradas tóxicas, tornando o EPL venenoso e impróprio para uso. Além do tipo de madeira, a temperatura empregada no processo de fabricação também deve ser controlada; temperaturas elevadas podem induzir a produção de compostos bioativos presentes no produto, como os benzopirenos, compostos cancerígenos, encontrado principalmente no alcatrão, interferindo na qualidade do mesmo (MIYASAKA, 2001).
Na nutrição animal, o EPL pode ser utilizado como potencial substituto aos antibióticos, modificando de maneira benéfica a microflora intestinal refletindo no desempenho e eficiência animal. Outra potencial utilização é sobre as excretas, na solução de 1/50, com a finalidade de reduzir mau cheiro e potenciais vetores (MIYASAKA, 2001).
Nunes (2019) ao avaliar o uso de EPL na alimentação de codornas japonesas em postura, constatou que a nível de 0,833% o EPL teve efeito positivo sobre os parâmetros de desempenho e qualidade de ovos. Estudo realizado por Diógenes (2017), avaliou o extrato pirolenhoso na ração de codornas europeias criadas em dois tipos de cama (nova e usada). Aves alojadas nas camas usadas, apresentaram melhoria no ganho de peso, na conversão alimentar e na eficiência produtiva quando comparadas as aves criadas na cama nova. De acordo com a autora a inclusão de até 2,5% de extrato pirolenhoso na ração de codornas europeias de 1 a 42 dias de idade independentemente do tipo de cama foi benéfico para os animais.
Choi et al. (2009) avaliaram o valor nutricional de diferentes níveis (0 a 0,3%) do extrato pirolenhoso em rações de leitões desmamados e observaram aumento linear da digestibilidade da matéria seca, energia bruta e da proteína bruta. Além disso observou-se melhoria do desempenho de leitões. Chu et al. (2013) observaram melhorias na eficiência alimentar, no ganho de peso, na reposta imune e nas populações da microfauna fecal.
Testando outras funcionalidades do EPL, dentre elas o efeito antisséptico, Zhu (2013) em experimento com frangos de corte, frente à desintoxicação da aflatoxina B1, encontrou diferença estatística sobre àqueles que consumiram rações com aflatoxina, comprovando que níveis de inclusão do extrato melhoraram o ganho de peso e conversão alimentar.
2.1 ÁCIDO ACÉTICO
Oficialmente conhecido como ácido etanoico, o ácido acético (CH3CO2H), que pertencente ao grupo químico dos ácidos orgânicos (–COOH) (MENTEN et al., 2014), é o componente de maior concentração no extrato pirolenhoso (EPL) (THEAPPARAT et al., 2014). Entre diversas propriedades atribuídas aos ácidos orgânicos, incluído o ácido acético, uma se destaca, sua atividade antimicrobiana, que está relacionada diretamente com sua capacidade de reduzir o pH do meio. Desta forma, ácidos orgânicos têm sido frequentemente utilizados na conservação de alimentos e na alimentação animal como forma de controle microbiológico (MENTEN et al., 2014).
Considerados na nutrição animal como possíveis alternativas a utilização de antibióticos promotores de crescimento (APC), espera-se que os ácidos orgânicos sejam similarmente eficientes, mas que não estimulem o surgimento da resistência bacteriana (MENTEN et al., 2014). De forma geral, estes aditivos atuam reduzindo pH do trato digestório, o que pode estimular a atividade de enzimas proteolíticas e, consequentemente, melhorar a digestão e absorção de alguns nutrientes. Também são capazes de reduzir a carga de bactérias enteropatogênicas vulneráveis a menores valores de pH, como Salmonella spp., Clostridium spp. e Escherichia coli, melhorando assim o equilíbrio da microbiota intestinal benéfica ao hospedeiro (BERTECHINI, 2012).
Não de hoje, estudos buscam avaliar os efeitos dos ácidos orgânicos sobre a nutrição animal, conservação de alimentos, acidificação do trato digestório e controle de microrganismos (MENTEN et al., 2014). Ostling e Lindgren (1993) estudaram a capacidade de inibição no crescimento de enterobactérias por ácidos orgânicos e verificaram que os ácidos lático, acético e fórmico, quando utilizados em concentrações mínimas inibitórias entre 2-11 mMol, 0,5-14 mMol, 0,1-1,5 mMol, respectivamente, foram capazes de inibir o crescimento desses microrganismos em condições aeróbias e anaeróbias. Entretanto, quando adicionado em rações de frangos de corte contaminadas com Salmonella Enteritidis e Salmonella Typhimurium, o ácido acético não apresentou efeito positivo na eliminação bacteriana, mas influenciou positivamente no consumo de ração e ganho de peso dos animais (REZENDE et al., 2008).
A existência de ambiente ácido no inglúvio é primordial para diminuir a colonização por patógenos. Esses patógenos só conseguem atingir o trato digestivo após passarem pelo inglúvio. Diante disso, é de suma importância a existência de ambiente ácido em parte anterior ao estômago (HINTON et al., 2000).
Rezende et al. (2008) conduziram estudo com cinco diferentes concentrações de ácido acético (0; 0,5%; 1,0%; 1,5%; e 2,0%) em rações contaminadas experimentalmente com Salmonella Enteritidis e Salmonella Typhimurium. Obtiveram resultados positivos para o índice de ganho de peso e melhoria na conversão alimentar para níveis de até 2,0%, sem que houvesse eliminação das salmonelas estudadas.
Bastos-Leite et al. (2016), realizaram estudo sobre o efeito de ácidos orgânicos e de sua associação com óleos essenciais com o objetivo de avaliar o desempenho (peso inicial e final, ganho de peso, consumo acumulado, conversão alimentar) e biometria dos órgãos (peso dos órgãos digestivos e reprodutivos) em frangas. Bonato et al. (2008) demonstraram em seu estudo, que a associação de ácidos orgânicos e extratos vegetais alcançaram efeitos positivos, sobre os parâmetros de desempenho e qualidade de ovos de poedeiras comerciais, porém no isolamento desses compostos, esses parâmetros não sofreram alterações.
2.2 FURFURAL
O furfural (C5H4O2) ou 2-furaldeído caracteriza-se por ser um líquido (solúvel em água) de coloração âmbar e odor forte (PUBCHEM, 2017). Deriva geralmente de pentoses (açucares de cinco carbonos), principalmente xilose e arabinose, contidas na hemicelulose de materiais lignocelulósicos (CHHEDA; ROMÁN-LESHKOV; DUMESIC, 2007). A indústria utiliza os furanos e seus derivados, como o furfural, na produção de conservantes, fungicidas, herbicidas, desinfetantes e agentes terapêuticos (HOYDONCKX et al., 2007).
2.3 FENÓIS E CRESÓIS
Os derivados fenólicos correspondem a segunda maior concentração entre os compostos orgânicos que compõem o extrato pirolenhoso. Representados genericamente pelo fenol, o grupo apresenta grande variedade de substâncias, sendo, no extrato pirolenhoso, a classe de compostos orgânicos com o maior número de substâncias diferentes (THEAPPARAT et al., 2014). O termo fenol pode ser empregado como nome de uma substância específica (hidroxibenzeno) ou como nome para uma família de compostos aromáticos hidróxisubstituídos (MCMURRY, 2005). Derivados do alcatrão de hulha (GIUFFRIDA, 2008), quimicamente, os fenóis apresentam em sua estrutura um ou mais grupos hidroxila (OH) ligados a um anel aromático (Benzênico) (BARBOSA, 2011). Inicialmente, esses compostos foram utilizados como antissépticos em cirurgias. No entanto, após a comprovação de sua toxicidade sobre tecidos corporais, os fenóis passaram a ser empregados principalmente na desinfecção do ambiente, de equipamentos e utensílios (GIUFFRIDA, 2008). De forma geral, os compostos fenólicos atuam sobre o protoplasma bacteriano, causando desnaturação e precipitação de proteínas (PAULINO; RIZZO, 2011). Também podem agir inativando sistemas enzimáticos bacterianos essenciais às células após se ligarem a substâncias importantes da parede celular (GIUFFRIDA, 2008).
Os fenóis tem amplo espectro de ação, exercendo atividade bactericida, principalmente contra bactérias Gram-positivas; fungicida; e viricida, com ação limitada somente aos vírus envelopados (PAULINO; RIZZO, 2011). Os cresóis são substâncias derivadas do fenol (GIUFFRIDA, 2008), e possuem estrutura química primária semelhante ao composto originário (BARBOSA, 2011). Existem três formas de cresol estruturalmente muito semelhantes: ortocresol, metacresol, paracresol (GIUFFRIDA, 2008). Assim como os fenóis, os cresóis penetram na parede celular bacteriana e no citoplasma causam desnaturação e precipitação de proteínas essenciais ao metabolismo do microrganismo (PAULINO; RIZZO, 2011). Os cresóis apresentam ação bactericida, viricida limitada (vírus envelopado) e não esporicida. Quando comparados aos fenóis, esses compostos apresentam maior ação bactericida com menos efeitos adversos (causticidade, toxicidade), o que os tornam desinfetantes mais eficazes (PAULINO; RIZZO, 2011).
2.4 GUAIACOL
Oficialmente conhecido como 2-metoxifenol (IUPAC), o guaiacol (C7H8O2) é um composto fenólico estruturalmente formado por um grupo metoxi. O guaiacol pode ser isolado naturalmente a partir da resina do Guaiaco (Guaiacum officinale) ou sintetizado através da oxidação da lignina. O guaiacol também está presente na fumaça gerada a partir da queima da madeira, sendo produto da pirólise da lignina. Caracteriza-se como uma substância líquida oleosa, aromática e amarelada. O guaiacol é utilizado medicinalmente como expectorante, antisséptico e anestésico local (PUBCHEM, 2017).
3 ANTIBIÓTICOS
Agentes antimicrobianos têm sido empregados na produção animal há mais de 50 anos, com ação terapêutica, melhorando a saúde dos animais ou como melhorador de desempenho, melhorando a produtividade animal (STELLA et al., 2020)
Seu uso tem sido bastante discutido, pois existe muitos pontos positivos e negativos para sua adoção. De acordo com Mota et al. (2005), a utilização indiscriminada e contínua, os antimicrobianos utilizados na terapêutica veterinária podem por pressão seletiva gerar bactérias resistentes na terapêutica humana e por isso há forte campanha para proibir o uso dos antibióticos na alimentação animal. Porém, todas essas alegações precisam ser comprovadas cientificamente (AZEVEDO, 2022).
3.1 ENRAMICINA
Primariamente isolada a partir de caldos fermentados do actinomiceto Streptomyces fungicidicus, a enramicina é um polipeptídio formado de dois componentes principais, a Enramicina A (C107 H138 N26 O31 C12) e a Enramicina B (C106 H140 N26 O31 Cl2) (EL-HUSSEINY; ABDALLAH; ABDEL-LATIF, 2008). Utilizada como antibiótico promotor de crescimento para aves e suínos (PALERMO-NETO; ALMEIDA, 2011), atua inibindo a síntese da parede celular de bactérias gram-positivas causadoras de afecções no trato digestório, como, por exemplo, algumas bactérias dos gêneros Clostridium e Streptococcus ((EL-HUSSEINY; ABDALLAH; ABDEL-LATIF, 2008). A enramicina é altamente estável em pH variando de 3,5 a 7,5 tanto na forma seca como em solução aquosa (INOUE et al., 2010), o que possibilita sua inclusão na alimentação ou na água de bebida dos animais.
Para frangos de corte utiliza-se a enramicina via alimentação (incluída na ração) nas dosagens que variam de 5 a 10 gramas por tonelada (g/ton) nas fases pré-inicial e crescimento e 3 a 5g/ton na fase final (PALERMO-NETO; ALMEIDA, 2011). Estudos avaliaram o efeito de inclusão da enramicina na alimentação de frangos de corte desafiados por infecções com Clostridium perfringens e verificaram melhores resultados de desempenho (ABUDABOS; ALYEMNI, 2013; ABUDABOS; YEHIA, 2013a) e redução da prevalência do agente patogênico (ABUDABOS; YEHIA, 2013b) nos tratamentos contendo o antibiótico. Segundo Wang et al. (2012), a suplementação com enramicina via dieta para frangos de corte influenciou positivamente o desempenho animal, digestibilidade dos nutrientes, controle da microbiota intestinal e morfologia intestinal.
3.2 ENROFLOXACINA
A enrofloxacina é um quimioterápico de ação antibacteriana pertencente ao grupo das fluoroquinolonas, também denominadas quinolonas de segunda geração. Originada na década de 1980, é utilizada exclusivamente no tratamento de afecções de origem bacteriana em animais (GÓRNIAK, 2011). Antimicrobiano de ação bactericida, age inibindo a enzima DNA girase bacteriana, que controla a direção e o espiralamento das cadeias de DNA (ANDRADE; GIUFFRIDA, 2008). Possui boa ação frente a bactérias aeróbias Gram-negativas, como Escherichia coli, Proteus spp., Klebsiella pneumoniae, Salmonella spp. e Enterobacter spp. (PAES, 2012), tendo entre seus principais usos na medicina veterinária o combate a gastroenterites graves de origem bacteriana (GÓRNIAK, 2011).
No uso terapêutico contra salmoneloses, estafilococose, celulite e outras infecções causadas por patógenos Gram-negativos suscetíveis em aves, indica-se a dose de 20 a 40 miligramas por quilo (mg/Kg) via água de bebida ou ração (ITO et al., 2005).
Em estudos da Secretaria da Saúde do Estado do Paraná sobre a comercialização de medicamentos veterinários para frangos de corte revelou que a enrofloxacina esteve entre os quimioterápicos antimicrobianos mais utilizados terapêutica e preventivamente, sendo, nesse último caso, empregado inadequadamente como um promotor de crescimento. Além do risco de desenvolvimento da resistência bacteriana associado ao uso indiscriminado do antibiótico, nada ainda se sabe sobre seu efeito no desempenho de frangos de corte. Desta forma, a enrofloxacina não se encaixa entre os antimicrobianos promotores de crescimento utilizados como aditivos na produção avícola (GÓRNIAK, 2011).
3.3 HALQUINOL
O halquinol (cloridroxiquinolina) resulta da cloração controlada da 8-hidroxiquinolina, consistindo na mistura de 5-monocloro-8-hidroxiquinolina (34, 27%), 5,7-dicloro-8- hidroxiquinolina (64,22%) e 7-monocloro-8-hidroxiquinolina (2,24%) (KAUL; LEWIS, 1965). Considerado um agente antimicrobiano não antibiótico, o Halquinol exerce atividade contra grande variedade de bactérias Gram-positivas e Gram-negativas, fungos e alguns protozoários causadores de enfermidades em aves e suínos. O halquinol funciona como droga de ação quelante, capaz de combinar-se ao grupo metálico de enzimas presentes na membrana citoplasmática, causando a destruição de bactérias e fungos pela supressão do processo de respiração celular nesses microrganismos. Pesquisas avaliando a utilização do halquinol separadamente ou em conjunto a outros aditivos promotores de crescimento em frangos de corte demonstraram melhores resultados sobre varáveis relacionadas ao desempenho (p< 0,05) nos tratamentos contendo algum nível de halquinol (FOMENTINI et al., 2016; NUNES et al., 2012).
4 PROBIÓTICOS
Como alternativa para o uso de antibióticos tem-se os probióticos. Sua forma de ação ocorre após sua colonização e multiplicação no trato gastrointestinal por exclusão competitiva; redução de pH do meio, devido a produção de ácidos com o seu metabolismo; e produção de metabólitos que atuam inibindo bactérias enteropatogênico ou mesmo a produção de peróxido de hidrogênio que inibe vários microrganismos (BERTECHINI, 2012).
Probiótico como suplemento alimentar que afeta de forma benéfica o animal hospedeiro, melhorando o equilíbrio microbiano intestinal. A presença desses probióticos, produzem enzimas que auxiliam na digestão pelo hospedeiro, além de fornecer barreira contra patógenos invasores. A alimentação de bactérias se torna uma alternativa à utilização de antibióticos uma vez que a competição em que os microrganismos benéficos são favorecidos é importante, pois o desequilíbrio em favor de bactérias indesejáveis pode resultar em infecção intestinal, o que comprometeria a digestibilidade da ração (ARAÚJO et al., 2007).
Para melhorar a eficiência, sugerem a utilização dos probióticos nos primeiros dias de vida, para que ocorra a exclusão competitiva, beneficiando assim um bom equilíbrio entre os microrganismos benéficos (LORENÇON et al., 2007).
5 PREBIÓTICOS
Prebióticos são produtos utilizado na alimentação animal que não são digeridos por enzimas normais no trato digestório e que atuam estimulando seletivamente o crescimento e/ou atividade de bactérias benéficas no intestino que têm, por ação final, melhorar a saúde do hospedeiro (AZEVEDO, 2022).
De acordo com Bertechini (2012), os prebióticos não são digeridos no trato gastrointestinal por falta de enzimas endógenas específicas, sendo seu modo de ação direcionada para determinadas cepas de microrganismo que utilizam estas substâncias como substratos.
Geralmente são extraídos de leveduras e células de plantas. Resultando assim, o favorecimento dos microrganismos benéfico ao animal gerando o equilíbrio da microbiota intestinal. O uso dos prebióticos como alternativa para eliminar a resistência bacteriana nos produtos avícolas tem sido crescente. Cada vez mais esses produtos são utilizados para melhorar a imagem dos produtos diante ao mercado consumidor (ALBINO et al., 2006).
6 ÓLEOS FUNCIONAIS
Os oléos funcionais são considerados alternativas a compostos sintéticos (PEARCE; JIN, 2010). De acordo com a espécie, apresentam diferentes funções como vermífugo, antitérmico, anti inflamatório, inseticida, anti-séptica, atividade antioxidante e antibacteriana. Com isso, promove melhoria na digestibilidade, absorção de nutrientes e na resposta imune. Além de aumentar a palatabilidade da ração e melhora da fauna intestinal (ALMEIDA, 2012).
A atividade desses óleos está relacionado a presença de compostos fenólicos, terpenóides, ésteres, cetonas, álcoois, e flavonóides que impendem a propagação do processo oxidativo (TRAESEL et al., 2011) podendo assim melhorar desempenho de frango de corte.
7 CONSIDERAÇÕES FINAIS
Existem muitos aditivos no mercado, cada um atendendo necessidades específicas e que devem ser analisados a eficiência do produto, a relação custo benefício e o mercado consumidor.
Com a busca de produtos isentos de antibiótico melhorador de desempenho na produção animal, o mercado tem utilizado produtos alternativos de forma cada vez maior, com resultados bastantes promissores. Dentre estes produtos o extrato pirolenhoso tem surgido com grandes perspectivas de utilização, devido aos resultados apresentados.
Publicado originalmente na revista Tópicos Especiais em Ciência Animal XI, 1ª edição, em dezembro de 2022. ISBN: 978-65-86981-36-0.