Modificações Post- Mortem
1- Glicogênio
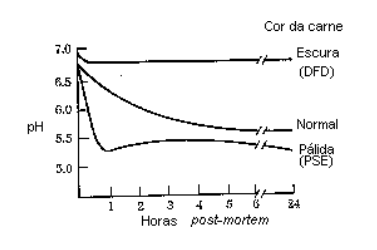
2- Glicólise e queda do pH
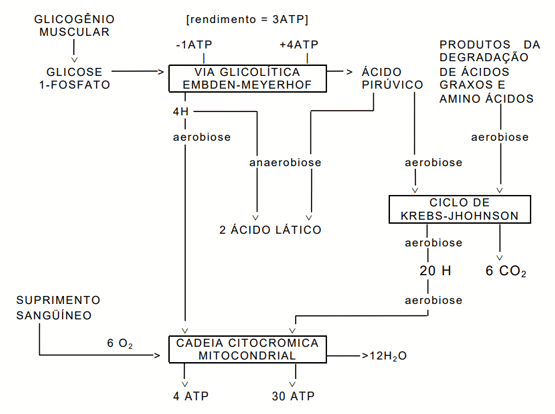
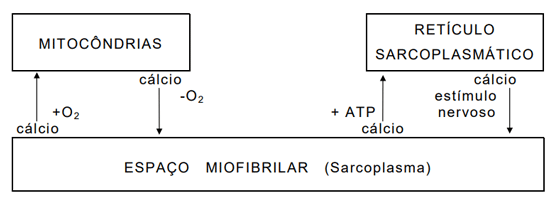
3- Modificações estruturais
![Figura 2 - Esquema das modificações da estrutura muscular post-mortem : [A] - repouso (imediatamente após a morte); [B] - contração, e, [C] - rigor mortis (HAMM, 1982).](/_next/image/?url=https%3A%2F%2Fimages.engormix.com%2FP_articles%2F52943_162.gif&w=1200&q=75)
4- Maturação
5- Fatores que afetam as modificações post-mortem
ASGHAR, A., PEARSON, A.M. Influence of ante and postmortem treatments upon muscle composition and meat quality. Adv. Food Res., San Diego, v.26, p.53-213, 1980.
BACILA, M. Bioquímica veterinária. São Paulo: J.M. Varela, 1980. 534p.
BÄCKSTRÖM, L. KAUFFMAN,R. The porcine Stress syndrome: a review of genetics, environmental factors, and animal weel-being implications. Agri-practice, v. 16, n.8, p.24-30, 1995.
BARTOS, L., FRANC, C., ALBISTON, G., et al. Prevention of dark-cutting (DFD) beef in penned bulls at the abattoir. Meat Sci., Barking, v.22, n.3, p.213-220, 1988.
BENDALL, J.R. El estímulo elétrico de las canales de los animales de abasto. In: LAWRIE, R., ed., Advances de la ciencia de la carne. Zaragoza: Acribia, 1984. p.57-83. BENNET, T.P., FRIEDEN, E. Tópicos modernos de bioquímica. São Paulo: Ed. Edgard Blucher, 1975. 175p.
BROWN, S.N., BEVIS, E.A., WARRISS, P.D. A estimate of the incidence of dark cutting beef in the United Kingdon. Meat Sci., Barking, v.27, n.3, p.249-258, 1990.
BRUAS, F., BRUN-BELLUT, J., LAROPPE, R. Etude des variations du pH de viande de taurillons abattus en Lorraine. Viandes et Prod. Carnes, v.11, p.273-275, 1990.
CORNFORTH, D.P., PEARSON, A.M., MERKEL, R.A. Relationship of mitochondria and sarcoplasmic reticulum to cold shortening. Meat Sci., Barking, v.4, n.2, p.103-121, 1980.
CUTHBERTSON, A. Procesado en caliente de la carne: revisión de sus razones e implicaciones económicas. In:LAWRIE, R., ed., Advances de la ciencia de la carne. Zaragoza: Acribia, 1984. p.84-118.
DALRYMPLE, R.G., HAMM, R. Effect of diphosphate (pyrophosphate) on postmortem glycolysis in bovine muscle. J. Food Sci., Chicago, v.39, p.1218-1220, 1974.
DALRYMPLE, R.H., HAMM, R. Postmortem glycolisis in pre rigor ground bovine and rabbit muscle. J. Food Sci., Chicago, v.40, n.4, p.850-853, 1975.
DAVEY, C.L., GILBERT, K.V. Cold shortening capacity and beef muscle growth. J. Sci. Food Agric., London, v.26, n.6, p.755-760, 1975.
DAVEY C.L., GILBERT, K.V. Cold shortening and cooling changes in beef. J. Sci. Food Agric., London, v.26, n.6, p.761-767, 1975.
DAVEY, C.L., GILBERT, K.V. The mechanism of cold-induced shortening in beef muscle. J. Food Technol., Chicago, v.9, n.1, p.51-58, 1978.
DREILING, C.E., BROWN, D.E., CASALE, L., et al. Muscle glycogen: comparison of iodine binding and enzyme digestion assays and application to meat samples. Meat Sci., Barking, v.20, n.3, p.167-177, 1987.
SEYDI, M. FAYE, J.E. pH et rigidite cadaverique des carcasses de bovins soudano-saheliens. Viandes et Prod. Carnes, v.11, p.275-276, 1990.
FIELD, R.A. Mecanically deboned red meat. Adv. Food Res., San Diego, v.27, p.23-107, 1981.
FORREST, J.C., ABERLE, E.D., HEDRICK, H.B., et al. Funda mentos de ciência de la carne. Zaragoza: Acribia, 1979, 364p.
GIL, M., HORTÓS, M., SÁRRAGA, C. Calpain and cathepsin acrivities, and protein extractability during agein of longissimus porcine muscle from normal and PSE meat. Food Chemistry, v.63, n.3, p.385-390, 1998.
HAMM, R. Biochemistry of meat hydration. Adv. Food Res., San Diego, v.10, p.356-463, 1960.
HAMM, R. Postmortem breakdown of ATP and glycogen in ground muscle: a review. Meat Sci., Barking, v.1, n.1, p.15-39, 1977.
HAMM, R. Postmortem changes in muscle with regard to processing of hot-boned beef. Food Technol., Chicago, v.36, n.11, p.105-115, 1982.
HAMM, R., HONIKEL, K.O., FISCHER, C., et al. Modificaciones en la carne vacuna luego de la faena e sus concecuencias sobre la capacidad de retención de água. Fleischwirtsch., espan·l, Frankfurt, v.1, p.42-8, 1983.
HOFMANN, K. El pH: una característica de calidad de la carne. Fleischwirtsch., espan·l, Frankfurt, v.1, p.13-18, 1988.
HONIKEL, K.O., HAMID, A., FISCHER, C., et al. Influence of postmortem changes in bovine muscle on the waterholding capacity of beef. Postmortem storage of muscle at various temperatures between 0 and 30oC. J. Food Sci., Chicago, v.46, n.1, p.23-25, 1981.
HONIKEL, K.O., HAMM, R. Uber die ursachen der abnahme des pH-wertes immm fleisch nach dem schlachaten. Fleischwirtsch., Frankfurt, v.54, n.3, p.557-560, 1974.
HONIKEL, K.O., HAMM, R. Influence of cooling and freezing of minced prerigor muscle on the breakdown of ATP and glycogen. Meat Sci., Barking, v.2, n.3, p.181-188, 1978.
HONIKEL, K.O., HAMM, R. La influencia del refrigerado sobre las cualidades de la carne vacuna reciém faenada. Fleischwirtsch., espan·l, Frankfurt, v.2, p.16-24, 1980.
HONIKEL, K.O., HAMM, R. Enfriado, congelado y descongelado. Aspectos coloidoquímicos de la calidad de la carne. Fleischwirtsch., espan·l, Frankfurt, v.1, p.46-53, 1985.
HONIKEL, K.O., FISCHER, C., HAMID, A., et al. Influence of postmortem changes in bovine muscle on the water holding capacity of beef. Postmortem storage of muscle at 20oC. J. Food Sci., Chicago, v.46, n.1, p.1-6, 1981.
HONIKEL, K.O., RONCALÉS, P., HAMM, R. The influence of temperature on shortening and rigor onset in beef muscle. Meat Sci., Barking, v.8, n.3, p.221-241, 1983.
IZUMI, K., ITO, T. FUKAZAWA, T. Effects of pH, calcium ions and ATP on rigor contraction in glycerinated rabbit psoas muscle fiber. J. Food Sci., Chicago, v.43, n.4, p.1188-1190, 1978.
JEACOCKE, R.E. The temperature dependence of anaerobic glycolisis in beef muscle held in a linear temperature gradient. J. Sci. Food Agric., London, v.28, n.6, p.551-556, 1977.
JOLLEY, P.D., HONIKEL, K.O., HAMM, R. Influence of temperature on the rate of postmortem metabolism and water holding capacity of bovine neck muscle. Meat Sci., Barking, v.5, n.1, p.99-107, 1981.
KATSARAS, K., PEETZ, P. Cambios morfologicos en el "dark cutting beef" originados por el tratamiento térmico. Fleischwirtsch., espan·l, Frankfurt, v.2, p.58-60, 1990.
KOLB, E. Fisiologia veterinária. 4 ed. Rio de Janeiro: Ed. Guanabara Koogan, 1980. 612p.
KOOHMARAIE, M. Role ofthe neutral proteinases in postmortem muscle protein degradation and meat tenderness. Reciprocal Meat Conference Proceedings, Americam Meat Science Association, v. 45, p.63-71, 1992a.
KOOHMARAIE, M. The role of Ca2++- proteases (calpains) in post-mortem proteolysis and meat tenderness. Biochimie, Paris, v.74, p.239-245, 1992b.
KOOHMARAIE, M., CROUSE, J.D., MERSMANN, H.J. Acceleration of postmortem tenderization in ovine carcasses through infusion of calcium chloride: Effect of concentration and ionic strength. J. Anim. Sci., Champaign, v.67, p.934- 942, 1989.
KOOHMARAIE, M., WHIPPLE, G., CROUSE, J.D. Acceleration of postmortem tenderization in lamb and brahmancross beef carcasses through infusion of calcium chloride. J. Anim. Sci., Champaign, v.68, p.1278-1283, 1990.
KUBOTA, E.H., OLIVO, R., SHIMOKOMAKI, M. Maturação da carne - um processo enzimático. Revista Nacional da Carne, São Paulo, v.18, n.200, p.12-14, 1993.
LOCKER, R.H. Carne de cordero curada. In: LAWRIE, R. Avances de la ciencia de la carne. Zaragoza: Acribia, 1984. cap. 7, p.223-239.
LOCKER, R.H., DAVEY, C.L., NOTTINGHAM, P.M., et al. New concepts in meat processing. Adv. Food Res., v.21, p. 157-222, 1975.
LOCKER, R.H., DAINES, G.J. Rigor mortis in beef sternomandibularis muscle at 37oC. J. Sci. Food Agric., London, v.26, n.11, p.1721-1733, 1975.
LUNDBERG, P., VOGEL, H.J. Postmortem metabolism in fresh porcine, ovine and frozen bovine muscle. Meat Sci., Barking, v.19, n.1, p.1-14, 1987.
NEWTON, K.G., GILL, C.O. The microbiology of DFD fresh meats: a review. Meat Sci., Barking, v.5, n.3, p.223-232, 1981.
PENNY, I.F. Enzimologia de la maturation. In: LAWRIE, R., ed. Avances de la ciência de la carne. Zaragoza: Acribia, 1984. p.148-181.
PRICE, J.F., SCHWEIGERT, B.S. Ciência de la carne y de los productos cárnicos. Zaragoza: Acribia, 1976. 668p.
ROÇA, R.O. Tecnologia da carne e produtos derivados. Botucatu: Faculdade de Ciências Agronômicas, UNESP, 2000. 202p.
ROÇA, R.O. Influência do banho de aspersão ante-mortem em parâmetros bioquímicos e microbianos da carne bovina. Campinas:F.E.A./UNICAMP, 1993. 185p. Tese (Doutorado em Engenharia de Alimentos, Área de Tecnologia de Alimentos) - Faculdade de Engenharia de Alimentos - Universidade Estadual de Campinas.
ROÇA, R.O., BONASSI, I.A. Alguns aspectos sobre alterações post-mortem, armazenamento e embalagens de carnes. In: CEREDA, M.P., SANCHEZ, L., coord. Manual de Armazenamento e Embalagens - Produtos Agropecuários. Piracicaba: Livro Ceres Ltda., 1983. cap.7, p.129-152.
ROÇA, R.O. Alternativas do aproveitamento da carne ovina. Rev. Nacional da Carne., v.18, n.201, p.53-60, 1993.
ROÇA, R.O., SERRANO, A.M. Abate de bovinos: conversão do músculo em carne. Higiene Alimentar, São Paulo, v. 8, n.33, p.7-12, 1994. Revista Nacional da Carne, São Paulo, v.19, n.212, p.87-94, 1994.
ROÇA, R.O., SERRANO, A.M., Influência do banho de aspersão ante-mortem em parâmetros bioquímicos e na eficiência da sangria da carne bovina. Pesq. Agrop. Bras., Brasília, v.30, n.8, p.1107-1115, 1995.
RONCALÉS, P., BELTR°N, J.A., JAIME, I., et al. A simple method for following postmortem ATP depletion in lamb muscle. J. Food Sci., Chicago, v.54, n.5, p.1365-1366, 1989.
FERNANDEZ, X., FORSLID, A., MAGARD, M. et al. Effect of time between adrenaline injection and slaughter on the rate and extend of post-mortem metabolism in porcine skeletal muscle. Meat Sci., Barking, v.31, n.287-298, 1992.
SEUβ, I., MARTIN, M. The influence of marinating with foods acids on the composition and sensory properties of beef. Fleischwitsch., Frankfurter, v. 73, n.3, p.292-295, 1993.
SWATLAND, H.J. Low temperature activation of postmortem glycogenolysis in bovine skeletal muscle fibres. Histochem. J., London, v.11, p.391-398, 1979.
TARRANT, P.V. The effect of hot-bonning on glycolysis in beef muscle. J. Sci. Food Agric., London, v.28, p.927-930, 1977.
TARRANT, P.V., McVEIGH, J.M. The effect of skeletal muscle needle biopsy on blood constituents, muscle glycogen and heart rate of cattle. Res. Vet. Sci., London, v.27, n.3, p.325-328, 1979.
TARRANT, P.V., MOTHERSILL, C. Glycolisis and associated changes in beef carcasses. J. Sci. Food Agric., London, v.28, n.8, p.739-749, 1977.
TARRANT, P.V., SHERINGTON, J. An investigation of ultimate pH in the muscle of commercial beef carcasses. Meat Sci., Barking, v.4, n.4, p.287-297, 1980.
WEBER, A. Computerized diffractometer for measurements of sarcomere lengths in meats: an evaluation of dat reduction methods. Meat Sci., Barking, v.27, n.3, p.259-271, 1990.
WHEELER, T.L., CROUSE, J.D., KOOHMARAIE, M. The effect of postmortem time of injection and freezing on the effectiveness of calcium chloride for improving beef terderness. J. Anim. Sci., Champaign, v.70, p.3451-3457, 1992.
WHEELER, T.L., KOOHMARAIE, M., CROUSE, J.D. Effect of calcium chloride injection and hot boning on the tenderness of round muscles. J. Anim. Sci., Champaign, v.70, p.4871-4875, 1991.
WHEELER, T.L., KOOHMARAIE, M., LANSDELL, J.L. et al. Effects of postmortem injection time, injection level and concentration of calcium chloride on beef quality traits. 1993. (no prelo)
WHIPPLE, G., KOOHMARAIE, M. Freezing and calcium chloride marination effects on beef tenderness and calpastatin activity. J. Anim. Sci., Champaign, v.70, p.3081-3085, 1992.
WHIPPLE, G., KOOHMARAIE, M. Calcium chloride marination effects on beef steak tenderness and calpain proteolytic activity. Meat Sci., Barking, v.33, p.265-275, 1993.
WIRTH, F. El pH y la elaboración de productos cárnicos. Fleischwirtsch., espanõl, Frankfurt, v.2, p.24-33, 1980.
WIRTH, F. Tecnología para la transformación de carne de calidad anormal. Fleischwirtsch., espanõl, Frankfurt, v.1, p.22-8, 1987.
WOLTERSDORF, W. Do quick methods of chilling cause faults in meat? Fleischwirtsch., Frankfurt, v.68, v.7, p.866- 868, 1988.
YOUNG, O.A., HUMPHREY, S.M., WILD, D.J.C. Effects of sugar on postmortem glycolisis in bovine muscle mince. Meat Sci., Barking, v.23, n.3, p.211-225, 1988.
ZEROUALA, A.C., STICKLAND, N.C. Cattle at risk for dark-cutting beef have a higher proportion of oxidative muscle fibres. Meat Sci., Barking, v.29, n.3, p.263-270, 1991.

