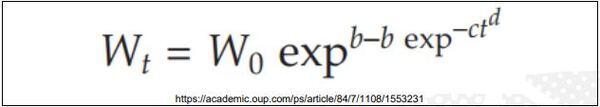Se há um legado do período pré-computacional é a utilização e domínio dos modelos lineares. Um exemplo clássico do uso desses recursos é do pesquisador Huxley (Figura 1), que de forma brilhante fez o de melhor diante das condições escassas (ferramentas) que dispunha em sua época, ao viabilizar as análises alométricas (LINDSEY, 2001; PACKARD, 2012, 2017ab).
Figura 1. Julian Sorell Huxley (1887-1975).
Entretanto, em face aos progressos da computação e dos pacotes estatísticos, o modelo não linear passa a oferecer muito mais vantagens científicas (LINDSEY, 2001).
Diante disso, com as mudanças e avanços na genética, nutrição, sanidade e ambiência e manejo do frango de corte (e outras espécies para fins comerciais), as funções lineares e de maior grau não seriam atualmente recomendadas para predizer modelos de rendimentos, razão de se adotar, atualmente, modelos não lineares, que apresentam mais robustez biológica para aferir crescimento (NARINÇ et al., 2017).
Assim, um dos objetivos da presente pesquisa foi definir parâmetros de curvas não lineares, que possam predizer pesos de diferentes partes da carcaça de frangos de corte, com máxima acurácia, pela planilha livre PPM (https://sites.google.com/site/programapraticodemodelagem/).
Modelos não lineares
Vários são os modelos candidatos não lineares. Temos os modelos em “S” (Ex: Gompertz, Weibull, Lopez, von Bertanlaff, Logistico e Richards), os de retorno decrescente (Lopez, Monomolecular e Log linear), e ainda a função de potência que se destina a avaliar proporções ao longo da ontogenia da espécie em estudo (ARCHONTOULIS et al., 2015).
Nesse sentido foi necessário incorporar na planilha PPM as funções alométricas de dois e três parâmetros, e estimar os mesmos de forma direta, não necessitando a linearização dos dados via log. Lembrando que esse foi o caminho adotado por Huxley em 1932, por não dispor obviamente de planilhas eletrônicas em sua época (PACKARD, 2017ab).
Dos modelos anteriormente citados temos algumas ressalvas para o modelo de Gompertz tradicional:
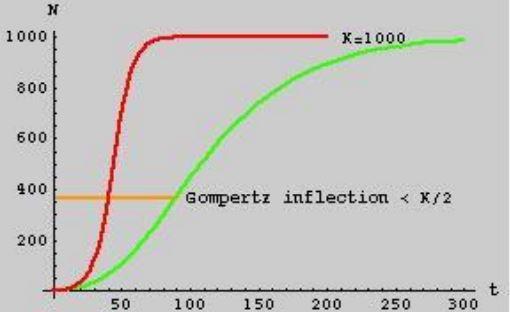
1- Ponto de inflexão fixo (Figura 2):
Figura 2. Ponto de inflexão fixo do modelo de Gompertz tradicional.
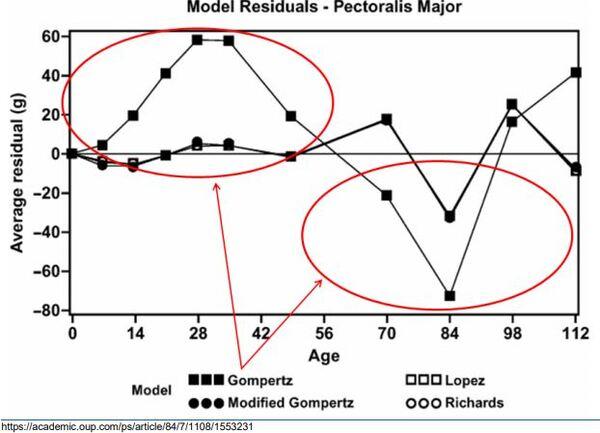
2- Elevada incidência de autocorrelação, devido exatamente seu ponto de inflexão fixo (LOPEZ et al., 2000). Tal influência interfere nas estimativas das partes da carcaça, que passam a ser subestimadas em idades precoces e superestimadas em idades tardias (Figura 3).
Figura 3. Influência das estimativas em partes da carcaça.
Desta forma, temos adotado preferencialmente o modelo de Richards, mas não descartamos usar o modelo de Gompertz modificado (ponto de inflexão livre) em futuras pesquisas (ZUIDHOF, 2005; TJORVE & TJORVE, 2017) (Figura 4).
Figura 4. Modelo de Gompertz modificado (ponto de inflexão livre).
Assim, para dar suporte em decisões de melhoramento genético, nutricional, ambiental, manejo e sanidade, descrições matemáticas são muito oportunas para entender as proporções de partes e seus rendimentos ao longo de sua ontogenia.
Ontogenia e Alometria
A ontogenia é complementada pelas análises alométricas (alometria significa “medida diferente”), que estuda as proporções dos organismos em relação ao seu tamanho.
Portanto, para avaliar a grandeza do corpo em relação à dimensão das partes, independente da idade, nada melhor do que a função (modelo) de potência.
Novamente é necessário alertar que há duas opções:
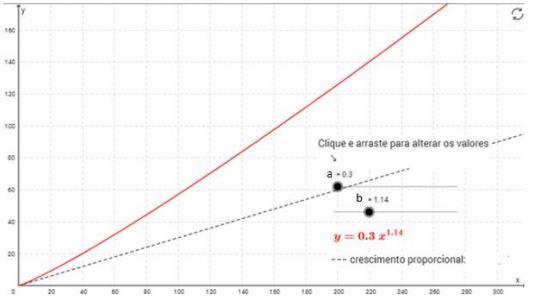
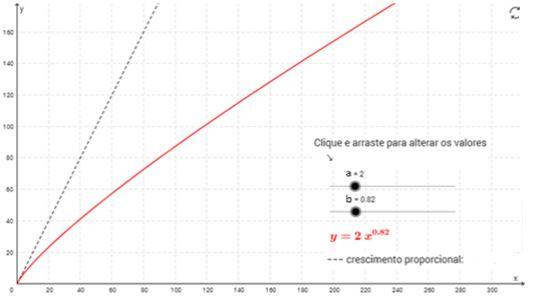
A primeira opção (Y= aXb ) foi utilizada por Huxley em função das limitações de sua época, mas o mesmo pesquisador indicava ser mais prudente utilizar a segunda opção (Y = y0 + aXb ) (PACKARD, 2013).
A razão é muito simples e coincide com o problema do modelo de Gompertz. A função potência com dois parâmetros apresenta um ponto fixo, o qual exige que o início da função passe inevitavelmente pela origem (zero).
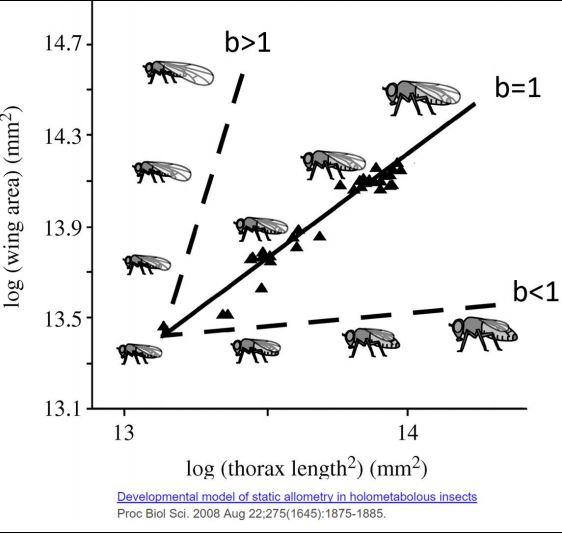
Podemos definir relação alométrica positiva ou hiperalometria (b>1), quando a parte cresce mais rápido do que o corpo. Entretanto, a relação alométrica negativa ou hipoalometria (b<1) ocorre quando a parte cresce a uma menor velocidade em relação ao corpo (SHINGLETON et al. 2008) (Figura 5). Portanto, o parâmetro alométrico “b” possibilita aferir a proporção de crescimento entre parte e o corpo, ou seja, a dinâmica do crescimento de forma não linear, e principalmente, sem a necessidade da relação linear na escala log (PACKARD, 2013).
Figura 5. Alometria positiva ou hiperalometria (b>1), alometria negativa ou hipoalometria (b<1) e isometria (b=1).
Essa prerrogativa da função Y= aXb ter seu intercepto em zero pode impedir que o parâmetro b seja corretamente determinado. Devido a esse fato, adotamos a função potência com três parâmetros (inviável de ser calculado via log), que oferece um início não fixo em “zero”, e acomoda melhor a função, sendo comprovado pelo melhor ajuste (R2 ) (PACKARD, 2017ab).
Há situações em que as funções potência (2 e 3 parâmetros) se tornam idênticas, e isso ocorre quando o y0 = “zero” (Y = 0 + aXb ). Mesmo assim, a função potência de três parâmetros é a mais recomendada, por assumir explicitamente que o intercepto não tem que ser necessariamente o zero (PACKARD, 2017ab). Portanto, não tendo que passar obrigatoriamente pela origem (Figura 6).
Figura 6. Alometria convencional apresenta explícito intercepto no zero.
Em virtude disso, temos novas ferramentas não lineares que permitem detalhar e simular o crescimento de frangos, permitindo aplicação em modelos econômicos e nutricionais com otimização do processo (PESTI & ALHOTAN, 2014).
Assim sendo, as curvas S são indicadas para caracterizar o crescimento sigmoide claramente evidenciado para o corpo e suas partes em relação à idade. Em outras espécies (bovinos e peixes) as curvas exponenciais de decréscimo podem ser mais apropriadas (ARCHONTOULIS & MIGUEZ, 2005).
Entretanto, a função de potência que em um primeiro momento, pessoalmente, julgava ser sua aparente fraqueza, agora se mostra como sua maior virtude: estimar o tamanho da parte em relação ao corpo, independentemente da idade. Tal condição justifica plenamente sua finalidade, ou seja, o modelo é robusto e prático (ZUIDHOF, 2005).
A curva S sofre pressões que achatam mais e mais sua curvatura. Caso não sofresse esse estresse, a curva seria um J. Mas há desbalanceamentos nutricionais, ambientais e de manejo, e até genéticos que “rebaixam” a curvatura do “S” (Figura 7).
Figura 7. Curva S sofre pressões que achatam mais e mais sua curvatura.
Além disso, o potencial ideal ou máximo da velocidade de crescimento ontogênico da ave somente será atingido em lotes de frangos de corte submetidos a perfeitas condições nutricionais, sanitárias, ambientais e de manejo. Desta forma, em condições comerciais, que resultam nos reais desafios e nas maiores pressões, deformam a curva S, não permitindo aflorar todo o potencial genético da ave aferido nas condições ideais (GOUS et al., 1999). Essa é a razão pela qual o modelo de crescimento permite calcular os requisitos nutricionais e ambientais para o máximo crescimento (quando tudo for favorável), mas também ele pode ajustar à realidade, acomodando aos desvios impostos pelas várias pressões desfavoráveis, nas quais os lotes são submetidos diariamente (GOUS, 1998).
Conhecendo a ação das forças contrárias ao crescimento, e que elas são responsáveis por achatar a curva “S” mais e mais, o tempo não seria o item mais apropriado para avaliar essas interferências em relação ao crescimento das partes em relação ao corpo.
Em termos mais práticos, animais mais precoces (em idade) ou tardios pelas pressões de uma desfavorável nutrição, manejo ou sanidade, o peso do corpo deveria ser igualado em diferentes momentos (dias), mas as partes desse corpo seriam mantidas constantes. Resumindo, uma vez que o modelo de potência não depende da idade, aflora a grande virtude de estimar o tamanho das partes em relação ao tamanho corpo todo.
Em relação as funções de potência de dois ou três parâmetros, o b=1 indica que a relação entre o tamanho do corpo do organismo e o tamanho da parte avaliada apresentam uma relação constante. Em outras palavras, todos os componentes do organismo crescem no mesmo ritmo para manter a forma (Figura 8). O parâmetro “a” serve como um fator de escala que movimenta o “conjunto” Xb para cima (aumento) ou para baixo (decréscimo). (
http://wmueller.com/precalculus/families/1_41.html).
Pode-se comprovar isso diretamente pela própria fórmula, com b=1. Devido a isso, o crescimento torna-se isogônico ou isométrico, indicando que o desenvolvimento da parte e do corpo apresentam taxas de crescimento semelhantes.
Para facilitar nosso exemplo vamos supor que y0 = 0, teríamos então
Assim sendo, o órgão ou parte do organismo sempre representaria 42% do tamanho do corpo em qualquer momento da trajetória do crescimento do organismo, entendido esse período do nascimento até sua maturidade (ontogenia). Disso a beleza do parâmetro b curvar o modelo para cima ou para baixo (Figura 9).
Desta forma, o valor de b>1 indica que a parte do órgão aumenta seu tamanho em uma velocidade maior do que o próprio tamanho do corpo do organismo.
Entretanto, b<1 demonstra que a parte contribui cada vez menos com o total do aumento de peso do corpo.
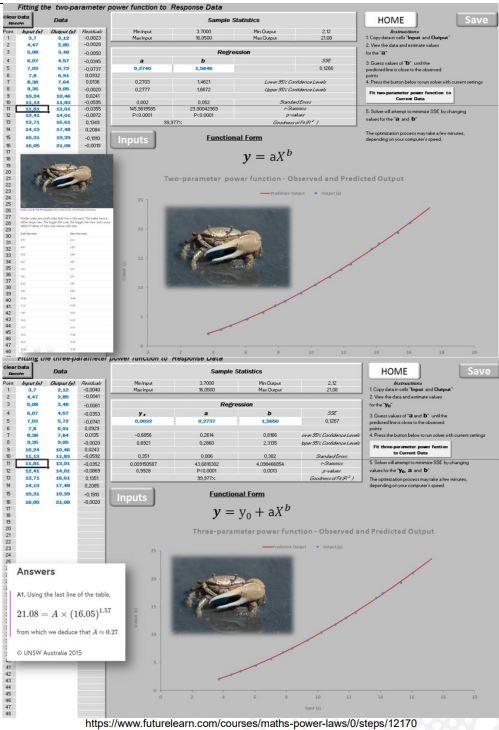
Exemplo 1 – Tamanho do corpo vs tamanho da quela de caranguejo
A pinça preensora (quela) de caranguejos, é outro exemplo clássico de estudo entre tamanho e forma, conforme diferentes estádios de desenvolvimento do corpo (MASUNARI & DISSENHA, 2005; PACKARD, 2012) (Figuras 10 e 11).
Figura 10. Tamanho do corpo vs tamanho da quela em diferentes estádios do desenvolvimento.
Decerto os machos por apresentarem o valor de b=1,565 caracteriza a pinça (quela) hipertrofiada (alometria positiva), a qual desempenha as seguintes finalidades: captura de alimento, duelo com outros machos, exibir-se às fêmeas para demonstrar suas acentuadas qualidades e para defesa de seu território (MASUNARI & DISSENHA, 2005).
Exemplo 2 – Frango de corte: carcaça vs partes
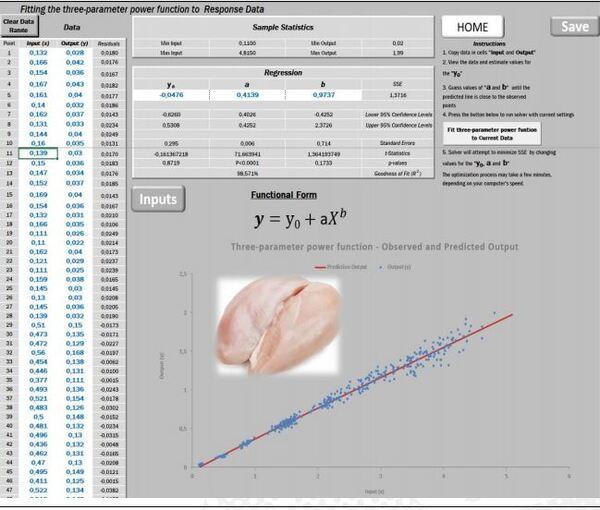
Nosso segundo exemplo inicia com a predição da proporção de peito em relação à carcaça, que é de importância primária economicamente (ZUIDHOF, 2005).
Geralmente é previsto que o peito dos frangos, tanto de machos como de fêmeas, se eleve percentualmente em relação ao peso da carcaça, no momento em que a ave se torna mais pesada ao avançar a idade. Assim, a expectativa é obter um valor de b≈1, indicando que esse músculo aumenta a uma velocidade muito próxima da taxa de crescimento da própria carcaça. No presente experimento, os machos apresentam o b=0,9737 (Figura 12).
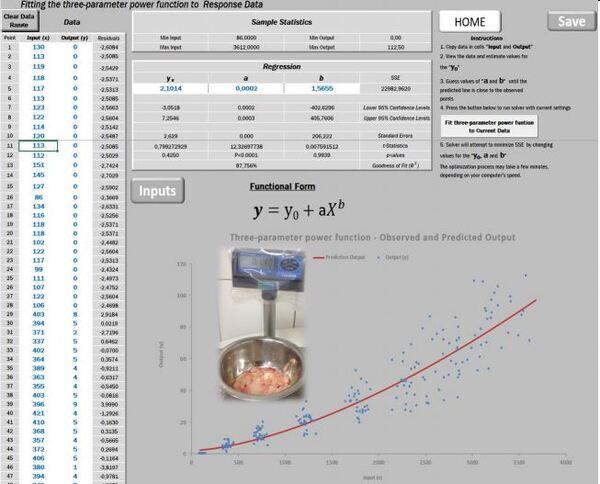
Espera-se o maior valor para o coeficiente alométrico b, quanto expectativas, para a gordura cavitária, principalmente para fêmeas que apresentaram um b=1,5655 (Figura 13).
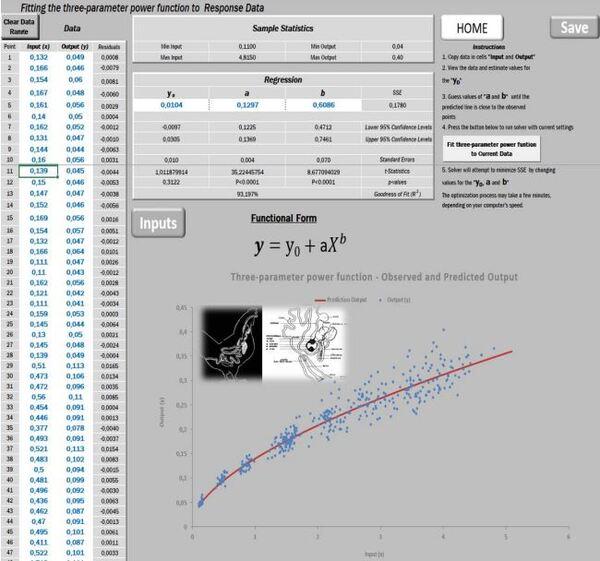
O intestino é um caso muito curioso. O valor de b=0,6086 mostra que sua maturação é muito precoce em relação ao contínuo aumento do peso do corpo (Figura 14).
Em ontogenia a idade está estreitamente relacionada com peso e vice-versa, ou seja, ao avançar a idade as aves tornam-se mais pesadas. Essas duas independentes variáveis são altamente correlacionadas (GOLIOMYTIS et al., 2003).
É muito bem evidenciado pela literatura diferentes graus de maturidades (assíntota) das partes em função da idade. Vísceras, asas, cabeça, pés são precoces. Entretanto, o peito e gordura apresentam suas assíntotas mais tardias (ZUIDHOF, 2005).
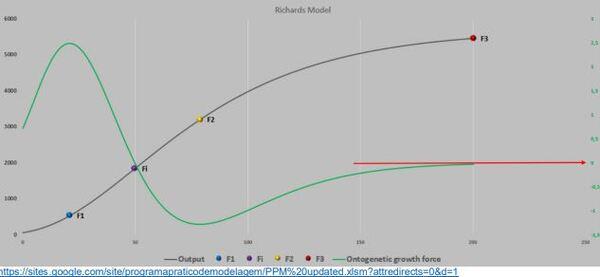
Em relação aos intestinos, que apresentam seu platô prematuramente, e em certo sentido “freia” o crescimento do animal. Desta forma alerta o corpo que o limite será para atender e manter a massa já sintetizada, não permitindo novas incorporações (nova biomassa) (MCNURLAN & GARLICK, 1980; CANT et al. 1996; ZIDHOF, 2005), razão da força ontogênica do crescimento ser zerada na maturidade do animal (Figura 15).
Figura 15. Força ontogênica do crescimento de frangos de corte.
A modelagem tem permitido compreender e aplicar, coerentemente, biologia na matemática (sem forçar a matemática na biologia), utilizando-se dos atuais recursos das planilhas eletrônicas. Se Huxley fez o que fez com as poucas ferramentas disponíveis (log), foi e é exemplar. Então, não temos “desculpas” para não adentrarmos mais a fundo em modelos não lineares, uma vez que novas ferramentas são oferecidas a cada dia, permitindo mais robustez e qualidade em nossos ajustes e conclusões (Figuras 16).
Figura 16. Evolução do conhecimento da humanidade.
E a ciência se multiplicará... Daniel 12:4