Caracterização Fenotípica e Genotípica de Salmonella spp. Isoladas de Aviários de Frangos de Corte no Brasil entre 2009 E 2010
Publicado: 28 de dezembro de 2000
Por: D Voss-Rech1,CSL Vaz1, L Alves2, A Coldebella1, JA Leão3, D Rodrigues4. Embrapa Suínos e Aves. Concórdia, SC, Brasil. 2Bolsista PIBIC-CNPq (Embrapa/UnC), Concórdia, SC, Brasil. 3Laboratório MercoLab. Cascavel, PR, Brasil. 4
Fundação Oswaldo Cruz. Rio de Janeiro, RJ, Brasil, A Back3.
Introdução
A salmonelose é uma das zoonoses de maior importância para a saúde pública em todo o mundo. As aves estão entre os principais reservatórios de Salmonella, sendo importantes veículos de disseminação da bactéria. Desta forma, estudos epidemiológicos e de rastreabilidade do patógeno, são uma importante ferramenta para o aperfeiçoamento de medidas que permitam seu controle na avicultura e, para os quais, o conhecimento da diversidade fenotípica e genotípica dos sorovares de Salmonella é essencial. Assim, o objetivo deste trabalho foi obter as características de sorotipificação, sensibilidade a antimicrobianos e perfis de eletroforese em campo pulsado (PFGE) de Salmonella spp. isoladas de granjas comerciais de frangos de corte no Brasil.
Material e Métodos
Foram selecionadas 87 amostras de Salmonella spp. isoladas de suabes de arrasto de aviários comerciais de frangos de corte entre 2009 e 2010, representando 10 empresas de Santa Catarina, Paraná e Mato Grosso do Sul. As amostras foram isoladas pelo Laboratório MercoLab (Cascavel-PR) e doadas à Embrapa Suínos e Aves. A sorotipificação foi realizada no Instituto Oswaldo Cruz (FIOCRUZ, RJ) por meio do método de aglutinação rápida em lâmina. O teste de sensibilidade a antimicrobianos foi realizado pelo método de difusão em ágar conforme o Clinical and Laboratory Standards Institute (CLSI) (2). Como controle de qualidade dos testes foram utilizadas Escherichia coli ATCC 25922 e Enteroccocus faecalis ATCC 29212. Foram testados 12 antimicrobianos: ceftiofur (30µg); ciprofloxacina (5µg); amoxicilina/ácido clavulâmico (20/10µg); colistina (10µg); enrofloxacina (5µg); estreptomicina (10µg); fosfomicina (0,2µg); gentamicina (10µg); neomicina (30µg); norfloxacina (10µg); tetraciclina (30µg) e sulfametoxazol/trimetroprima (1.25/23.75µg). A genotipificação por PFGE foi realizada conforme previamente descrito (3) e os padrões de macrorestrição comparados pelo software Bionumerics 4.0 (Applied Maths). A similaridade foi calculada pelo coeficiente de Dice com tolerância de 1,5% e o dendrograma gerado pela análise de cluster pelo UPGMA.
Resultados e Discussão
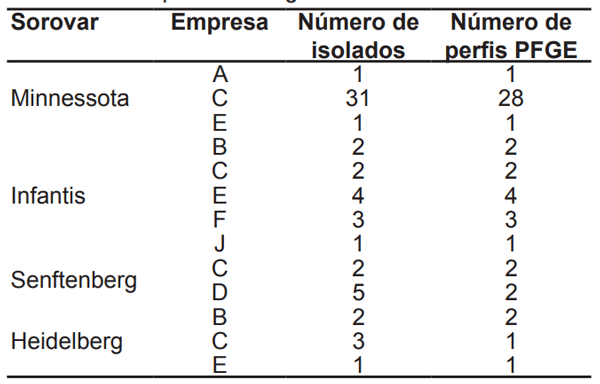
Foram identificados 20 sorovares, sendo Minnessota (37,93%), Infantis (13,79%), Senftenberg (8,05%) e Heidelberg (6,9%) os mais frequentes. O sorovar S. Enteritidis não foi identificado nas amostras analisadas. A Tabela 1 apresenta os 18 perfis de resistência antimicrobiana identificados. Aproximadamente 60% das amostras apresentaram resistência a um ou mais antimicrobianos. Todas as amostras foram sensíveis a fosfomicina, norfloxacina, enrofloxacina, colistina e ciprofloxacina. As amostras foram diferenciadas por PFGE em 67 genótipos, e apresentaram alta variabilidade, mesmo em sorovares originados da mesma empresa (Tabela 2).
Tabela 1 - Distribuição de Salmonella segundo o perfil de resistência a antimicrobianos.

Tabela 2 - Distribuição dos perfis de PFGE segundo o sorovar e a empresa de origem.
Conclusão
Os resultados sugerem o declínio da ocorrência de S. Enteritidis, provavelmente devido à vacinação de matrizes, em contrapartida nota-se emergência de outros sorovares. A resistência antimicrobiana observada alerta para a necessidade de monitoria e controle criterioso do uso de antimicrobianos. Por fim, a variabilidade genotípica identificada sugere possibilidade da existência de diversas fontes de infecção nas granjas avaliadas.
Referências
1. Ribot EM. et al. J. Clin. Microbiol 2001; 39(5):1889-1894.
2. CLSI. Approved Standard M2-A8, CLSI. USA. 2005.
3. CDC. CDC Training Manual. Atlanta GA.USA. 1998.
Tópicos relacionados:
Autores:
Mercolab
Embrapa Suínos e Aves
Recomendar
Comentário
Compartilhar

Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.







.jpg&w=3840&q=75)