anti-sépticos desinfecção estruturas químicas usos clínicos biocida
O uso de anti-sépticos e desinfetantes
Publicado: 29 de março de 2012
Por: Marco Murro (Gerente Técnico, Poly Sell.)
INTRODUÇÃO
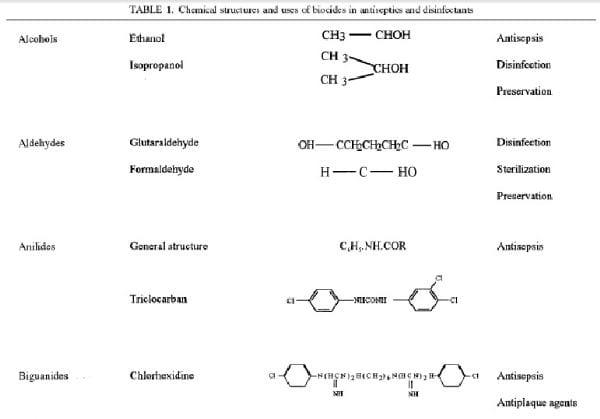
Anti-sépticos e desinfetantes são usados extensivamente em hospitais e outras configurações de cuidados de saúde parauma variedade de aplicativos da atualidade em superfície dura. Em particular, são uma parte essencial das práticas de controlede infecção e ajuda na prevenção de infecções nosocomiais (277, 454). Muitas preocupações sobre o potencial de riscos decontaminação e infecção microbianas nos mercados do consumidor em geral e alimentar também levaram ao aumento da utilização de anti-sépticos e desinfetantes pelo público em geral. Uma ampla variedade de agentes químicos ativos (ou"biocidas") encontra-se nestes produtos, muitos dos quais foram utilizados por centenas de anos para antisepsia, desinfecção e conservação (39). Apesar disto, pouco se sabe sobre o modo de ação destes agentes ativos que sobre antibióticos. Em geral, biocidas têm um espectro mais amplo de atividade que os antibióticos e, enquanto os antibióticos tendem a ter metas específicas intracelular, biocidas podem ter vários destinos. O uso generalizado dos produtos anti-sépticos e desinfetantes levou algumas especulações sobre o desenvolvimento da resistência microbiana, em particular cross resistência aos antibióticos. Esta revisão considera que é conhecido sobre o modo de ação e mecanismos de resistência microbiana dos anti-sépticos e desinfetantes e tentativas, sempre que possível, para relacionar os conhecimentos atuais para o ambiente clínico. Um resumo dos vários tipos debiocidas utilizados na assepsia e desinfecção, suas estruturas químicas e seus usos clínicos são demonstrados na tabela 1. É importante observar que muitos desses biocidas podem ser utilizados isoladamente ou em combinação em uma variedade de produtos que variam consideravelmente na atividade contra microrganismos. Atividade antimicrobiana pode ser influenciada por vários fatores, tais como efeitos de formulação, a presença de uma carga orgânica, sinergia, temperatura, diluição e métodode ensaio. Estas questões estão além do escopo desta revisão e são discutidos em outra parte (123, 425, 444, 446, 451).
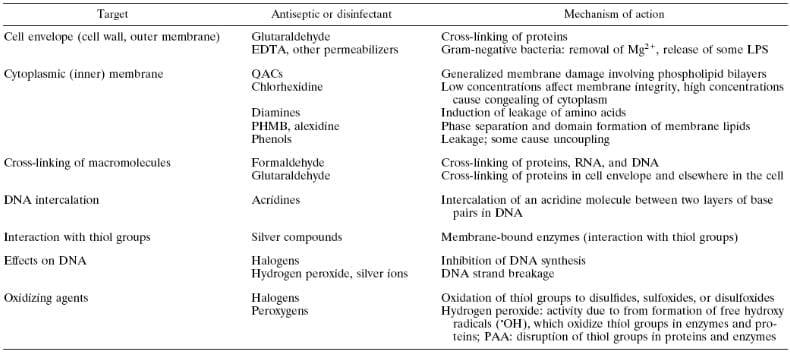
Tabela 1. Estrutura Química e uso de Biocidas em assepsia e desinfecção
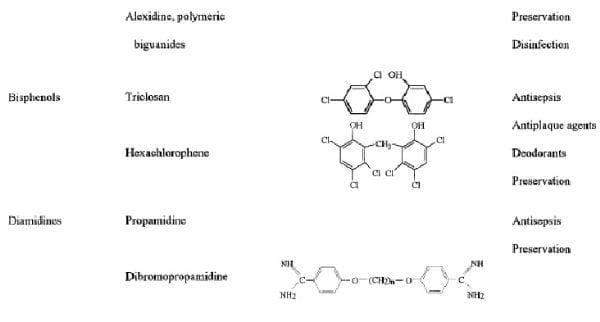
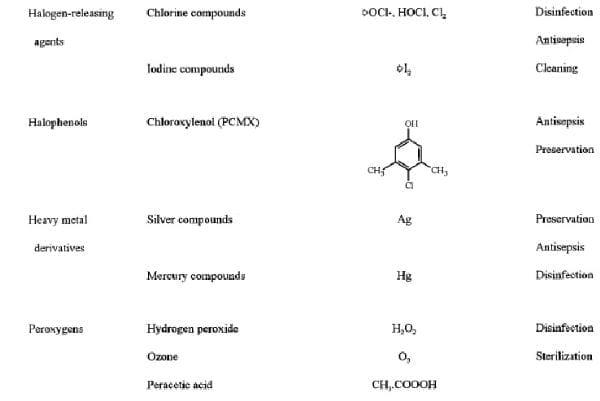
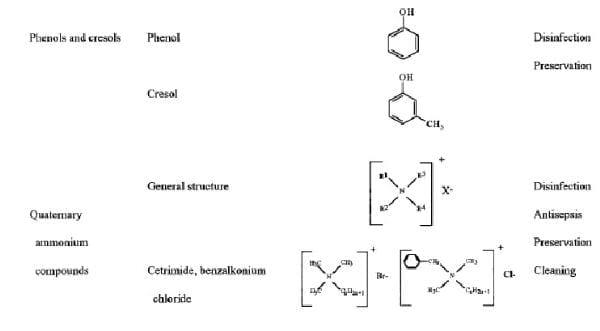
DEFINIÇÕES
"Biocida" é um termo geral que descreve um agente químico, geralmente de amplo espectro, que inativa microrganismos. Porque biocidas variam em atividade antimicrobiana, outros termos podem ser mais específicos, incluindo "- estático," referindo-se aos agentes que inibem o crescimento (por exemplo, bacteriostáticos, fungistáticos e esporistatico) e "-cidal," referindo-se aos agentes que matam o organismo de destino (por exemplo, esporicida, virucida e bactericida). Para efeitos do disposto na presente revisão, antibióticos são definidos como de ocorrência natural ou sintéticas, matérias orgânicas inibem ou destroem bactérias seletivas ou outros microrganismos, geralmente em baixas concentrações; anti-sépticos são biocidas ou produtos que destroem ou inibem o crescimento de microrganismos em ou sobre o tecido da vida (por exemplo, cuidados de saúde pessoal handwashes e scrubs cirúrgicos); e desinfetantes são semelhantes, mas geralmente são produtos ou biocidas que são usados em objetos inanimados ou superfícies. Desinfetantes podem ser esporistatico, mas não são necessariamente esporicida. Esterilização refere-se a um processo físico ou químico que destrói completamente ou remove toda a vida microbiana, incluindo esporos. Preservação é a prevenção da multiplicação dos microrganismos em produtos formulados, incluindo produtos farmacêuticos e alimentos. Um número de biocidas também é usado para fins de limpeza; limpeza nestes casos refere-se à remoção física de material estranho de uma superfície (40).
MECANISMOS DE AÇÃO
Introdução
Foram realizados progressos consideráveis de introdução de mecanismos de ação na compreensão dos mecanismos da ação antibacterianas, anti-sépticos e desinfetantes (215, 428, 437). Por outro lado, estudos sobre seus modos de ação contra fungos (426, 436), vírus (298, 307) e protozoários (163) têm sido bastante esparsos. Além disso, pouco se sabe sobre o meio pelo quais esses agentes desativam priões (503). Qualquer que seja o tipo de célula microbiana (ou entidade), é provável que exista uma seqüência de eventos comuns. Isso pode ser considerado como interação dos antisépticos ou desinfetantes com a superfície da célula seguida de penetração na célula e a ação, o complexo de destino. A natureza e a composição da superfície variam de tipo de uma célula (ou entidade) para outro, mas também podem alterarem consequência de alterações no ambiente (57, 59). Interação na superfície celular pode produzir um efeito significativo sobre viabilidade (por exemplo, com glutaraldeído) (374, 421), mas a maioria dos agentes antimicrobianos parece estar ativa intracelularmente (428, 451). As camadas de células microbianas ultraperiféricas assim podem ter um efeito significativo sobre a susceptibilidade (ou insusceptibilidade) dos anti-sépticos e desinfetantes; é decepcionante como pouco se sabe sobre a passagem destes agentes antimicrobianos em diferentes tipos de microrganismos. Dinamização da atividade da maioria dos biocidas pode ser alcançada através da utilização de aditivos diferentes, como mostrado nas partes mais tarde desta revisão. Nesta seção, são discutidos os mecanismos de ação antimicrobiana de uma gama de agentes químicos que são usados como anti-sépticos, desinfetantes ou ambos. São considerados diferentes tipos de microrganismos, semelhanças e diferenças na natureza e os efeitos são enfáticos. Os mecanismos da ação são resumidos na tabela 2.
Metodologia geral
Várias técnicas estão disponíveis para o estudo dos mecanismos de ação de anti-sépticos e desinfetantes sobre microrganismos, principalmente bactérias (448). Estes incluem análise de absorção (215, 428, 459), lise e fugas de constituintes intracelulares (122), perturbação da célula Homeostase (266, 445), efeitos sobre o modelo de membranas(170), inibição de enzimas, transporte de elétrons e Fosforilação oxidativa (162, 272), interação com macromoléculas (448, 523), efeitos sobre processos biosintéticos macromoleculares (133) e exame microscópico das células expostas ao biocida (35). Informações adicionais e úteis podem ser obtidas pelo cálculo expoentes de concentração (valores de n [219, 489]) e relativos à atividade de membrana (219). Muitos destes processos são valiosos para a detecção e avaliaçãode anti-sépticos ou desinfetantes utilizados em combinação (146, 147, 202, 210). Técnicas semelhantes foram utilizadas para estudar a atividade de anti-sépticos e desinfetantes contra fungos, em particulares de leveduras. Além disso, estudos sobre a porosidade da parede celular (117-119) podem fornecer informações úteis sobre entrada intracelular dos desinfetantes e anti-sépticos (204-208). Mecanismos de ação antiprotozoal não têm sido amplamente investigados. Uma razão para isso é a dificuldade em cultura de alguns protozoários (por exemplo, Cryptosporidium) em condições laboratoriais. No entanto, as fases de vida diferentes (trophozoites e Cistos) fornecem um exemplo fascinante do problema (148) de como variações de Citologia e fisiologia podem modificar respostas dos anti-sépticos e desinfetantes. Khunkitti et al. (251- 255) exploraram este aspecto utilizando índices de viabilidade, fugas, absorção e microscopiacomo ferramentas experimentais. Alguns destes procedimentos também podem ser modificados para estudar efeitos sobre vírus e phages (por exemplo, absorção de células inteiras e viral ou componentes phage, efeitos sobre microscopia, ácidos nucléicos e proteínas) (401). Virais alvos são predominantemente vírus envelopados (se houver), derivado da célula de host citoplasmáticas ou membrana nuclear; o capsídeo, que é responsável pelo forma de partículas de vírus e de proteção dos ácidos nucléicos virais; e o genoma viral. Lançamento de um ácido nucléico viral intacto, no ambiente após a destruição do capsídeo é potencial preocupação, pois alguns ácidos nucleicos são infecciosos quando libertado a partirdo capsídeo (317), um aspecto que deve ser considerado na desinfecção viral. Considerações importantes na inativação viral são tratadas por Klein e Deforest (259) e Prínce et al. (384), enquanto é altamente recomendado um papel anterior pelo Grossgebauer (189).
Álcoois.
Embora vários álcoois se revelaram ser antimicrobianos eficazes, álcool etílico (etanol, álcool), álcool isopropílico (isopropanol, 2-propanol) e n-propanol (em especial na Europa) são o mais amplamente usados (337). Álcoois apresentam rápida atividade antimicrobiana com amplo espectro contra bactérias vegetativas (incluindo a micobactéria), vírus e fungos, mas não são esporicidas. Eles são, no entanto, conhecidos como inibidor de esporulação e germinação de esporos (545), mas este efeito é reversível (513). Por falta de atividade esporicida, álcoois não são recomendados para esterilização, mas são amplamente utilizadas para desinfecção de superfície dura e anti-sepsia. Concentrações inferiores também podem ser utilizadas como conservantes e potenciador da atividade de outros biocidas. Muitos produtos de álcool incluem níveis baixos de outros biocidas (em particular clorexidina), que permanecem na pele após evaporação do álcool ou excipientes (incluindo emolientes), o que diminui o tempo de evaporação do álcool e podem aumentar significativamente a eficácia do produto (68). Em geral, álcool isopropílico é considerado ligeiramente mais eficaz contra bactérias (95) e álcool etílico é mais potente contra vírus (259); no entanto, este é dependente das concentrações, do agente ativo e do microorganismo de teste. Por exemplo, álcool isopropílico tem propriedades lipofilica maior que álcool etílico e é menos ativa contra vírus hidrofílicos (por exemplo, vírus) (259). Geralmente, a atividade antimicrobiana dos álcoois é significativamente inferior em concentrações inferiores a 50 % e é ideal na faixa de 60 a 90%. Pouco é conhecido sobre o modo de ação dos álcoois, mas como base tem maior eficácia na presença da água, geralmente podemos acreditar que causam danos de membrana e desnaturação rápida de proteínas, com interferência subseqüente com o metabolismo e lise celular (278, 337). Isso é suportado pelos relatórios específicos de desnaturação da Escherichia coli dehydrogenases (499) e uma fase de latência maior em aerogenes Enterobacter, devida à inibição do metabolismo necessário para divisão celular rápida (101).
Tabela 2 - Resumo: Mecanismos de ação
Tabela 3. Mecanismo de ação do Glutaraldeído

Aldeídos
Glutaraldeido.
Glutaraldeído é um importante dialdeido que encontrou uso como desinfetante em esterilização, em particular para baixas temperaturas de desinfecção e esterilização de Endoscópios e equipamento cirúrgico e como um fixador em microscopia de elétrons. Glutaraldeído tem um amplo espectro de atividade contra bactérias e seus esporos, fungos e vírus, e uma quantidade considerável de informação está disponível sobre as maneiras pela qual organismos diferentes são inativados (quadros 2 e 3). Revisões anteriores dos seus mecanismos de ação foram publicadas (179, 182, 374, 482).
Os primeiros relatórios em 1964 e 1965 (182) demonstraram que glutaraldeído possui elevada atividade antimicrobiana. Posteriormente, a investigação foi realizada para avaliar a natureza da ação bactericida (339-344, 450) e esporicida (180, 181, 507, 508). Estes estudos bactericidas demonstraram (374) uma forte vinculação de glutaraldeído para camadas exteriores de organismos como a e. coli e Staphylococcus aureus (179, 212, 339-341, 343, 344), inibição de transporte em bactérias gram (179), inibição da atividade desidrogenase (343, 344) e das enzimas periplasmica (179), prevenção de lise induzidas pelo lysostaphin em S. aureus (453) e de sódio laurílico induzidas pelo sulfato lise de e. coli (340, 344), inibição de lise spheroplast e protoplastos na mídia hipotonica (340, 344) e inibição da síntese de RNA, DNA e proteínas (320). Forte interação de glutaraldeído com lisina e outros aminoácidos tem sido demonstrado (450). Claramente, o mecanismo de ação do glutaraldeído envolve uma forte associação com as camadas exteriores das células bacterianas, especificamente com aminas na superfície da célula, possivelmente representando os sítios reativos (65). Esse efeito poderia explicar sua ação inibitória no transporte e nos sistemas de enzima, onde é proibido o acesso de substrato à enzima. Remoção parcial ou total da parede da célula em meio hipertônico, levando para a produção de esferoplastos ou protoplastos e a prevenção subseqüente de lise por glutaraldeído quando estas formas são diluídas em um ambiente hipotônico, sugere um efeito adicional na membrana interna, uma constatação justificada pelo fato de que o dialdeido impede à divulgação seletiva de algumas enzimas ligadas a membrana de Micrococcus lysodeikticus (138).Glutaraldeído é mais ativo em pH alcalino que em pH ácido. Como o pH externo é alterado de ácido para alcalino, sítios mais reativos serão formados na superfície da célula, levando a um efeito bactericida mais rápido. Os cross-links assim obtidos significam que a célula não consegue realizar a maioria, se não todas, as suas funções essenciais. Glutaraldeído também é micobactericida. Infelizmente, não há estudos críticos ainda realizados para avaliar a natureza desta ação (419).
Os esporos bacterianos apresentam vários sítios em que é possível, interação com glutaraldeído, apesar de interação com um determinado sitio não significa necessariamente que isso está associado a inativação de esporos. E. coli, S. aureus e células vegetativa de Bacillus subtilis vinculam glutaraldeído a mais do que fazer repouso dos esporos do B. subtilis (377, 378); a fixação de glutaraldeído é maior durante a germinação e desdobramento do que com esporos maduros, mas ainda inferior com células vegetativa. Baixas concentrações de (0,1 %) dialdeido inibem a germinação, considerando concentrações mais elevadas (2 %) são esporicidas. Os aldeídos, em pHs ácido e alcalino, interagem com as camadas exteriores de esporos (508, 509); esta interação reduz a libertação de ácido dipicolinico (DPA) de esporos aquecidos e a lise induzidas por mercaptoetanol (ou thioglycolate)-peróxido. Baixas concentrações de glutaraldeído ácido e alcalino aumentam a superfície hidrofobicito de esporos, indicando novamente um efeito nas regiões ultra periféricas da célula.
Foi observado por vários autores (182, 374, 376, 380) que a maior atividade esporicida de glutaraldeído a pH alcalino não é refletida pelas diferenças na absorção; no entanto, absorção reflete por ser vinculativo e não necessariamente a penetração nos esporos. É concebível que glutaraldeído ácido interage com e permanece na superfície celular.
Considerando glutaraldeído alcalino penetra mais profundamente nos esporos. Em contradição com a hipótese de Bruch (65), que previa a forma ácida penetrar o Brasão e reagindo com o córtex enquanto o formula alcalino atacou o Brasão, esta disputa está destruindo assim a capacidade dos esporos de funcionar apenas como resultado deste fenômeno superficial. Não há, ainda, provas para suportar esta teoria. Formulações de ingredientes glutaraldeído baseadas glutaraldeído ácido, em vez de alcalino, que beneficiam a maior estabilidade inerente a aldeído a pH inferior, foram produzidas. A atividade esporicida melhor alegada para estes produtos pode ser obtida pelos agentes que potenciam a atividade do dialdeido (414, 421).
Durante a esporulação, a célula eventualmente fica menos sensível à glutaraldeído (ver "Resistência intrínsecas dos esporos bacterianos"). Pelo contrário, germinando e ultrapassando células readquire sensibilidade. Germinação pode ser definida como um processo irreversível em que haja uma mudança de um esporo ativado de um inativo para um estado ativo metabolicamente dentro de um curto período. Glutaraldeído exerce um efeito antecipado sobre o processo de germinação. L-alanina é considerado a agir pela vinculação a um receptor específico sobre o Brasão de esporos, e esporos uma vez acionados para germinarem, ficam comprometidos irreversivelmente a perder suas propriedades inativas (491). Glutaraldeído em concentrações elevadas inibe a absorção de L-[C 14] alanina em esporos de B. subtilis, embora por um mecanismo desconhecido (379, 414). Esporos tratados com Glutaraldeído retem sua refratividade, tendo a mesma aparência ao microscópio de contraste de fase como esporos normais, não tratadas até mesmo quando os esporos são incubados posteriormente na germinação. Glutaraldeído é normalmente usado como uma solução de 2 % para obter um efeito esporicida (16, 316); baixas concentrações (0,1 %) impedem a fase escurecimento dos esporos e também evitam a diminuição da densidade óptica associada a um evento na germinação tardio. Pelo contrário, concentrações mais elevadas (1 a 0,1 %) reduzem significativamente a absorção de L-alanina, possivelmente em consequência de um fecho efeito do aldeído sobre a superfície da célula. Mecanismos envolvidos no relançamento do glutaraldeído tratados em esporos são discutidos abaixo (ver "intrínsecas resistência dos esporos bacterianos").
Não há nenhum estudo recente dos mecanismos de ação fungicida do glutaraldeído. Trabalhos anteriores tinham sugerido que a parede da célula fúngica era um local principal de destino (179, 182, 352), especialmente a parede componente principal, quitina, que é análoga do peptidoglicano encontrado nas paredes de células bacterianas.
Glutaraldeído é um potente agente virucida (143, 260). Ele reduz a atividade de antígeno de superfície hepatite B (HBsAg) e especialmente o antigênico de núcleo de hepatite B ([HBcAg] em vírus da hepatite B [HBV]) (3) e interage com resíduos de lisina na superfície do vírus da hepatite A (HAV) (362). Baixas concentrações (, 0,1 %) do glutaraldeído alcalino são eficazes contra vírus purificado, considerando vírus RNA é altamente resistente às concentrações aldeído até 1 % a pH 7.2 e é inativados só lentamente a pH 8.3 (21). Em outras palavras, as partículas de vírus são muito mais sensíveis do que o vírus RNA. Na luz disto, ele tem sido inferido que induzidas em glutaraldeído a perda de infecciosidade está associada a alterações do capsídeo (21). Glutaraldeído a baixas concentrações de 0,05 e 0,005 % interage com as proteínas de capsídeo do vírus e ecovirus, respectivamente; as diferenças na sensibilidade provavelmente refletem os dois vírus (75) grandes variações estruturais. Bacteriofases recentemente foram estudados para obter informações sobre mecanismos de ação virucida (298-304, 306, 307). Muitos glutaraldeídos tratados p. aeruginosa F116 phage partículas tinham cabeças vazias, implicando que o genoma phage tinha sido ejetado. O aldeído possivelmente foi vinculado ao DNA de dupla-ociosos F116 mas sem afetar a molécula; glutaraldeído também interagiu com proteínas F116 phage, que eram postulou ser envolvido na ejeção do ácido nucléico. As concentrações de glutaraldeído superiores a 0,1 a 0,25 % afetam significativamente a transdução deste phage; o processo de transdução era mais sensível do aldeído que foi o próprio phage. Glutaraldeído e outros aldeídos foram testados para a sua capacidade de formar proteínas-DNA cross-links no vírus simian 40 (SV40); aldeídos (isto é, glioxal, furfuraldeído, prionaldeido, acetaldeído e benzilaldeido) sem capacidade reticuladores detectável não tem efeitos na síntese de DNA SV40, Considerando que acroleína, glutaraldeído e formaldeído, que formou tais cross-links (144, 271, 297), inibida síntese de ADN (369).
Os primeiros relatórios em 1964 e 1965 (182) demonstraram que glutaraldeído possui elevada atividade antimicrobiana. Posteriormente, a investigação foi realizada para avaliar a natureza da ação bactericida (339-344, 450) e esporicida (180, 181, 507, 508). Estes estudos bactericidas demonstraram (374) uma forte vinculação de glutaraldeído para camadas exteriores de organismos como a e. coli e Staphylococcus aureus (179, 212, 339-341, 343, 344), inibição de transporte em bactérias gram (179), inibição da atividade desidrogenase (343, 344) e das enzimas periplasmica (179), prevenção de lise induzidas pelo lysostaphin em S. aureus (453) e de sódio laurílico induzidas pelo sulfato lise de e. coli (340, 344), inibição de lise spheroplast e protoplastos na mídia hipotonica (340, 344) e inibição da síntese de RNA, DNA e proteínas (320). Forte interação de glutaraldeído com lisina e outros aminoácidos tem sido demonstrado (450). Claramente, o mecanismo de ação do glutaraldeído envolve uma forte associação com as camadas exteriores das células bacterianas, especificamente com aminas na superfície da célula, possivelmente representando os sítios reativos (65). Esse efeito poderia explicar sua ação inibitória no transporte e nos sistemas de enzima, onde é proibido o acesso de substrato à enzima. Remoção parcial ou total da parede da célula em meio hipertônico, levando para a produção de esferoplastos ou protoplastos e a prevenção subseqüente de lise por glutaraldeído quando estas formas são diluídas em um ambiente hipotônico, sugere um efeito adicional na membrana interna, uma constatação justificada pelo fato de que o dialdeido impede à divulgação seletiva de algumas enzimas ligadas a membrana de Micrococcus lysodeikticus (138).Glutaraldeído é mais ativo em pH alcalino que em pH ácido. Como o pH externo é alterado de ácido para alcalino, sítios mais reativos serão formados na superfície da célula, levando a um efeito bactericida mais rápido. Os cross-links assim obtidos significam que a célula não consegue realizar a maioria, se não todas, as suas funções essenciais. Glutaraldeído também é micobactericida. Infelizmente, não há estudos críticos ainda realizados para avaliar a natureza desta ação (419).
Os esporos bacterianos apresentam vários sítios em que é possível, interação com glutaraldeído, apesar de interação com um determinado sitio não significa necessariamente que isso está associado a inativação de esporos. E. coli, S. aureus e células vegetativa de Bacillus subtilis vinculam glutaraldeído a mais do que fazer repouso dos esporos do B. subtilis (377, 378); a fixação de glutaraldeído é maior durante a germinação e desdobramento do que com esporos maduros, mas ainda inferior com células vegetativa. Baixas concentrações de (0,1 %) dialdeido inibem a germinação, considerando concentrações mais elevadas (2 %) são esporicidas. Os aldeídos, em pHs ácido e alcalino, interagem com as camadas exteriores de esporos (508, 509); esta interação reduz a libertação de ácido dipicolinico (DPA) de esporos aquecidos e a lise induzidas por mercaptoetanol (ou thioglycolate)-peróxido. Baixas concentrações de glutaraldeído ácido e alcalino aumentam a superfície hidrofobicito de esporos, indicando novamente um efeito nas regiões ultra periféricas da célula.
Foi observado por vários autores (182, 374, 376, 380) que a maior atividade esporicida de glutaraldeído a pH alcalino não é refletida pelas diferenças na absorção; no entanto, absorção reflete por ser vinculativo e não necessariamente a penetração nos esporos. É concebível que glutaraldeído ácido interage com e permanece na superfície celular.
Considerando glutaraldeído alcalino penetra mais profundamente nos esporos. Em contradição com a hipótese de Bruch (65), que previa a forma ácida penetrar o Brasão e reagindo com o córtex enquanto o formula alcalino atacou o Brasão, esta disputa está destruindo assim a capacidade dos esporos de funcionar apenas como resultado deste fenômeno superficial. Não há, ainda, provas para suportar esta teoria. Formulações de ingredientes glutaraldeído baseadas glutaraldeído ácido, em vez de alcalino, que beneficiam a maior estabilidade inerente a aldeído a pH inferior, foram produzidas. A atividade esporicida melhor alegada para estes produtos pode ser obtida pelos agentes que potenciam a atividade do dialdeido (414, 421).
Durante a esporulação, a célula eventualmente fica menos sensível à glutaraldeído (ver "Resistência intrínsecas dos esporos bacterianos"). Pelo contrário, germinando e ultrapassando células readquire sensibilidade. Germinação pode ser definida como um processo irreversível em que haja uma mudança de um esporo ativado de um inativo para um estado ativo metabolicamente dentro de um curto período. Glutaraldeído exerce um efeito antecipado sobre o processo de germinação. L-alanina é considerado a agir pela vinculação a um receptor específico sobre o Brasão de esporos, e esporos uma vez acionados para germinarem, ficam comprometidos irreversivelmente a perder suas propriedades inativas (491). Glutaraldeído em concentrações elevadas inibe a absorção de L-[C 14] alanina em esporos de B. subtilis, embora por um mecanismo desconhecido (379, 414). Esporos tratados com Glutaraldeído retem sua refratividade, tendo a mesma aparência ao microscópio de contraste de fase como esporos normais, não tratadas até mesmo quando os esporos são incubados posteriormente na germinação. Glutaraldeído é normalmente usado como uma solução de 2 % para obter um efeito esporicida (16, 316); baixas concentrações (0,1 %) impedem a fase escurecimento dos esporos e também evitam a diminuição da densidade óptica associada a um evento na germinação tardio. Pelo contrário, concentrações mais elevadas (1 a 0,1 %) reduzem significativamente a absorção de L-alanina, possivelmente em consequência de um fecho efeito do aldeído sobre a superfície da célula. Mecanismos envolvidos no relançamento do glutaraldeído tratados em esporos são discutidos abaixo (ver "intrínsecas resistência dos esporos bacterianos").
Não há nenhum estudo recente dos mecanismos de ação fungicida do glutaraldeído. Trabalhos anteriores tinham sugerido que a parede da célula fúngica era um local principal de destino (179, 182, 352), especialmente a parede componente principal, quitina, que é análoga do peptidoglicano encontrado nas paredes de células bacterianas.
Glutaraldeído é um potente agente virucida (143, 260). Ele reduz a atividade de antígeno de superfície hepatite B (HBsAg) e especialmente o antigênico de núcleo de hepatite B ([HBcAg] em vírus da hepatite B [HBV]) (3) e interage com resíduos de lisina na superfície do vírus da hepatite A (HAV) (362). Baixas concentrações (, 0,1 %) do glutaraldeído alcalino são eficazes contra vírus purificado, considerando vírus RNA é altamente resistente às concentrações aldeído até 1 % a pH 7.2 e é inativados só lentamente a pH 8.3 (21). Em outras palavras, as partículas de vírus são muito mais sensíveis do que o vírus RNA. Na luz disto, ele tem sido inferido que induzidas em glutaraldeído a perda de infecciosidade está associada a alterações do capsídeo (21). Glutaraldeído a baixas concentrações de 0,05 e 0,005 % interage com as proteínas de capsídeo do vírus e ecovirus, respectivamente; as diferenças na sensibilidade provavelmente refletem os dois vírus (75) grandes variações estruturais. Bacteriofases recentemente foram estudados para obter informações sobre mecanismos de ação virucida (298-304, 306, 307). Muitos glutaraldeídos tratados p. aeruginosa F116 phage partículas tinham cabeças vazias, implicando que o genoma phage tinha sido ejetado. O aldeído possivelmente foi vinculado ao DNA de dupla-ociosos F116 mas sem afetar a molécula; glutaraldeído também interagiu com proteínas F116 phage, que eram postulou ser envolvido na ejeção do ácido nucléico. As concentrações de glutaraldeído superiores a 0,1 a 0,25 % afetam significativamente a transdução deste phage; o processo de transdução era mais sensível do aldeído que foi o próprio phage. Glutaraldeído e outros aldeídos foram testados para a sua capacidade de formar proteínas-DNA cross-links no vírus simian 40 (SV40); aldeídos (isto é, glioxal, furfuraldeído, prionaldeido, acetaldeído e benzilaldeido) sem capacidade reticuladores detectável não tem efeitos na síntese de DNA SV40, Considerando que acroleína, glutaraldeído e formaldeído, que formou tais cross-links (144, 271, 297), inibida síntese de ADN (369).
Formaldeido.
Formaldeído (methanal, CH2O) é um monoaldeido que existe como um gás livre solúveis em água. Solução de formaldeído (formol) é uma solução aquosa contendo ca. 34 e 38 % (wt/wt) CH2O com metanol para atrasar a polimerização. Geralmente, a sua utilização clínica é como um desinfetante e esterilizante líquido ou em combinação com vapor de baixa temperatura. Formaldeído é bactericida, esporicida e virucida, mas funciona mais lentamente do que glutaraldeído (374, 482). Formaldeído é uma substância extremamente reativa (374, 442) que interage com proteínas (156, 157), DNA (155) e RNA (155) in vitro. Ele há tempo foi considerado esporicida em virtude da sua capacidade de penetrar no interior de esporos de bactérias (500). A interação com proteína resulta de uma combinação com a principal amida, bem como com os grupos amino, embora grupos de fenol vincular pouco formaldeído (155). Foi proposto que o formaldeído atua como um agente mutagénico (291) e como um agente alcalinizante por reação com grupos carboxila, sulfidrila e hidroxila (371). Formaldeído também reage extensivamente com ácido nucléico (489) (por exemplo, o DNA de phage T2) (190). Como assinalado, faz cross-links de proteínas-DNA em SV40, assim, inibem a síntese de ADN (369). As baixas concentrações de formaldeído são esporostatico e inibem a germinação (512). Formaldeído altera HBsAg e HBcAg do HBV (3). Claramente, suas propriedades interativas e reticuladores devem desempenhar um papel considerável nesta atividade. A maioria dos outros aldeídos (glutaraldeído, glyoxal, succinaldeido e o-phthalaldeido [OPA]) que têm atividade esporicida são dialdeidos (e destas, glyoxal e succinaldeido são fracamente ativos). A distância entre os dois grupos aldeído no glutaraldeído (e possivelmente no OPA) pode ser ideal para a interação dos grupos -CHO em ácidos nucleicos e sobretudo em proteínas e enzimas (428).
Formaldeido- agentes doadores.
Vários agentes de liberação de formaldeído foram utilizados no tratamento de Peritonite (226, 273). Eles incluem noxythiolin (oxymethylenethiourea), tauroline (um condensado de duas moléculas de ácido aminosulfonico taurine com três moléculas de formaldeído), hexamine (hexametilenotetramina, metenamina), a melamina de resinas e formaldeído uréia e derivados de imidazolona como dantoina. Todos estes agentes são microbicidas devido à libertação de formaldeído. No entanto, porque a atividade antibacterianas de taurolin é maior que o de formaldeído livre, da atividade de taurolin não é inteiramente o resultado da ação de formaldeído (247).
o-Phthalaldeido.
OPA é um novo tipo de desinfetante que alegou ter potente atividade bactericida e esporicida e foi sugerido como uma substituição para glutaraldeído na desinfecção de endoscopios (7). OPA é um composto com dois grupos de aldeído aromático. Até à data, o mecanismo antimicrobiano e ação tem sido pouco estudada, mas provas preliminares (526) sugerem uma ação semelhante dos glutaraldeído. Investigações são necessários para corroborar esta opinião.
Anilides
Os anilides já investigados primariamente para uso como anti-sépticos, mas raramente são usados na clínica. Triclocarbão (CTP; 3,4,49-triclorocarbanilide) é o mais amplamente estudados nesta série e é usado principalmente em consumidor de sabões e desodorizantes. CTP é particularmente ativa contra bactérias gram mas significativamente menos ativo contra bactérias gram e fungos (30) e carece de substantividade apreciável (persistência) para a pele (37). Os anilides agem por adsorção e destruindo o caráter semi permeável da membrana citoplasmáticas, levando a mortecelular (194).
Biguanidas
Clorexidina.
Clorexidina é provavelmente a biocida mais amplamente usado em produtos anti-sépticos, em particularnos produtos handwashing e oral, mas também como um desinfetante e conservante. Isto se deve em particular a sua eficácia e amplo espectro, substantivitdade para a pele e irritação baixa. Nota, irritabilidade foi descrita e em muitos casos, pode ser de um produto específico (167, 403). Apesar das vantagens de clorexidina, sua atividade é dependente depH e é bastante reduzida na presença de matéria orgânica (430). Uma quantidade considerável de investigação tem sido realizada sobre o mecanismo da ação antimicrobiana deste importante bisbiguanide (389) (quadros 2 e 4), embora a maior parte da atenção fosse dedicada à forma na qual ela age (Tabelas 2 e 4).
Tabela 4. Mecanismo de ação da Clorexidina.
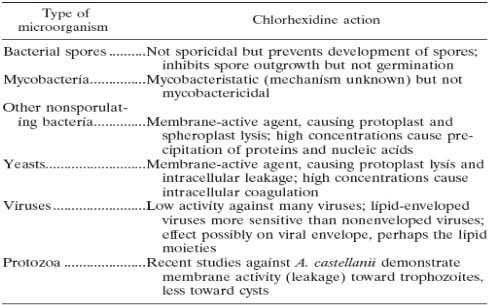
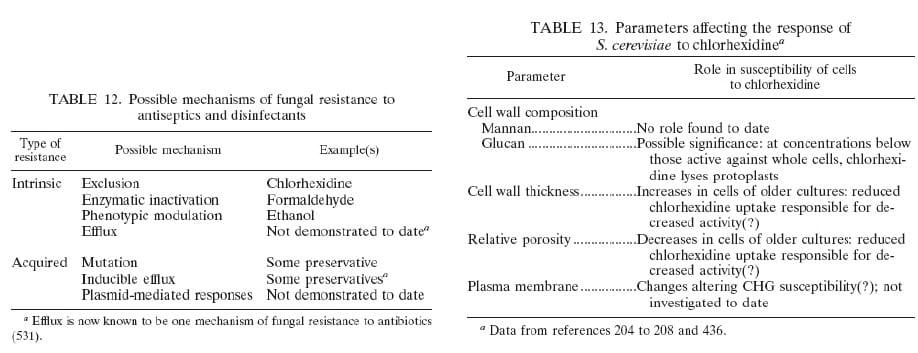
Inativa as bactérias não esporuladas (215, 428, 430, 431, 451). No entanto, dados suficientes estão agora disponíveis para examinar sua ação esporostática e ação micobacteriostática, seus efeitos sobre leveduras e protozoários e sua atividade antivirais. Clorexidina é um agente bactericida (120, 215). Sua interação e absorção pelas bactérias foram estudados inicialmente por Hugo et al. (222-224), que descobriu que a absorção de clorexidina por e. coli e S. aureus era muito rápida e dependo da concentração de clorexidina e pH. Mais recentemente, utilizando gluconato de clorexidina [C14], a absorção por bactérias (145) e leveduras (204) foi mostrada para ser extremamente rápido, com um efeito máximo ocorra dentro de 20 s. danos às camadas exteriores das células ocorrem (139), mas são insuficientes para induzir a morte lise da célula. O agente em seguida atravessa as paredes celulares ou membrana exterior, presumivelmente por difusão passiva e posteriormente os ataques a membrana interior ou citoplasmáticas da bactéria ou a membrana de plasma de levedura. Em leveduras, clorexidina causa "partições" na parede celular, membrana de plasma e citoplasma das células (205). Danos para as membranas semi permeáveis delicada é seguido de fuga dos constituintes intracelulares, que pode ser medido através de técnicas adequadas. Fugas não por si só responsável inativação celular, mas é uma consequência da morte celular (445). Concentrações elevadas de clorexidina causam coagulação dos constituintes intracelulares. Como resultado, o citoplasma torna-se congelado, com uma consequente redução em fuga (222-224, 290), portanto, o que existe é um efeito bifásico na permeabilidade da membrana. Uma alta taxa inicial de fugas sobe com a concentração de aumentos de clorexidina, mas é reduzido em concentrações mais elevadas do biocida e há vazamento devido a coagulação do Citosol. Os efeitos de clorexidina sobre células de leveduras são provavelmente semelhantes às descritas anteriormente para bactérias (204-207). Clorexidina tem um efeito bifásico sobre lise protoplastos, com reduzida lise em concentrações mais altas de hexametilenobiguanida. Além disso, em células de toda a parede da célula de levedura pode ter algum efeito em limitar a absorção da hexametilenobiguanida (208). As conclusões apresentadas aqui e noutros locais (47, 136, 137, 527) demonstram um efeito sobre a membrana de plasma fúngica, mas com ações significativas noutras partes da célula (47). O aumento das concentrações de clorexidina (até 25 mg/ml) induz lise progressiva de Saccharomyces cerevisiae protoplastos, mas concentrações mais elevadas de hexametilenobiguanida resultam em lise reduzida (205). Trabalho a data sugere que clorexidina tem um efeito semelhante sobre os trophozoites de Acanthameoba castellanii, com os Cistos sendo menos sensíveis (251-255). Furr (163) revisa efeitos de clorexidina e outros biocidas no Acanthameoba e mostrou que o dano de membrana nestes protozoários é um fator importante na sua desativação. Micobactéria geralmente é altamente resistente à clorexidina (419). Pouco se sabe sobre a absorção de clorexidina (e outros anti-sépticos e desinfetantes) por micobactérias e sobre as alterações bioquímicas que ocorrem nas células tratadas. Uma vez que o PRM para alguns micobactérias é da ordem de aqueles de clorexidina-sensíveis, Gram cocci (48), efeitos inibitórios de clorexidina sobre a micobactéria não podem ser diferentes para as bactérias sensíveis.
Mycobacterium avium-intracellulare é consideravelmente mais resistente que outra micobactéria (48). Clorexidina não é esporicida (discutidos em "mecanismos de resistência"). Mesmo elevadas concentrações da bisbiguanide não afetam a viabilidade dos esporos de Bacillus à temperatura ambiente (473, 474), embora um efeito esporicida marcado é alcançado a temperaturas elevadas (475). Presumivelmente, suficientes ocorrem alterações na estrutura de esporos para permitir uma maior aceitação da hexametilenobiguanida, embora este ainda tem que ser mostrado experimentalmente. Pouco se sabe sobre a absorção de clorexidina por esporos bacterianos, embora formulários coatless ocupem mais do composto que os esporos "normais" (474). Clorexidina tem pouco efeito sobre a germinação dos esporos de bactérias (414, 422, 432, 447), mas inibe o desdobramento (447). O motivo da sua falta de efeito sobre o processo antigo, mas sua atividade significativa contra este último não é clara. Ele poderia, no entanto, traduzir-se na absorção relativa de clorexidina, desde germinação das células take up muito menos do bisbiguanide que fazer outgrowing formulários (474). Sítio de vinculação poderia assim ser reduzida no número ou mascarado em células de germinação. A atividade de clorexidina como antivirais é variável. Estudos com diferentes tipos de bacteriophages mostraram que clorexidina não tem efeito sobre coliphages MS2 ou K (300). Concentrações elevadas também conseguiram desativar Pseudomonas aeruginosa phage F116 e não tem efeitos na phage ADN dentro do capsídeo ou
phage proteínas (301); o processo de transdução era mais sensível à clorexidina e outras biocidas que foi o próprio phage. Esta fundamentada uma constatação anterior (306) que clorexidina mal vinculada às partículas de F116. Clorexidina não é sempre considerado um agente antiviral eficaz, sua atividade é restrita aos vírus envelopados lípidos (361). Clorexidina não desativa vírus não envelopados como rotavirus (485), HAV (315) ou vírus (34). Sua atividade foi encontrada por Ranganathan (389) ser restringido para o núcleo de ácido nucléico ou o Brasão exterior, embora seja provável que este último seria um local de destino mais importante.
Mycobacterium avium-intracellulare é consideravelmente mais resistente que outra micobactéria (48). Clorexidina não é esporicida (discutidos em "mecanismos de resistência"). Mesmo elevadas concentrações da bisbiguanide não afetam a viabilidade dos esporos de Bacillus à temperatura ambiente (473, 474), embora um efeito esporicida marcado é alcançado a temperaturas elevadas (475). Presumivelmente, suficientes ocorrem alterações na estrutura de esporos para permitir uma maior aceitação da hexametilenobiguanida, embora este ainda tem que ser mostrado experimentalmente. Pouco se sabe sobre a absorção de clorexidina por esporos bacterianos, embora formulários coatless ocupem mais do composto que os esporos "normais" (474). Clorexidina tem pouco efeito sobre a germinação dos esporos de bactérias (414, 422, 432, 447), mas inibe o desdobramento (447). O motivo da sua falta de efeito sobre o processo antigo, mas sua atividade significativa contra este último não é clara. Ele poderia, no entanto, traduzir-se na absorção relativa de clorexidina, desde germinação das células take up muito menos do bisbiguanide que fazer outgrowing formulários (474). Sítio de vinculação poderia assim ser reduzida no número ou mascarado em células de germinação. A atividade de clorexidina como antivirais é variável. Estudos com diferentes tipos de bacteriophages mostraram que clorexidina não tem efeito sobre coliphages MS2 ou K (300). Concentrações elevadas também conseguiram desativar Pseudomonas aeruginosa phage F116 e não tem efeitos na phage ADN dentro do capsídeo ou
phage proteínas (301); o processo de transdução era mais sensível à clorexidina e outras biocidas que foi o próprio phage. Esta fundamentada uma constatação anterior (306) que clorexidina mal vinculada às partículas de F116. Clorexidina não é sempre considerado um agente antiviral eficaz, sua atividade é restrita aos vírus envelopados lípidos (361). Clorexidina não desativa vírus não envelopados como rotavirus (485), HAV (315) ou vírus (34). Sua atividade foi encontrada por Ranganathan (389) ser restringido para o núcleo de ácido nucléico ou o Brasão exterior, embora seja provável que este último seria um local de destino mais importante.
Alexidina.
Alexidina difere quimicamente clorexidina em que possuam grupos etilhexilo no final. Alexidina é mais rapidamente bactericida e produz uma modificação significativamente mais rápida na permeabilidade bactericida (79, 80). Estudos com vesículas fosfolipídeos pura e mistas-lipídeos demonstram que, ao contrário de clorexidina, alexidina produz lipídeos fase separação e domínio de formação (tabela 2). Ele foi proposto (80) que a natureza do grupo etilhexilo final em alexidina, em vez da um clorofenol de clorexidina, possa influenciar a capacidade de uma hexametilenobiguanida para produzir domínios de levedos na membrana citoplasmáticas.
Polimericas biguanidas.
Vantocil é uma mistura de heterodisperse de polyhexamethylene biguanides (PHMB) com um peso molecular de aproximadamente 3.000. Biguanidas poliméricas encontraram uso como agentes de desinfecção geral na indústria alimentar e, com muito êxito, para a desinfecção de piscinas. Vantocil é ativo contra bactérias gram e Gram, embora p. aeruginosa e Proteus vulgaris são menos sensíveis. Vantocil não é esporicida. PHMB é um agente de membrana-ativo que também prejudica a integridade da membrana exterior de bactérias gram, embora a membrana também pode atuar como uma barreira de permeabilidade (64, 172). Atividade de aumentos PHMB em uma base de peso com níveis crescentes de polimerização, que esteve associado a perturbação de membrana interna reforçada (173, 174).
Ao contrário de clorexidina, mas semelhante ao alexidina (tabela 2), PHMB provoca formação de domínio dos fosfolípidos ácidas da membrana citoplasmáticas (61-64, 172, 173, 227). Alterações de permeabilidade decorrer e aí é acreditado para ser uma função alterada de algumas enzimas associados à membrana. A seqüência de eventos durante sua interação com o envelope de célula de e. coli a proposta é a seguinte: (i) há atração rápida de PHMB em direção a negativamente carregada célula bacteriana da superfície, com forte e específica adsorção de fosfato-contendo compostos; (ii) a integridade do exterior da membrana é prejudicada e PHMB é atraído para a membrana interna; (iii) ligação de PHMB para fosfolípidos ocorre, com um aumento da permeabilidade da membrana interna (perda de K1) acompanhado de bacteriostasis; e (iv) a perda completa de membrana função segue, com precipitação de constituintes intracelulares e um efeito bactericida.
Diamidinas
Diamidinas são caracterizados quimicamente conforme descrito na tabela 1. Os sais de isotionato de dois compostos, propamidine (4,4-diaminodiphenoxypropane) e dibromopropamidina (2,2-dibromo-4,4-diamidinodiphenoxypropane), foram utilizados como agentes antibacterianos. Suas propriedades antibacterianas e utilizações foram revistas por Hugo (213) e Hugo e Russell (226). Clinicamente, diamidinas são usadas para o tratamento tópico de feridas. O mecanismo exato da ação da diamidines é desconhecido, mas eles foram apresentados para inibir a absorção de oxigênio e induzir a fuga de aminoácidos (tabela 2), como seria esperado se eles são considerados como agentes tensoativos catiônicos. Danos à célula superfície do p. aeruginosa e Enterobacter cloacae tem sido descrito (400).
Agentes derivados de Halogênios
Compostos de cloro e baseada em iodo são os mais significativos halogênios microbicidas utilizados na clínica e foram tradicionalmente utilizados para fins anti-sépticos e desinfetantes.
Agentes derivados de Cloro.
Excelente revisões que lidam com o químico, físico, e Propriedades microbiológicas de cloro-releasing agentes (CRAs) estão disponíveis (42, 130). Os tipos mais importantes de CRAs são hipoclorito de sódio, dióxido de cloro e os compostos de cloro-N como dicloroisocianurato de sódio (NaDCC), com cloramina T sendo usado em certa medida. Soluções de hipoclorito de sódio são amplamente utilizadas para desinfecção de superfície dura (bleach doméstico) e podem ser usadas para desinfecção de manchas de sangue que contenham vírus da imunodeficiência humana ou HBV. NaDCC também pode ser usado para essa finalidade e tem as vantagens da fornecendo uma maior concentração de cloro e sendo menos sensíveis à inativação por matéria orgânica. Na água, hipoclorito de sódio ioniza para produzir Na1 e o Íon hipoclorito, OCl2, que estabelece um equilíbrio com ácido hipocloroso, HOCl (42). Entre pH 4 e 7, cloro existe predominantemente como HClO, o grupo ativo, considerando acima pH9, OCl2 predomina. Embora CRAs foram utilizados predominantemente como desinfetantes de superfície dura, clorito de sódio acidificado novel (um sistema de dois componentes de ácido clorito e mandélico de sódio) tem sido descrito como um anti-séptico eficaz (248). Surpreendentemente, apesar de ser amplamente estudada, o mecanismo de ação de CRAs real não é totalmente conhecido (tabela 2). CRAs são altamente ativos agentes de oxidação e assim destruir a atividade celular de proteínas (42); a dinamização da oxidação pode ocorrer a pH baixo, onde a atividade de CRAs é máxima, embora maior penetração das camadas exteriores célula pode ser alcançada com CRAs no Estado unionizado. Ácido hipocloroso foi considerado o grupo ativo responsável pela inativação bacteriana por CRAs, o ião OCl2 tendo um efeito minuto em relação à causa HOCl (130). Isso se correlaciona com a observação de que a atividade CRA é maior quando a percentagem de causa HOCl é mais alta. Este conceito se aplica a hipocloritos, NaDCC e cloramina-T. Efeitos deletérios CRAs sobre bacteriana ADN que envolvem a formação de derivados clorados das bases nucleotide foram descritas (115, 128, 477). Ácido hipocloroso também foi encontrado a perturbar a Fosforilação oxidativa (26) e outras atividades de membrana-associado (70). Em um papel particularmente interessante, McKenna e Davies (321) descrito pelo ácido hipocloroso a inibição do crescimento bacteriano. A 50 mM (2,6 ppm), HOCl inibida completamente o crescimento de e. coli dentro de 5 min e síntese de ADN foi inibida por 96 % mas síntese de proteína foi inibida por apenas 10 a 30 %. Porque concentrações inferiores a 5 mM (260 ppm) não induzir perturbações de membrana bacteriana ou degradação de proteínas extensa, ela foi inferida que a síntese de ADN foi alvo sensível. Em contraste, o dióxido de cloro inibe a síntese de proteínas bacteriana (33). CRAs em concentrações superiores são esporicidas (44, 421, 431); isto depende do pH e da concentração de cloro (408, 412). Durante o tratamento, os esporos perdem refratividade, o Brasão de esporos separa o córtex e lise ocorre (268). Além disso, alguns estudos concluíram que esporos CRA-tratadas apresentam maior permeabilidade do Brasão de esporos (131, 268, 412). CRAs também possuem atividade virucida (34, 46, 116, 315, 394, 407, 467, 485, 486). Olivieri et al. (359) revelou que o cloro inativados f2 naked RNA ao mesmo ritmo como RNA em phage intacto, considerando f2 capsídeo proteínas poderiam ainda adsorver para o host. Taylor e Butler (504) encontrados que do RNA do vírus tipo 1 foi degradada em fragmentos por cloro, mas esse vírus inativado precedido quaisquer modificações morfológicas graves. Pelo contrário, Floyd et al. (149) e o ´ Brien e Newman (357) demonstram que o capsídeo do vírus tipo 1 foi discriminado. Claramente, ainda são necessários estudos para explicar a ação de CRAs antivirais.
Iodina e iodoforos
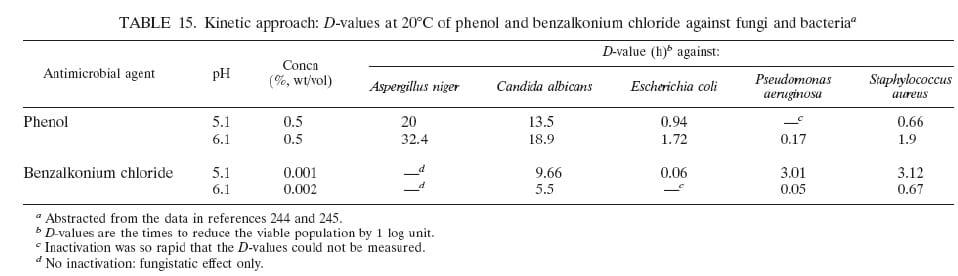
Embora menos reativo de cloro, iodo é rapidamente bactericida, fungicida, tuberculocida, virucida e esporicida (184). Soluções aquosa ou alcoólica (tintura) de iodo foram utilizadas por 150 anos como anti-sépticos, eles estão associados a irritação e coloração excessiva. Além disso, soluções aquosas são geralmente instáveis; em solução, pelo menos sete espécies de iodo estão presentes em um complexo equilíbrio, com iodo molecular (I2), sendo responsáveis pela eficácia de antimictrobianos (184). Estes problemas foram superados pelo desenvolvimento do iodoforos ("iodo transportadoras" ou "agentes de iodo-liberação"); o mais amplamente usados são povidone-iodo epolixamero-iodo em anti-sépticos e desinfetantes. Iodoforos são complexos de iodo e um agente solubilizante ou transportador, que atua como um reservatório do iodo ativo "gratuito" (184). Embora seja mantida a atividade germicida, iodoforos são considerados menos ativos contra certos fungos e esporos que as tinturas (454). Semelhante ao cloro, aação antimicrobiana de iodo é rápida, mesmo em concentrações baixas, mas o modo exato de ação é desconhecido. Iodo rapidamente penetra em microrganismos (76) e ataca os principais grupos de proteínas (em especial a freesulfuraminoácidos cisteína e metionina [184, 267]), nucleótidos e ácidos gordos (15, 184), que culmina na morte celular (184). Pouco é conhecido sobre a ação do iodo como antivirais, mas o vírus não lipidos e parvoviruses são menos sensíveis doque os lípideos de vírus envelopado (384). Da mesma forma para bactérias, é provável que as proteínas do vírus Envelopados superfície de ataques de iodo, mas eles também podem desestabilizar ácidos gordos de membrana reagindo com cadeias de carbono insaturados (486).
Compostos de Prata.
De uma forma ou de outra, prata e seus compostos tem sido muito utilizados como agentes antimicrobianos (55, 443). A prata mais importante composta atualmente em uso é sulfadiazine prata (AgSD), apesar de metal prateado, acetato de prata, nitrato de prata e proteínas de prata, os quais têm propriedades antimicrobianas, estão listados no Martindale, A farmacopeia extra (312). Nos últimos anos, compostos de prata foram utilizados para evitar a infecção de queimaduras e algumas infecções oculares e destruir as verrugas.
Nitrato de Prata.
O mecanismo da ação antimicrobiana de íons de prata está intimamente relacionado com a sua interação com tiol (sulfydryl, - SH) agrupa (32, 49, 161, 164), embora outros sítios de destino continuam a ser uma possibilidade (397, 509). Liau et al (287) demonstrou que os aminoácidos como cisteína e outros compostos comothioglycolate de sódio contendo grupos tiol neutralizam a atividade de nitrato de prata contra p. aeruginosa. Por contraste, aminoácidos, contendo obrigações Dissulfeto (SS), não-sulfurcontaining aminoácidos e compostos de enxofre contendo tais como cystathione, ácido cisteico, L-metionina, taurine, bissulfito de sódio e tiossulfato de sódio conseguiram neutralizar a atividade Ag+. Estas e outras constatações implicam que a interação de Ag com grupos de enzimas e proteínas tiol desempenha um papel fundamental na inativação bacteriana, embora outros componentes celulares podem ser envolvidos. Colagem de hidrogênio, os efeitos da quebra de hidrogenio bond agentes e a especificidade do Ag para grupos de tiol foram discutidos detalhadamente por Russell e Hugo (443) (tabela 2). Propriedades virucidas também podem ser explicadas pela vinculação a grupos -SH (510). Lukens (292) propõe que sais de prata e outros metais pesados como cobre por ligação aos principais grupos funcionais das enzimas fúngica. Ag faz com que a libertação dos íons K de microrganismos; o plasma microbiano ou membrana citoplasmáticas, com o qual está associado a muitas enzimas importantes, é um local de destino importante para a atividade de Ag (161, 329, 392, 470). Em complemento aos seus efeitos sobre enzimas, Ag produz outras variações de microrganismos. Nitrato de prata provoca marcada inibição do crescimento do Cryptococcus neoformans e é depositado no vacúolo e parede celular comogrânulos (60). Ag inibe a divisão celular e danifica o envelope de célula e o conteúdo do p. aeruginosa (398). Células bacterianas para aumentar o tamanho e a membrana citoplasmáticas, conteúdo citoplasmáticos e camadas exteriores da célula todos apresentam anomalias estruturais, embora sem qualquer blebs (protuberâncias) (398). Por último, o ião Ag+interage com ácidos nucleicos (543); ele interage preferencialmente com as bases no DNA em vez dos grupos fosfato, embora seja claro o significado em termos de sua ação letal (231, 387, 510, 547.)
Sulfadiazina de Prata.
AgSD é essencialmente uma combinação de dois agentes antibacterianos, Ag e sulfadiazine (SD). A pergunta se o efeito antibacterianos AgSD predominantemente provenha de apenas um dos compostos ou através de uma interação sinérgica tem sido levantada repetidamente. AgSD tem um amplo espectro de atividade e, diferentemente de nitrato de prata, produz blebs de superfície e de membrana em bactérias sensíveis (mas não resistentes) (96). AgSD vincula-se aos elementos de célula, incluindo ADN (332, 404). Com base numa análise química, Fox (153) propõe uma estrutura polimérica de AgSD composto de seis átomos de prata e colagem para seis moléculas SD por ligação dos átomos prata para os nitrogênios do anel pirimidina SD. Inibição bacteriana, será atingida presumivelmente quando prata vincular-se aos pares de bases suficientes na hélice de DNA, assim inibe a transcrição. Da mesma forma, suas propriedades antiphage tenham sido atribuídas para o fato de AgSD vincula à phage ADN (154, 388). Claramente, o mecanismo preciso da ação da AgSD ainda a ser resolvido.
Peroxigenios
Hidrogênio peróxido.
Hidrogênio peróxido.
Peróxido de hidrogênio (H2O2) é uma biocida amplamente usada para desinfecção, esterilização e anti-sepsia. É um líquido incolor, claro que é comercialmente disponível em uma variedade de concentrações que variam de 3 a 90 %. H2O2 é considerada biodegradável, porque ele pode degradar rapidamente na água em produtos inócuos e oxigênio. Embora soluções puras são geralmente estáveis, a maioria contêm estabilizadores para impedir a decomposição. H2O2 demonstra largo espectro de eficácia contra vírus, bactérias, leveduras e esporos de bactérias (38). Em geral, é considerado uma maior atividade contra Gram de bactérias, no entanto, a presença de catalase ou outros peroxidases, estes organismos pode aumentar tolerância na presença de concentrações inferiores. Concentrações mais elevadas de H2O2 (10 a 30 %) e tempos de contatos mais longos são necessários para a atividade esporicida (416), embora essa atividade é significativamente maior na fase gasosa. H2O2 funciona como um comburente, produzindo radicais livres de hidroxila (•OH) que atacam os componentes essenciais da célula, incluindo lípidos, proteínas e DNA. Foi proposto que os grupos expostos sulfidrila e duplas são especialmente direcionados (38).
Peracetico acido.
Ácido paracético (PAA) (CH3COOOH) é considerado uma biocida mais potente de peróxido de hidrogênio, sendo esporicida, bactericida, virucida e fungicidas em baixas concentrações (, 0,3 %) (38). PAA também se decompõe aos subprodutos seguros (ácido acético e oxigênio) mas tem as vantagens de ser isento de decomposição por peroxidases, ao contrário de H2O2 e o restante ativa na presença de cargas orgânicas (283, 308) adicionadas. Sua aplicação principal é como um esterilizante líquido de baixa temperatura para dispositivos médicos, escopos flexíveis e hemodiálises, mas também é usado como um ambiente esterilizante de superfície (100, 308). Semelhante ao H2O2, PAA provavelmente desnatura proteínas e enzimas e aumenta a permeabilidade da parede celular, interromper sulfidrila
(-SH) e sulfur obrigações (S - S) (22, 38).
(-SH) e sulfur obrigações (S - S) (22, 38).
Fenóis.
Agentes antimicrobianos fenólicos são utilizados para anti-sepsia, desinfecção ou propriedades conservantes, dependendo do composto. Ele tem sido conhecido por muitos anos (215) que, embora eles frequentemente tem sido referidos como "venenos protoplásmico gerais", têm propriedades de membrana-ativo que também contribuem para a sua atividade global (120) (tabela 2). Fenol induz progressiva fuga dos constituintes intracelular, incluindo o lançamento de K+, o primeiro índice de danos de membrana (273) e de radioatividade 14 C-rotulado e. coli (242, 265). Pulvertaft e Lumb (386) demonstram que a baixa concentração de fenóis (0.032 %, 320 mg/ml) e outros agentes (não fenólico) morrem culturas rapidamente crescentes de e. coli, estafilococos e estreptococos e concluiu que as enzimas autoliticas não estavam envolvidas. Srivastava e Thompson (487, 488) propõe que fenol atua apenas no momento da separação de pares de células da filha, com jovens células bacterianas, sendo mais sensíveis do que os antigas células de fenol. Hugo e Bloomfield (216, 217) mostraram com o fenticlor clorados bis-fenol que havia uma relação estreita entre atividade bactericida e fugas de 260 nm-absorção de materiais (vazamento sendo induzido apenas por concentrações bactericidas).
Fentichlor afetadas as atividades metabólicas de S. aureus e e. coli (217) e produzido um aumento seletivo na permeabilidade de prótons com uma consequente dissipação da força motriz Próton (PMF) e um desengate de Fosforização oxidativa (41). Clorocresol possui uma ação semelhante (124). Coagulação de constituintes citoplasmáticos em concentrações mais elevadas de fenol, que provoca danos celulares irreversíveis, foi descrita por Hugo (215). Os fenólicos possuem propriedades antifungo e antivirais. Sua ação antifungo provavelmente envolve a membrana (436), resultando em fuga dos constituintes intracelulares. Fenol não afeta a Transdução de p. aeruginosa PAO por Fago F116 (301), não tem nenhum efeito sobre phage ADN dentro do capsídeo e tem pouco efeito sobre várias das proteínas phage banda menos tratamentos de 20 minutos ou mais são usados (303, 304).
Fentichlor afetadas as atividades metabólicas de S. aureus e e. coli (217) e produzido um aumento seletivo na permeabilidade de prótons com uma consequente dissipação da força motriz Próton (PMF) e um desengate de Fosforização oxidativa (41). Clorocresol possui uma ação semelhante (124). Coagulação de constituintes citoplasmáticos em concentrações mais elevadas de fenol, que provoca danos celulares irreversíveis, foi descrita por Hugo (215). Os fenólicos possuem propriedades antifungo e antivirais. Sua ação antifungo provavelmente envolve a membrana (436), resultando em fuga dos constituintes intracelulares. Fenol não afeta a Transdução de p. aeruginosa PAO por Fago F116 (301), não tem nenhum efeito sobre phage ADN dentro do capsídeo e tem pouco efeito sobre várias das proteínas phage banda menos tratamentos de 20 minutos ou mais são usados (303, 304).
Bis-fenóis os bis-fenóis são derivados halogenados hidroxi dos dois grupos fenólicos conectados por várias pontes (191, 446). Em geral, eles apresentam eficácia e amplo-espectro mas têm pouca atividade contra p. aeruginosa e moldes e são esporostaticos na direção de esporos bacterianos. Triclosan e hexachlorophane são os biocidas mais amplamente usados neste grupo, especialmente em sabões anti-sépticos e passagens por água de mão. Ambos compostos se revelaram ter efeitos cumulativos e persistentes na pele (313).
Triclosan. triclosan (éter 2,4,49-trichloro-29-hidroxidifenilo; Irgasan DP 300) apresenta atividade específica contra bactérias gram positivas (469, 521). Sua eficácia contra bactérias gram e leveduras pode ser significativamente aprimorada pelos efeitos de formulação. Por exemplo, triclosan em combinação com EDTA causou maior permeabilidade da membrana exterior (282). Relatórios também têm sugerido que, além de suas propriedades antibacterianas, triclosan pode ter atividade anti-inflamatória (25, 522). O modo específico da ação da triclosan é desconhecido, mas foi sugerido que os principais efeitos são na membrana citoplasmáticas. Em estudos com e. coli, triclosan em concentrações sub inibitória inibe a absorção de nutrientes essenciais, enquanto as concentrações superiores, resultaram na vazão rápida dos componentes celulares e morte celular (393). Estudos com um mutante de triclosan divalente ion-dependentes de e. coli, para os quais o MIC do triclosan foi 10 vezes maior do que o de uma estirpe de tipo selvagem revelaram não há diferenças significativas no envelope total perfis de proteína, mas apresentam diferenças significativas de ácidos gordos de envelope (370). Especificamente, um proeminente 14: 1 de ácidos gordos esteve ausente na estirpe resistente, e havia pequenas diferenças em outras espécies de ácidos gordos. Foi proposto que íons divalentes e ácidos gordos podem adsorver e limitar a permeabilidade do triclosan a seu sitio de ação (370). Pequenas alterações nos perfis de ácidos gordos recentemente foram encontradas e. coli tanto S. aureus para os quais o triclosano PRM foram elevados; no entanto, os MBCs não foram afetados, sugerindo, como para outros fenóis, que os efeitos cumulativos em vários destinos contribuem para a atividade bactericida (318, 319).
Hexachlorophene. Hexaclorofeno (hexachlorophane; 2,29-dihidroxi-3,5,6,39,59,69-hexaclorodifenilmetano) é outro bis-fenol, cujo modo de ação tem sido extensivamente estudado. A ação principal de hexaclorofeno, com base em estudos com Bacillus megatherium, inibe a membrana e parte da cadeia de transporte de elétrons e os outros efeitos acima são secundários que ocorrem somente em concentrações elevadas (92, 158, 241, 481). Ela induz fugas, provoca morte de protoplastos e inibe a respiração. A concentração de limiar para a atividade bactericida da hexachlorphene é de 10 mg/ml (peso seco), mas pico de fuga em concentrações superiores a 50 mg/ml e ocorrem alterações citológicas acima de 30 mg/ml. Além disso, hexaclorofeno é bactericida a 0 ° C, apesar de causar pouco vazamento a esta temperatura.
Apesar da eficácia e largo espectro de hexaclorofeno, preocupações sobre toxicidade (256), em particular em neonatos, tem significado que sua utilização em produtos anti-sépticos foi limitada.
Apesar da eficácia e largo espectro de hexaclorofeno, preocupações sobre toxicidade (256), em particular em neonatos, tem significado que sua utilização em produtos anti-sépticos foi limitada.
Halofenóis.
Cloroxilenol (4-cloro-3,5-dimetilfenol; p-Cloro-m-xilenol) é a chave halofenol usado em formulações anti-séptica ou desinfetantes (66). Cloroxilenol é bactericida, mas p. aeruginosa e muitos moldes são altamente resistentes (66, 432).
Surpreendentemente, o seu mecanismo de ação tenha sido pouco estudado apesar de sua utilização generalizada ao longo de muitos anos. Devido à sua natureza fenólica, é esperado ter um efeito nas membranas microbianas.
Surpreendentemente, o seu mecanismo de ação tenha sido pouco estudado apesar de sua utilização generalizada ao longo de muitos anos. Devido à sua natureza fenólica, é esperado ter um efeito nas membranas microbianas.
Quaternários de Amônia.
Agentes tensoativos (tensoativos) tem duas regiões em suas estruturas moleculares, um hidrocarboneto, grupos impermeáveis (hidrofóbico) e o outro um grupo captação de água (hidrofílicos ou polar). Dependendo do encargo ou ausência de ionização do grupo hidrófila, tensoativos classificam-se em catiônicos, aniônicos, não iônico e compostos anfolitos (anfotéricos). Destes, os agentes catiônicos, como ilustrado por compostos de amônio quaternário (QACs), são as mais úteis anti-sépticos e desinfetantes (160). Às vezes, eles são conhecidos como detergentes ativadores. QACs foram utilizados para uma variedade de efeitos clínicos (por exemplo, desinfecção preoperativa, a aplicação de membranas mucosas e desinfecção de superfícies não críticas). Além de ter propriedades antimicrobianas, QACs
também são excelentes para limpeza e desodorização de superfície dura. É conhecido há muitos anos que QACs são agentes ativos na membrana (221) (tabela 2) (isto é, com um sitio de destino predominantemente na membrana citoplasmáticas (interior) em bactérias ou a membrana de plasma em leveduras) (215). Salton (460) propôs a seguinte seqüência de eventos com microrganismos expostos a agentes ativadores: (I) a adsorção e penetração do agente na parede da célula; (ii) reação com a membrana citoplasmática (lípidos ou proteínas) seguido de desorganização da membrana; (iii) a fuga dos materiais de baixa massa molecular intracelular; (iv) a degradação das proteínas e ácidos nucleicos; e (v) a parede lise causado pelas enzimas autoliticas. Assim, há uma perda de organização estrutural e integridade da membrana citoplasmática em bactérias, juntamente com outros malefícios para a célula bacteriana (120). Informações úteis sobre a seletividade da ação de membrana podem ser obtidas por estudar os efeitos de biocidas para protoplastos e esferoplastos suspensas em diversos solutos. QACs causam morte de esferoplastos e protoplastos suspensos em sacarose (107, 215, 243, 428). Os agentes ativadores reagem com componentes de fosfolípidos na membrana citoplasmáticas (69), produzindo assim a distorção de membrana e morte dos protoplastos sob estresse azul.
Membranas isoladas não sofrem desagregação a exposição ao QACs, porque não é suficientemente drástica a distorção de membrana. Os agentes não-QAC CTP e trichlorosalicylanide têm efeitos específicos: TCC induz morte de protoplastos em cloreto de amônio pela crescente de permeabilidade de Cl-, considerando trichlorosalicylanide induz lise de nitrato de amônio, aumentando a permeabilidade NO3- (428). Em contraste, QACs (e clorexidina) induzem lise de protoplastos ou esferoplastos suspensos em vários solutos porque elas afetam generalizadamente, em vez de específicos, danos da membrana. A membrana citoplasmática bacteriana fornece o mecanismo pelo qual metabolismo está ligado a soluto transporte, movimentação flagelar e a geração de ATP. Prótons são deslocados para o exterior da célula bacteriana durante o metabolismo. O potencial combinado (concentração ou efeito azul o próton e sua Eletro positividade) é a PMF, que orienta a estas atividades auxiliares (428). O cetrimide QAC foi encontrado (121) para ter um efeito sobre o FPP em S. aureus. A sua concentração bacteriostática, cetrimide causou a quitação do componente pH do FPP e também produziu a quantidade máxima de 260 nm-absorção de materiais. QACs também causam danos a membrana exterior de bactérias gram, promovendo sua própria fixação. Este aspecto da QACs é considerado abaixo (ver "intrínsecas resistência das bactérias gram-"). O cloreto de cetylpyridium QAC (CPC) induz a fuga de K e pentose material proveniente da levedura S. cerevisiae e induz lise protoplastos, bem como interagir com a seiva bruta de célula (205). No entanto, diferentemente de clorexidina, não foi observado nenhum efeito bifásico sobre lise protoplastos. O efeito tóxico inicial QACs em células de leveduras é uma desorganização das membranas plasma, com estruturas de lípidos organizados em das membranas (e lípidos bilayers) sendo interrompida. QACs esporostatico; eles inibam o desdobramento dos esporos (o desenvolvimento de uma célula vegetativa de um germinação de esporos) mas não os processos reais de germinação (desenvolvimento de dormência para um estado ativo metabolismo), embora por um mecanismo desconhecido (414). Da mesma forma, os QACs não são micobactericida, mas têm uma ação micobacteriostatica, embora os efeitos reais sobre micobactérias foram pouco estudadas (419). Os QACs tem um efeito de lípideos, envolta (incluindo vírus da imunodeficiência humana e HBV) mas não envelopados vírus (394, 485, 486). Produtos baseados em QAC induzem a desintegração e alterações morfológicas do HBV humana, resultando em perda de infecciosidade (382). Em estudos com diferentes phages (298-301, 303-305, 307), o CPC inibida transdução por Fago F116 significativamente e inativados as partículas phage. Além disso, o CPC alterou as bandas de proteína do F116 mas não afetou o phage ADN dentro do capsídeo.
também são excelentes para limpeza e desodorização de superfície dura. É conhecido há muitos anos que QACs são agentes ativos na membrana (221) (tabela 2) (isto é, com um sitio de destino predominantemente na membrana citoplasmáticas (interior) em bactérias ou a membrana de plasma em leveduras) (215). Salton (460) propôs a seguinte seqüência de eventos com microrganismos expostos a agentes ativadores: (I) a adsorção e penetração do agente na parede da célula; (ii) reação com a membrana citoplasmática (lípidos ou proteínas) seguido de desorganização da membrana; (iii) a fuga dos materiais de baixa massa molecular intracelular; (iv) a degradação das proteínas e ácidos nucleicos; e (v) a parede lise causado pelas enzimas autoliticas. Assim, há uma perda de organização estrutural e integridade da membrana citoplasmática em bactérias, juntamente com outros malefícios para a célula bacteriana (120). Informações úteis sobre a seletividade da ação de membrana podem ser obtidas por estudar os efeitos de biocidas para protoplastos e esferoplastos suspensas em diversos solutos. QACs causam morte de esferoplastos e protoplastos suspensos em sacarose (107, 215, 243, 428). Os agentes ativadores reagem com componentes de fosfolípidos na membrana citoplasmáticas (69), produzindo assim a distorção de membrana e morte dos protoplastos sob estresse azul.
Membranas isoladas não sofrem desagregação a exposição ao QACs, porque não é suficientemente drástica a distorção de membrana. Os agentes não-QAC CTP e trichlorosalicylanide têm efeitos específicos: TCC induz morte de protoplastos em cloreto de amônio pela crescente de permeabilidade de Cl-, considerando trichlorosalicylanide induz lise de nitrato de amônio, aumentando a permeabilidade NO3- (428). Em contraste, QACs (e clorexidina) induzem lise de protoplastos ou esferoplastos suspensos em vários solutos porque elas afetam generalizadamente, em vez de específicos, danos da membrana. A membrana citoplasmática bacteriana fornece o mecanismo pelo qual metabolismo está ligado a soluto transporte, movimentação flagelar e a geração de ATP. Prótons são deslocados para o exterior da célula bacteriana durante o metabolismo. O potencial combinado (concentração ou efeito azul o próton e sua Eletro positividade) é a PMF, que orienta a estas atividades auxiliares (428). O cetrimide QAC foi encontrado (121) para ter um efeito sobre o FPP em S. aureus. A sua concentração bacteriostática, cetrimide causou a quitação do componente pH do FPP e também produziu a quantidade máxima de 260 nm-absorção de materiais. QACs também causam danos a membrana exterior de bactérias gram, promovendo sua própria fixação. Este aspecto da QACs é considerado abaixo (ver "intrínsecas resistência das bactérias gram-"). O cloreto de cetylpyridium QAC (CPC) induz a fuga de K e pentose material proveniente da levedura S. cerevisiae e induz lise protoplastos, bem como interagir com a seiva bruta de célula (205). No entanto, diferentemente de clorexidina, não foi observado nenhum efeito bifásico sobre lise protoplastos. O efeito tóxico inicial QACs em células de leveduras é uma desorganização das membranas plasma, com estruturas de lípidos organizados em das membranas (e lípidos bilayers) sendo interrompida. QACs esporostatico; eles inibam o desdobramento dos esporos (o desenvolvimento de uma célula vegetativa de um germinação de esporos) mas não os processos reais de germinação (desenvolvimento de dormência para um estado ativo metabolismo), embora por um mecanismo desconhecido (414). Da mesma forma, os QACs não são micobactericida, mas têm uma ação micobacteriostatica, embora os efeitos reais sobre micobactérias foram pouco estudadas (419). Os QACs tem um efeito de lípideos, envolta (incluindo vírus da imunodeficiência humana e HBV) mas não envelopados vírus (394, 485, 486). Produtos baseados em QAC induzem a desintegração e alterações morfológicas do HBV humana, resultando em perda de infecciosidade (382). Em estudos com diferentes phages (298-301, 303-305, 307), o CPC inibida transdução por Fago F116 significativamente e inativados as partículas phage. Além disso, o CPC alterou as bandas de proteína do F116 mas não afetou o phage ADN dentro do capsídeo.
Vapor Fase Esterilizantes.
Muitos dispositivos médicos sensíveis ao calor e suprimentos cirúrgicos podem ser esterilizados de forma eficaz por esterilizantes (em especial glutaraldeído, PAA e peróxido de hidrogênio) ou por sistemas de esterilização fase vapor (Tabela 1). Os agentes ativos mais amplamente usados nesses sistemas "frios" são: óxido de etileno, formaldeído e, mais recentemente desenvolvidos, peróxido de hidrogênio e PAA. Óxido de etileno e formaldeído são ambos de largo epectro e agentes alcalinizantes. No entanto, sua atividade é dependente da concentração de ativo, da temperatura, da duração da exposição e da umidade relativa (87). Como agentes de alcalinização, elas atacam proteínas, ácidos nucleicos e outros compostos orgânicos; ambos são particularmente reativos com sulfidrilas e outros grupos de reação enzimática. Gás deóxido de etileno tem as desvantagens de ser mutagênico e explosivo, mas não geralmente sobre equipamentos sensíveis e resíduos tóxicos do procedimento de esterilização podem ser eliminados rotineiramente com arejamento correto. Gás de formaldeído é semelhante e tem a vantagem adicional de serem não explosivo, mas não é amplamente usado em cuidados de saúde, é cancerígeno. Fase de vapor de água oxigenada e PAA são considerados mais ativos (oxidantes) em concentrações inferiores que na forma líquida (334). Dois agentes ativos são usadas em combinação com gás plasma em sistemas de esterilização de baixa temperatura (314). Suas principais vantagens sobre outros sistemas de vapor-fase incluem baixa toxicidade, uma ação rápida e atividade a temperatura inferior; as desvantagens incluem aplicativos elimitação de penetrabilidade.
MECANISMOS de RESISTÊNCIA.
Introdução
Tal como acima referido, diferentes tipos de microrganismos variam na sua resposta ao anti-sépticos e desinfetantes. Isso é devido a estrutura celular diferente, composição e fisiologia. Tradicionalmente, susceptibilidade anti-sépticos e desinfetantes foi classificada como base nessas diferenças; com trabalho recente, esta classificação pode ser ainda mais alargada (Figura 1). Porque diferentes tipos de organismos reagem de forma diferente, é conveniente considerar bactérias, fungos, vírus, protozoários e priões separadamente.
Bactérias - Resistência aos Anti-sépticos e Desinfetantes.
Nos últimos anos, consideráveis progressos na compreensão mais plenamente as respostas dos diferentes tipos de bactérias (micobactérias, bactérias não esporuladas e esporos bacterianos) para agentes antibacterianos (43, 84, 414, 415, 419, 422, 496). Como resultado, resistência pode ser tanto uma propriedade natural de um organismo (intrínseca) ou adquiridos por mutação ou aquisição de plasmídeos (DNA auto-replicação, extracromosomal) ou transportes (cromossômica ou plasmídeos integrando, transmissíveis de cassetes de DNA). Resistência intrínseca é demonstrada por bactérias gram negativa, esporos bacterianos micobactérias e, sob certas condições, estafilococos (quadro 5). Resistência de plasmídeos adquiridos, é mais amplamente associada com compostos de mercúrio e outros sais metálicos. Nos últimos anos, foi observada resistência adquirida para determinados outros tipos de biocidas, nomeadamente estafilococos.
Intrínseca Bacterial - Mecanismos Resistência.
Para uma molécula anti-séptica ou desinfetante chegar a seu site de destino, as camadas externas de uma célula devem ser ultrapassadas. A natureza e a composição dessas camadas dependem do tipo de organismo e podem atuar como uma barreira de permeabilidade, na qual pode haver uma absorção reduzida (422, 428). Como alternativa, mas menos comumente, constituivelmente sintetizadas, enzimas podem trazer sobre a degradação de um composto (43, 214, 358). Resistência (inato) intrínseca Fig. 1. Ordem decrescente de resistência anti-sépticos e desinfetantes. O asterisco indica que as conclusões não são ainda universalmente acordadas. É, portanto, uma propriedade natural e cromosomalmente controlada de uma célula bacteriana que lhe permite contornar a ação de um anti-séptico ou desinfetante. Bactérias gramnegativas tendem a ser mais resistente dos organismos Gram, tais como estafilococos (quadro 6).
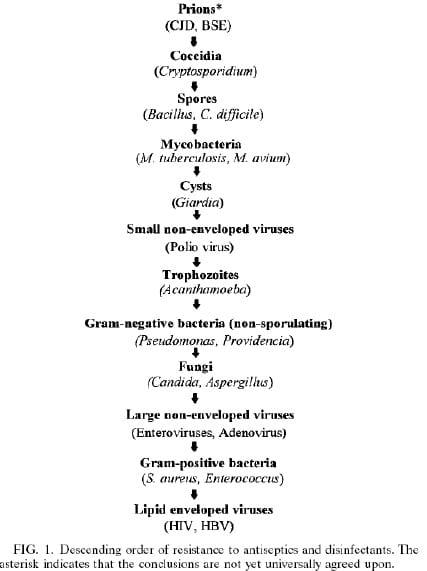

Intrinsica resistencia de esporos bacterianos.
Esporos bacterianos dos gêneros Bacillus e Clostridium tem sido amplamente estudados e são invariavelmente os mais resistentes de todos os tipos de bactérias anti-sépticos e desinfetantes (43, 46, 150, 414, 418, 420, 422, 423, 457). Embora geralmente não são Bacillus patogênicos, seus esporos são amplamente utilizados como indicadores de esterilização eficiente. Clostridium são agentes patogênicos significativos; por exemplo, C. difficile é a causa mais comum de diarréia hospitalar (478). Muitos produtos biocidas são bactericidas ou bacteriostáticos em baixas concentrações de bactérias não esporuladas, incluindo as células vegetativas da espécie Bacillus e Clostridium, mas concentrações elevadas pode ser necessárias para obter um efeito esporicida (por exemplo, para glutaraldeído e CRAs).
Pelo contrário, ainda elevadas concentrações de álcool, fenólicos, QACs e clorexidina carecem de um efeito de esporicida, embora isto pode ser conseguido quando estes compostos são usados a temperaturas elevadas (475). Um típico esporo tem uma estrutura complexa (29, 151). Em suma, as células germinativas (protoplastos ou núcleo) e paredes de células germinativas são rodeados do córtex, fora que são os Casacos de esporos de interior e exterior. Uma fina exosporium pode estar presente os esporos de algumas espécies, mas pode envolver apenas um Brasão de esporos. RNA, DNA e DPA, bem como a maioria do cálcio, potássio, manganês e fósforo, está presente no protoplastos esporos. Também estão presentes grandes quantidades de proteínas básicas baixa massa molecular (pequenas esporos solúveis em ácido proteínas [SASPs]), que são rapidamente degradadas durante a germinação. O córtex consiste em grande parte peptidoglicano, incluindo um lactâmico de muramico específicos de esporos. Os Casacos de esporos constituem uma parte importante dos esporos. Estas estruturas consistem principalmente de proteínas, com uma fração álcalis solúvel composta por Polipeptídeos ácidos, sendo encontrados no Brasão do interior e uma fração alcalina resistente associada com a presença de obrigações Dissulfeto rico sendo encontrado no Brasão do exterior. Estes aspectos, especialmente as funções do coat(s) e do córtex, são todos relevantes para o mecanismo(s) da resistência apresentada pelos esporos bacterianos anti-sépticos e desinfetantes. Várias técnicas estão disponíveis para estudar mecanismos de resistência de esporos (428). Eles incluem removendo o Brasão de esporos e córtex, usando uma técnica de "step-down" para alcançar um esporulação altamente síncrona (de modo que as alterações celulares podem ser monitoradas com precisão), empregando esporos mutantes que não esporuladas para além dos estágios geneticamente determinados em esporulação, adicionando um anti-séptico ou um desinfetante no início da esporulação e determinar o quão longe o processo podem prosseguir e analisar o papel dos SASPs. Tais procedimentos ajudaram a fornecer uma quantidade considerável de informações úteis. Esporulação propriamente dita é um processo no qual uma célula vegetativa desenvolve em esporos e envolve sete estágios (designados 0 a VII). Durante esse processo, a célula vegetativa (fase 0) sofre uma série de modificações morfológicas que culminan na libertação de uma maturidade esporos (fase VII). Fases (desenvolvimento de córtex) IV a VII são os mais importantes no desenvolvimento de resistência aos biocidas. Resistência à anti-sépticos e desinfetantes se desenvolve durante esporulação e pode ser um evento inicial, intermediário ou tardio (muito) (103, 375, 378, 429, 474). Marcadores úteis para acompanhamento do desenvolvimento de resistência são tolueno (resistência aos quais é um evento precoce), calor (intermediário) e lisozima (tardia) (236, 237). Estudos com um subtilis B. de tipo selvagem da estirpe, 168 e seus mutantes Spo- ajudaram a determinar as fases em que se desenvolve resistência (262, 375, 474). Estes estudos (Fig. 2), a ordem do desenvolvimento da resistência era tolueno (marcador), formaldeído, sulfato laurílico de sódio, fenol e nitrato fenilmercúrico; m-cresol, clorocresol, gluconato de clorexidina, cloreto de cetilpiridinium e cloreto de mercúrio; e calor úmido (marcador), dicloroisocianurato de sódio, hipoclorito de sódio, lisozima (marcador) e glutaraldeído. Assim, é demonstrada a associação da superveniência da resistência a um
determinado anti-séptico ou desinfetante com um estagio(s) especial no desenvolvimento de esporos. Formulários de Brasão-menos de esporos, produzidos por tratamento de esporos. Condições alcalinas com uréia plus ditiotreitol acrescido de sódio laurílico sulfato (UDS), foram também de valor em estimar o papel dos casacos em limitar o acesso de anti-sépticos e desinfetantes aos seus sites de destino. No entanto, Bloomfield e Arthur (44, 45) e Bloomfield (43) demonstraram que este tratamento também remove certa quantidade de córtex e que o montante do córtex restante pode ainda ser reduzida pela utilização subsequente de lisozima. Estas conclusões demonstram que os Casacos de esporos têm um papel inquestionável no que conferem resistência, mas que o córtex é também uma barreira importante desde (UDS mais lisozina) - esporos tratados são muito mais sensíveis aos agentes de iodo-liberação de clorinas que estão expostas ao UDS esporos. O desenvolvimento inicial e a data de vencimento do córtex estão implicados no desenvolvimento de resistência aos fenólicos. Da mesma forma, agora é claro que o desenvolvimento do córtex, pelo menos, é parcialmente responsável por resistência clorexidina e QACs; esta resistência é aprimorada no desenvolvimento de esporos pelo início do Brasão de síntese esporos (262). O efeito de diferentes concentrações de clorexidina, subletais às bactérias vegetativas, no desenvolvimento de esporos do B. subtilis 168 MB2 foram investigados pela Knott e Russell (261). Eles descobriram que desenvolvimento de esporos de clorexidina afetado; as concentrações da hexametilenobiguanida aumentada, valores de índice de esporos (a porcentagem de células formando esporos) diminuíram e aumento da sensibilidade ao calor e tolueno. Por outro lado, a cultura de controle (não tratada) foi altamente resistente a ambos estes agentes e tinha um valor de índice elevado de esporos, indicativo de níveis elevados de esporos maduros. Ligeiramente maior resistência à tolueno comparado a resistência ao calor não foi surpreendente, uma vez que as células devem chegar fases V, VI (síntese de Casacos de esporos e maturação) para atingir a resistência ao calor, mas apenas a fase III (um com a forespore duração) para atingir a resistência de tolueno (Fig. 2); em outras palavras, se esporulação é inibida por clorexidina, mais células são susceptíveis de atingir a fase III que as fases posteriores. Embora menos definitivo que as abordagens anteriores, estes procedimentos fornecem mais provas do envolvimento do córtex e casacos na resistência de clorexidina. Desenvolvimento de resistência durante esporulação para formaldeído foi um evento precoce, mas dependia em certa medida a concentração (1 a 5 % [vol/vol]) de formaldeído utilizado. Isso parece estar em contradição com o desenvolvimento extremamente tardio de resistência a dialdeido, glutaraldeído. Desde glutaraldeído e o monoaldeido, formaldeído, contêm um grupo aldeído (s) e são agentes alcalinizantes, seria plausível para supor que eles teriam um modo semelhante de ação esporicida, embora o dialdeido seja um agente alcalinizante mais potente. Se isto fosse verdade, ele poderia também ser assumido que os esporos iriam expor os mesmos mecanismos de resistência para estes desinfetantes. Em solução aquosa, formaldeído faz um glicol em equilíbrio (512, 524); assim, formaldeído poderia bem ser agindo mal como desinfetante um tipo de álcool, em vez de um aldeído (327). Glutaraldeído alcalino não forma prontamente glicóis em solução aquosa (178). Resistência ao formaldeído pode estar ligada à maturação do córtex e resistência ao glutaraldeído pode ser lin Setlow e seus colegas de trabalho (472) demonstram que Brasão de SASPs um/b-tipo o DNA no tipo selvagem e esporos do B. subtilis, assim protegê-lo contra ataques por enzimas e agentes antimicrobianos. Esporos (a2b2) estas falta um/btipo SASPs são significativamente mais sensíveis aos hipoclorito (456) de peróxido de hidrogênio (471). Assim, SASPs contribuem para a resistência de esporos de hipoclorito de peróxido, mas pode não ser os únicos fatores envolvidos, desde os casacos e córtex também desempenham um papel (428). Dois outros aspectos de esporos devem ser considerados: o relançamento dos esporos feridos e os efeitos de anti-sépticos e desinfetantes sobre germinação e ultrapassando esporos. Embora nenhum aspecto verdadeiramente é um mecanismo de resistência, cada um pode fornecer informações úteis sobre o sitio e o mecanismo de ação dos agentes esporicidas e sobre os esporos associados mecanismos de resistência e pode ser de importância clínica. O relançamento dos desinfetantes tratados esporos não tenha sido amplamente estudado. Spicher e Peters (483, 484) demonstram que poderiam ser ressuscitados exposição de esporos ao formaldeído (B. subtilis) após um processo de choque térmico subseqüentes. Uma constatação mais recente com stearothermophilus B. lança mais dúvidas sobre a eficácia do vapor de baixa temperatura com formaldeído como um procedimento esterilizante (541). O relançamento dos esporos expostos ao formaldeído, cloro, iodo e glutaraldeído foi examinado por Russell e seus colegas (103, 376, 377, 424, 532-537). Uma pequena proporção dos esporos glutaraldeído-tratados de várias espécies de Bacillus foram reavivados quando os esporos foram tratados com alcalinos após neutralização dos glutaraldeído com glicina (103, 379, 380). Experiências projetadas para distinguir entre germinação e desdobramento no processo de renascimento demonstraram que o relançamento induzidas pelo hidróxido de sódio aumenta o potencial de germinação. Com base em outras conclusões, no processo de germinação é também implicado no relançamento dos esporos expostos a outras desinfetantes.
Pelo contrário, ainda elevadas concentrações de álcool, fenólicos, QACs e clorexidina carecem de um efeito de esporicida, embora isto pode ser conseguido quando estes compostos são usados a temperaturas elevadas (475). Um típico esporo tem uma estrutura complexa (29, 151). Em suma, as células germinativas (protoplastos ou núcleo) e paredes de células germinativas são rodeados do córtex, fora que são os Casacos de esporos de interior e exterior. Uma fina exosporium pode estar presente os esporos de algumas espécies, mas pode envolver apenas um Brasão de esporos. RNA, DNA e DPA, bem como a maioria do cálcio, potássio, manganês e fósforo, está presente no protoplastos esporos. Também estão presentes grandes quantidades de proteínas básicas baixa massa molecular (pequenas esporos solúveis em ácido proteínas [SASPs]), que são rapidamente degradadas durante a germinação. O córtex consiste em grande parte peptidoglicano, incluindo um lactâmico de muramico específicos de esporos. Os Casacos de esporos constituem uma parte importante dos esporos. Estas estruturas consistem principalmente de proteínas, com uma fração álcalis solúvel composta por Polipeptídeos ácidos, sendo encontrados no Brasão do interior e uma fração alcalina resistente associada com a presença de obrigações Dissulfeto rico sendo encontrado no Brasão do exterior. Estes aspectos, especialmente as funções do coat(s) e do córtex, são todos relevantes para o mecanismo(s) da resistência apresentada pelos esporos bacterianos anti-sépticos e desinfetantes. Várias técnicas estão disponíveis para estudar mecanismos de resistência de esporos (428). Eles incluem removendo o Brasão de esporos e córtex, usando uma técnica de "step-down" para alcançar um esporulação altamente síncrona (de modo que as alterações celulares podem ser monitoradas com precisão), empregando esporos mutantes que não esporuladas para além dos estágios geneticamente determinados em esporulação, adicionando um anti-séptico ou um desinfetante no início da esporulação e determinar o quão longe o processo podem prosseguir e analisar o papel dos SASPs. Tais procedimentos ajudaram a fornecer uma quantidade considerável de informações úteis. Esporulação propriamente dita é um processo no qual uma célula vegetativa desenvolve em esporos e envolve sete estágios (designados 0 a VII). Durante esse processo, a célula vegetativa (fase 0) sofre uma série de modificações morfológicas que culminan na libertação de uma maturidade esporos (fase VII). Fases (desenvolvimento de córtex) IV a VII são os mais importantes no desenvolvimento de resistência aos biocidas. Resistência à anti-sépticos e desinfetantes se desenvolve durante esporulação e pode ser um evento inicial, intermediário ou tardio (muito) (103, 375, 378, 429, 474). Marcadores úteis para acompanhamento do desenvolvimento de resistência são tolueno (resistência aos quais é um evento precoce), calor (intermediário) e lisozima (tardia) (236, 237). Estudos com um subtilis B. de tipo selvagem da estirpe, 168 e seus mutantes Spo- ajudaram a determinar as fases em que se desenvolve resistência (262, 375, 474). Estes estudos (Fig. 2), a ordem do desenvolvimento da resistência era tolueno (marcador), formaldeído, sulfato laurílico de sódio, fenol e nitrato fenilmercúrico; m-cresol, clorocresol, gluconato de clorexidina, cloreto de cetilpiridinium e cloreto de mercúrio; e calor úmido (marcador), dicloroisocianurato de sódio, hipoclorito de sódio, lisozima (marcador) e glutaraldeído. Assim, é demonstrada a associação da superveniência da resistência a um
determinado anti-séptico ou desinfetante com um estagio(s) especial no desenvolvimento de esporos. Formulários de Brasão-menos de esporos, produzidos por tratamento de esporos. Condições alcalinas com uréia plus ditiotreitol acrescido de sódio laurílico sulfato (UDS), foram também de valor em estimar o papel dos casacos em limitar o acesso de anti-sépticos e desinfetantes aos seus sites de destino. No entanto, Bloomfield e Arthur (44, 45) e Bloomfield (43) demonstraram que este tratamento também remove certa quantidade de córtex e que o montante do córtex restante pode ainda ser reduzida pela utilização subsequente de lisozima. Estas conclusões demonstram que os Casacos de esporos têm um papel inquestionável no que conferem resistência, mas que o córtex é também uma barreira importante desde (UDS mais lisozina) - esporos tratados são muito mais sensíveis aos agentes de iodo-liberação de clorinas que estão expostas ao UDS esporos. O desenvolvimento inicial e a data de vencimento do córtex estão implicados no desenvolvimento de resistência aos fenólicos. Da mesma forma, agora é claro que o desenvolvimento do córtex, pelo menos, é parcialmente responsável por resistência clorexidina e QACs; esta resistência é aprimorada no desenvolvimento de esporos pelo início do Brasão de síntese esporos (262). O efeito de diferentes concentrações de clorexidina, subletais às bactérias vegetativas, no desenvolvimento de esporos do B. subtilis 168 MB2 foram investigados pela Knott e Russell (261). Eles descobriram que desenvolvimento de esporos de clorexidina afetado; as concentrações da hexametilenobiguanida aumentada, valores de índice de esporos (a porcentagem de células formando esporos) diminuíram e aumento da sensibilidade ao calor e tolueno. Por outro lado, a cultura de controle (não tratada) foi altamente resistente a ambos estes agentes e tinha um valor de índice elevado de esporos, indicativo de níveis elevados de esporos maduros. Ligeiramente maior resistência à tolueno comparado a resistência ao calor não foi surpreendente, uma vez que as células devem chegar fases V, VI (síntese de Casacos de esporos e maturação) para atingir a resistência ao calor, mas apenas a fase III (um com a forespore duração) para atingir a resistência de tolueno (Fig. 2); em outras palavras, se esporulação é inibida por clorexidina, mais células são susceptíveis de atingir a fase III que as fases posteriores. Embora menos definitivo que as abordagens anteriores, estes procedimentos fornecem mais provas do envolvimento do córtex e casacos na resistência de clorexidina. Desenvolvimento de resistência durante esporulação para formaldeído foi um evento precoce, mas dependia em certa medida a concentração (1 a 5 % [vol/vol]) de formaldeído utilizado. Isso parece estar em contradição com o desenvolvimento extremamente tardio de resistência a dialdeido, glutaraldeído. Desde glutaraldeído e o monoaldeido, formaldeído, contêm um grupo aldeído (s) e são agentes alcalinizantes, seria plausível para supor que eles teriam um modo semelhante de ação esporicida, embora o dialdeido seja um agente alcalinizante mais potente. Se isto fosse verdade, ele poderia também ser assumido que os esporos iriam expor os mesmos mecanismos de resistência para estes desinfetantes. Em solução aquosa, formaldeído faz um glicol em equilíbrio (512, 524); assim, formaldeído poderia bem ser agindo mal como desinfetante um tipo de álcool, em vez de um aldeído (327). Glutaraldeído alcalino não forma prontamente glicóis em solução aquosa (178). Resistência ao formaldeído pode estar ligada à maturação do córtex e resistência ao glutaraldeído pode ser lin Setlow e seus colegas de trabalho (472) demonstram que Brasão de SASPs um/b-tipo o DNA no tipo selvagem e esporos do B. subtilis, assim protegê-lo contra ataques por enzimas e agentes antimicrobianos. Esporos (a2b2) estas falta um/btipo SASPs são significativamente mais sensíveis aos hipoclorito (456) de peróxido de hidrogênio (471). Assim, SASPs contribuem para a resistência de esporos de hipoclorito de peróxido, mas pode não ser os únicos fatores envolvidos, desde os casacos e córtex também desempenham um papel (428). Dois outros aspectos de esporos devem ser considerados: o relançamento dos esporos feridos e os efeitos de anti-sépticos e desinfetantes sobre germinação e ultrapassando esporos. Embora nenhum aspecto verdadeiramente é um mecanismo de resistência, cada um pode fornecer informações úteis sobre o sitio e o mecanismo de ação dos agentes esporicidas e sobre os esporos associados mecanismos de resistência e pode ser de importância clínica. O relançamento dos desinfetantes tratados esporos não tenha sido amplamente estudado. Spicher e Peters (483, 484) demonstram que poderiam ser ressuscitados exposição de esporos ao formaldeído (B. subtilis) após um processo de choque térmico subseqüentes. Uma constatação mais recente com stearothermophilus B. lança mais dúvidas sobre a eficácia do vapor de baixa temperatura com formaldeído como um procedimento esterilizante (541). O relançamento dos esporos expostos ao formaldeído, cloro, iodo e glutaraldeído foi examinado por Russell e seus colegas (103, 376, 377, 424, 532-537). Uma pequena proporção dos esporos glutaraldeído-tratados de várias espécies de Bacillus foram reavivados quando os esporos foram tratados com alcalinos após neutralização dos glutaraldeído com glicina (103, 379, 380). Experiências projetadas para distinguir entre germinação e desdobramento no processo de renascimento demonstraram que o relançamento induzidas pelo hidróxido de sódio aumenta o potencial de germinação. Com base em outras conclusões, no processo de germinação é também implicado no relançamento dos esporos expostos a outras desinfetantes.
Resistência Intrínseca de Micobactéria.
Micobactérias são bem conhecidas de possuir uma resistência ao anti-sépticos e desinfetantes que é aproximadamente intermediária entre aqueles de outras bactérias não esporuladas e esporos de bactérias (Fig. 1) (177, 345, 419). Não há provas de que a degradação enzimática de moléculas prejudiciais se realiza. O mecanismo mais provável para a alta resistência das micobactérias está associado com suas paredes de célula complexas que oferecem uma barreira eficaz à entrada desses agentes. Até à data, mediada por plasmídeos ou Transposão resistência aos biocidas não foi demonstrada em micobactérias. A parede celular micobacteriana é uma estrutura altamente hidrofóbica com um esqueleto de mycoylarabinogalactan-peptidoglicano (27, 105, 106, 322, 389, 390, 461, 530). O peptidoglicano covalente está ligado ao polissacarídeo copolímero (arabinogalactan), composta por arabinose e galactose esterificada de ácidos micolico. Também presentes são complexos de lípidos e proteínas, incluindo porin canais através dos quais moléculas hidrofílicas podem difusas na célula (232, 356) lipopolysaccharides (LPSs). Estruturas de parede celular semelhantes existem em todas as espécies micobacteriana examinadas até a data (228). A composição de paredes celulares de uma determinada espécie pode ser influenciada por seu nicho ambiental (27). Bactérias patogênicas, como a tuberculose Mycobacterium existirem em um ambiente relativamente rico em nutrientes, Considerando a micobactéria saprofíticos vivem no solo ou água é expostas a antibióticos naturais e tende a ser mais intrinsicamente resistentes a estas drogas. Anti-sépticos ou desinfetante que apresentam atividade micobacteriana são fenol, PAA, peróxido de hidrogênio, álcool e glutaraldeído (16, 17, 99, 419, 425, 455). Por contraste, outro conhecido agente bactericida, como clorexidina e QACs, são
micobacteristaticos mesmo quando usado em concentrações elevadas (51, 52, 419, 425, 455). No entanto, a atividade destes pode ser aumentada substancialmente por efeitos de formulação. Assim, uma série de produtos baseados em QAC, afirmam ter atividade micobacteriana. Por exemplo, é uma formulação mais recente (Sactimed-I-Sinald) que contém uma mistura de alquil poliguanidas e QACs alquil pretendia ser micobactericida (211, 353). No entanto, há algumas dúvidas se os agentes antibacterianos tinham sido adequadamente mortos ou neutralizados para impedir que a transição das concentrações inibitórias em mídia de recuperação. Há muitos anos, ele foi proposto (T. H. Shen, citado na referência 99) que a resistência das micobactérias para QACs estava coligada com o teor de lípidos da parede da célula. Em apoio desta disputa, Mycobacterium phlei, que tem um teor de lípideos célula total baixa, foi mais sensível do que o M. tuberculosis, que tem um maior teor de lípideos. Também foi observado que a resistência de várias espécies de micobactérias estava relacionada ao conteúdo do material cerosa na parede. Agora é conhecido que devido à natureza altamente hidrófobo da parede da célula, biocidas hidrofílicos geralmente conseguem penetrar na parede da célula micobacteriana em concentrações suficientemente elevadas para produzir um efeito letal. No entanto, baixas concentrações de anti-sépticos e desinfetantes, como clorexidina presumivelmente devem atravessar essa barreira de permeabilidade, porque o PRM é da mesma ordem que essas concentrações inibem o crescimento de estirpes de não micobactérias como S. aureus, (51, 52) Embora M. avium-intracellulare pode ser particularmente resistente. Os componentes de ação na parede da célula micobacteriana responsável ao biocida de alta resistência são atualmente desconhecidos, embora algumas informações estão disponíveis. Inibidores de síntese da parede celular aumentam a susceptibilidade de M. avium à droga (391); a inibição da myocide C, arabinogalactan e mycolic ácido biossíntese aprimora a susceptibilidade de droga. Tratamento deste organismo com m-fluoro-DL-fenilalanina (m-FL-phe), que inibe a síntese de C mycocide, produz alterações significativas nas camadas exteriores da parede celular (106). Etanobutol, um inibidor de arabinogalactan (391, 501) e síntese de fosfolípidos (461, 462), também desorganizam essas camadas. Além disso, ethambutol induz a formação de falsos sem a dissolução do peptidoglicano (391). Metil - 4-(2- octadecylcyclopropen-1-ilo) butanoato (MOCB) é um análogo estrutural de um precursor chave na síntese de ácido mycolic. Assim, os efeitos da MOCB na síntese de ácido mycolic e m-FL-phe ethambutol na parede exterior processos biossintéticas levando a mudanças na arquitetura de parede celular parecem ser responsáveis por aumentar a concentração intracelular de drogas chemotherapeutic. Estas conclusões apóiam o conceito de parede da célula, agindo como uma barreira de permeabilidade a estas drogas (425). Menos estudos foram feitos dos mecanismos envolvidos na resistência da micobactéria a anti-sépticos e desinfetantes. No entanto, a atividade de clorexidina e de um QAC, cloreto de cetilpiridinium, contra M. avium e M. tuberculosis pode ser potencializada na presença de ethambutol (52). A partir desses dados, pode deduzir-se que arabinogalactan é um componente da parede celular que age como uma barreira de permeabilidade de clorexidina e QACs. Não é possível, no presente, para comentar outros componentes, uma vez que estes ainda têm de ser investigados. Seria útil dispor de informações sobre a fixação em células desses agentes antisépticos na presença e ausência de inibidores de síntese de parede celular diferente. Uma espécie de micobactérias de preocupação no momento é q M. chelonae, desde que esses organismos são por vezes isolados de endoscópios em lavagens e água de diálise. Tal estirpe não foi morto mesmo após uma exposição de 60-min para glutaraldeído alcalino; em contrapartida, uma estirpe de referência mostrou uma redução de 5-log-unidade após um tempo de contato de 10 min (519). Esta estirpe de chelonae M. glutaraldeída-resistente tem demonstrado uma maior tolerância para PAA mas não NaDCC ou um fenólico. Outros trabalhadores também tem observado uma resistência superior à média de chelonae M. Glutaraldeído e formaldeído (72), mas não para PAA (187, 294). As razões para esta resistência elevada Glutaraldeído são desconhecidas. No entanto, M. chelonae é conhecido fortemente aderir às superfícies suaves, que podem tornar as células dentro um biofilme menos suscetível a desinfetantes. Não há nenhuma prova até agora essa absorção de Glutaraldeído por M. chelonae é reduzido.
micobacteristaticos mesmo quando usado em concentrações elevadas (51, 52, 419, 425, 455). No entanto, a atividade destes pode ser aumentada substancialmente por efeitos de formulação. Assim, uma série de produtos baseados em QAC, afirmam ter atividade micobacteriana. Por exemplo, é uma formulação mais recente (Sactimed-I-Sinald) que contém uma mistura de alquil poliguanidas e QACs alquil pretendia ser micobactericida (211, 353). No entanto, há algumas dúvidas se os agentes antibacterianos tinham sido adequadamente mortos ou neutralizados para impedir que a transição das concentrações inibitórias em mídia de recuperação. Há muitos anos, ele foi proposto (T. H. Shen, citado na referência 99) que a resistência das micobactérias para QACs estava coligada com o teor de lípidos da parede da célula. Em apoio desta disputa, Mycobacterium phlei, que tem um teor de lípideos célula total baixa, foi mais sensível do que o M. tuberculosis, que tem um maior teor de lípideos. Também foi observado que a resistência de várias espécies de micobactérias estava relacionada ao conteúdo do material cerosa na parede. Agora é conhecido que devido à natureza altamente hidrófobo da parede da célula, biocidas hidrofílicos geralmente conseguem penetrar na parede da célula micobacteriana em concentrações suficientemente elevadas para produzir um efeito letal. No entanto, baixas concentrações de anti-sépticos e desinfetantes, como clorexidina presumivelmente devem atravessar essa barreira de permeabilidade, porque o PRM é da mesma ordem que essas concentrações inibem o crescimento de estirpes de não micobactérias como S. aureus, (51, 52) Embora M. avium-intracellulare pode ser particularmente resistente. Os componentes de ação na parede da célula micobacteriana responsável ao biocida de alta resistência são atualmente desconhecidos, embora algumas informações estão disponíveis. Inibidores de síntese da parede celular aumentam a susceptibilidade de M. avium à droga (391); a inibição da myocide C, arabinogalactan e mycolic ácido biossíntese aprimora a susceptibilidade de droga. Tratamento deste organismo com m-fluoro-DL-fenilalanina (m-FL-phe), que inibe a síntese de C mycocide, produz alterações significativas nas camadas exteriores da parede celular (106). Etanobutol, um inibidor de arabinogalactan (391, 501) e síntese de fosfolípidos (461, 462), também desorganizam essas camadas. Além disso, ethambutol induz a formação de falsos sem a dissolução do peptidoglicano (391). Metil - 4-(2- octadecylcyclopropen-1-ilo) butanoato (MOCB) é um análogo estrutural de um precursor chave na síntese de ácido mycolic. Assim, os efeitos da MOCB na síntese de ácido mycolic e m-FL-phe ethambutol na parede exterior processos biossintéticas levando a mudanças na arquitetura de parede celular parecem ser responsáveis por aumentar a concentração intracelular de drogas chemotherapeutic. Estas conclusões apóiam o conceito de parede da célula, agindo como uma barreira de permeabilidade a estas drogas (425). Menos estudos foram feitos dos mecanismos envolvidos na resistência da micobactéria a anti-sépticos e desinfetantes. No entanto, a atividade de clorexidina e de um QAC, cloreto de cetilpiridinium, contra M. avium e M. tuberculosis pode ser potencializada na presença de ethambutol (52). A partir desses dados, pode deduzir-se que arabinogalactan é um componente da parede celular que age como uma barreira de permeabilidade de clorexidina e QACs. Não é possível, no presente, para comentar outros componentes, uma vez que estes ainda têm de ser investigados. Seria útil dispor de informações sobre a fixação em células desses agentes antisépticos na presença e ausência de inibidores de síntese de parede celular diferente. Uma espécie de micobactérias de preocupação no momento é q M. chelonae, desde que esses organismos são por vezes isolados de endoscópios em lavagens e água de diálise. Tal estirpe não foi morto mesmo após uma exposição de 60-min para glutaraldeído alcalino; em contrapartida, uma estirpe de referência mostrou uma redução de 5-log-unidade após um tempo de contato de 10 min (519). Esta estirpe de chelonae M. glutaraldeída-resistente tem demonstrado uma maior tolerância para PAA mas não NaDCC ou um fenólico. Outros trabalhadores também tem observado uma resistência superior à média de chelonae M. Glutaraldeído e formaldeído (72), mas não para PAA (187, 294). As razões para esta resistência elevada Glutaraldeído são desconhecidas. No entanto, M. chelonae é conhecido fortemente aderir às superfícies suaves, que podem tornar as células dentro um biofilme menos suscetível a desinfetantes. Não há nenhuma prova até agora essa absorção de Glutaraldeído por M. chelonae é reduzido.
Resistência Intrínseca de outras bactérias gram-positivas.
A parede celular dos estafilococos é composta essencialmente por peptidoglicano e acido teichoic. Nenhum destes parece atuar como uma barreira à entrada de anti-sépticos e desinfetantes eficaz. Desde que as substâncias peso molecular alto facilmente podem atravessar a parede da célula de estafilococos e vegetativa spp Bacillus., isso pode explicar a sensibilidade desses organismos para muitos agentes antibacterianos, incluindo QACs e clorexidina (411, 417, 422, 428, 451). No entanto, a plasticidade da célula bacteriana envelopada é um fenômeno conhecido (381). Taxa de crescimento e de qualquer nutriente peso limitante afetará o estado fisiológico das células. Em tais circunstâncias, a espessura e o grau de crosslinking de peptidoglicano são susceptíveis de ser modificados e, por conseguinte, a sensibilidade celular anti-sépticos e desinfetantes será alterada. Por exemplo, Gilbert e Brown (171) demonstram que a sensibilidade de células Bacillus megaterium a clorexidina e 2-fenoxietanol é alterada quando são feitas alterações na limitação de taxa e nutrientes de crescimento com células chemostat-cultivadas. No entanto, induzidas a lisozima protoplastos destas células manteve-se sensível e foram mortas por esses agentes de membrana-ativa. Portanto, a parede celular nas células inteiras é responsável pela sua resposta modificada. Na natureza, S. aureus podem existir como estirpes mucoide, com as células rodeadas por uma camada de slime. Estirpes não mucoide morrem mais rapidamente do que as estirpes mucoide ao cloroxilenol, cetrimide e clorexidina, mas há pouca diferença no abate por fenóis ou fenóis clorados (263); remoção de slime por lavagem processado as células sensíveis. Portanto, o slime desempenha um papel de proteção, como uma barreira física à penetração desinfetante ou como uma camada solta interagindo com ou absorver as moléculas biocida. Não há provas até a data em que os enterococos resistentes à vancomicina ou enterococos com alto nível de resistência aos antibióticos aminoglycoside são mais resistentes à desinfetantes que são sensíveis ao antibiótico enterococcal estirpes (9, 11, 48, 319). No entanto, os enterococos são geralmente menos sensíveis aos biocidas que os estafilococos e diferenças nas concentrações inibitórias de bactericidas, também se verificou entre as espécies enterococcal (257).
Resistência Intrínseca de bactéria gram-negativa.
Bactérias gram negativas são geralmente mais resistentes aos anti-sépticos e desinfetantes que não esporulados, não micobactérias, bactérias gram positivas (Figura 2) (428, 440, 441). Exemplos de MIC contra organismos Gram positivos e negativos são fornecidos na tabela 6. Com base nesses dados, existe uma diferença marcada na sensibilidade do s. aureus e e. coli QACs (benzalcónio, benzetónio e cetrimide), hexaclorofeno, diamidines, e triclosano, mas pouca diferença na susceptibilidade de clorohexidina. P. aeruginosa é consideravelmente mais resistente à maioria desses agentes, incluindo clorohexidina, e (não mostrado) spp Proteus. Possuem uma resistência superior à média de agentes catiônicos, como clorohexidina e QACs (311, 440). A membrana exterior de bactérias gram negativos age como uma barreira que limita a entrada de muitos quimicamente independentes tipos de agentes antibacterianos (18, 169, 196, 197, 355, 366, 440, 516, 517). Esta conclusão é baseada sobre as sensibilidades relativas dos estafilococos e bactérias grame também estudos com membrana exterior mutantes de e. coli, s. typhimurium e p. aeruginosa (134, 135, 433-435, 438). Suaves, tipo bactérias selvagens tem uma superfície de célula hidrofóbica; pelo contrário, devido aos patches de Fosfolípido sobre a superfície da célula, profundidade aproximadas de (heptose-menos) de mutantes são hidrofóbicas. Estes mutantes tendem a ser hipersensíveis aos antibióticos hidrofóbicos e desinfetantes. Baixa massa molecular (Mr < ca. 600) moléculas hidrofílicas facilmente passam através dos porins em células Gram negativas, mas moléculas hidrofóbicas difundem em toda a bilayer de membrana exterior (Tabela 7). Em bactérias gram- tipo selvagem, intactos de moléculas LPS impedem o acesso pronto de moléculas hidrofóbicas para Fosfolipídeos e daí para o interior da célula. Estirpes profundo em bruto, o que faltam a cadeia de lado O- específicos e a maioria dos polissacarídeos de núcleo, os patches de Fosfolipídeos na superfície celular têm seus cabeçotes grupos orientados em direção ao exterior. Além dessas vias de entrada hidrofílicos e hidrofóbicos, foi proposto um percurso de terceiro para agentes catiônicos tais como QACs, biguanidas e diamidinas. Afirma-se que esses danos a membrana exterior, promovendo sua própria aceitação (197). Policátions desorganizam a membrana exterior de e. coli (520). Ele deve ser adicionado, no entanto, que a QACs e diamidinas são consideravelmente menos ativa contra estirpes de wildtype que contra estirpes profundo em bruto, enquanto clorohexidina tem a mesma ordem de atividade (MIC aumento rebatíveis de cerca de 2 a 3 log) contra ambos os tipos de estirpes de e. coli (434, 435, 439). No entanto, s. typhimurium mutantes são mais sensíveis aos clorohexidina que as estirpes de tipo selvagem (433). Bactérias Gram-negativa que mostram um elevado nível de resistência à muitos anti-sépticos e desinfetantes incluem p. aeruginosa, Burkholderia cepacia, Proteus spp. e Providencia stuartii (428, 440). A membrana exterior de p. aeruginosa é responsável por sua alta resistência; em comparação com outros organismos, existem diferenças na composição de LPS, o conteúdo de catiônico da membrana exterior (54). O alto teor de Mg+2 auxilia na produção de fortes laços de LPS-LPS; além disso, devido à sua reduzida dimensão, o porins não pode permitir divulgação geral através deles. Cepacia b. muitas vezes é consideravelmente mais resistente no ambiente hospitalar que nos meios de cultura artificial (360); o elevado teor de arabinose fosfato-ligado no seu LPS diminui a afinidade da membrana exterior de antibióticos de polimixina e outras moléculas catiônicas e policatiônicas (97, 516). Pseudomonas stutzeri, pelo contrário, é altamente sensível a muitos antibióticos e desinfetantes (449), que implica que esses agentes têm pouca dificuldade em atravessar as camadas externas das células deste organismo. Os membros do gênero Proteus são invariavelmente insensíveis a clorohexidina (311). Algumas estirpes que são altamente resistentes à clorohexidina, QACs, EDTA e diamidinas foram isolados de fontes clínicas. A presença do tipo menos acida membrana exterior LPS poderia ser um fator que contribuiu para esta resistência intrínseca (97, 516). Um membro particularmente problemático do gênero Providencia é p. stuartii. Como Proteus spp., p. stuartii estirpes foram isolados de infecções do Trato Urinário em pacientes paraplégicos e são resistentes aos diferentes tipos de anti-sépticos e desinfetantes incluindo clorohexidina e QACs (492, 496). Estirpes de p. stuartii que demonstrou baixa-, intermediário- e alto nível de resistência a clorohexidina formaram a base de uma série de estudos sobre a mecanismos de resistência (86, 422, 428). Não foram detectadas diferenças brutas na composição das camadas exteriores dessas estirpes e concluiu-se que (i) sutis mudanças no arranjo estrutural dos envelopes célula essas estirpes foi associado esta resistência e (ii) a membrana interna não era implicados (230). Alguns autores consideraram peptidoglicano em bactérias gram- como sendo uma barreira potencial para a entrada de substâncias inibidoras. O conteúdo de peptidoglicano desses organismos é muito menor em estafilococos, que são inerentemente mais sensíveis aos muitos anti-sépticos e desinfetantes. No entanto, houve ocorrências (discutida em referência 422) onde organismos Gram- cultivados em concentrações sub inibitórias de uma penicilina têm barreiras de permeabilidade deficiente. Além disso, foi conhecido por muitos anos (215, 409, 411) que induzidas em penicilina spheroplasts e lisozima EDTA-tri "protoplasts" das bactérias gram- rapidamente são mortas pelos agentes de membrana ativo como clorohexidina. É concebível que a natureza ampliada das membranas exteriores e interiores em organismos b-lactama- tratados poderia contribuir para esta susceptibilidade maior. Existe a possibilidade de que a membrana citoplasmática (interna) fornece um mecanismo de resistência intrínseca. Esta membrana é composta de Lipoproteína e seria esperada para impedir a difusão passiva de moléculas hidrófilas. Também é sabido que as alterações na composição de membrana afetam a sensibilidade para etanol (159). Lannigan e Bryan (275) propôs que a susceptibilidade diminuição de Serratia marcescens a clorohexidina estava ligada à membrana interna, mas Ismaeel et al. (230) foi possível encontrar nenhum papel tão com stuartii p. clorohexidina- resistente. Neste momento, há pouca evidência para envolvem a membrana interna na resistência biocida. Além disso, a degradação de clorohexidina foi reportada para s. marcescens, p. aeruginosa e Achromobacter / Alcaligenes xylosoxidans (358).
Fisiológica (phenotypic) adaptação como mecanismo intrínseco
A associação dos microrganismos com superfícies sólidas leva a geração de um biofilme, definido como um consórcio de organismos organizados dentro de uma exopolimero extenso exopolisacarideo (93, 94). Biofilme podem consistir de monocultures, de várias espécies diferentes ou de phenotypes mistos de uma determinada espécie (57, 73, 381). Algumas publicações excelentes que lidam com a natureza, a formação e o conteúdo de biofilme estão disponíveis (125, 178, 276, 538). Biofilme são importantes por várias razões, nomeadamente biocorrosão, reduzido a qualidade da água e focos de contaminação dos produtos de higiene (10, 12-14). Colonização também ocorre em biomateriais implantados e dispositivos médicos, resultando em taxas de aumento de infecção e possível recorrência da infecção (125).
Bactérias em diferentes partes de um biofilme experimentam diferentes ambientes de nutrientes e suas propriedades fisiológicas são afetadas (57). Dentro as profundidades de um biofilme, por exemplo, limitação dos nutrientes é susceptível de reduzir as taxas de crescimento, o que podem afetar a susceptibilidade aos agentes antimicrobianos (98, 142, 171, 172). Assim, os phenotypes de organismos sésseis dentro biofilme diferem consideravelmente as células planctônicas encontradas no laboratório de culturas (73). Crescimento lento bactérias são particularmente insusceptíveis, um ponto reiterou recentemente noutro contexto (126). Várias razões podem contabilizar a sensibilidade reduzida de bactérias dentro de um biofilme (Tabela 8). (I) pode haver redução ao acesso de um desinfetante (ou antibiótico) para as células dentro do biofilme; (ii) química de interação entre o desinfetante e o próprio biofilme, (iii) a modulação da micro desenvolvimento, (iv) a produção de enzimas degradativas (e produtos químicos neutralizadores), (v) ou troca genética entre as células em um biofilme. No entanto, removido um biofilme e reculturado nos meios de cultura de bactérias são geralmente não mais resistentes que as células planctônicas "ordinárias" dessa espécie (57). Várias instâncias são conhecidas da contaminação das soluções anti-séptica ou desinfetantes por bactérias. Por exemplo, Marrie e Costerton (310) descreveram a sobrevivência prolongada de S. marcescens em soluções de clorexidina de 2 %, que foi atribuída a incorporação desses organismos em uma matriz espessa que aderiu às paredes de um recipiente de armazenamento. Conclusões análogas foram alcançadas por Hugo et al. (225) sobre a sobrevivência de cepacia B. de clorexidina e por Anderson et al. (10, 14 12-) sobre a contaminação de anti-sépticos Iodofor com Pseudomonas. Nos estudos por Anderson et al., biofilme de Pseudomonas foram encontrados nas superfícies interiores de tubos de policloreto de vinil utilizados durante o fabrico de providone iodada anti-sépticos. É para se perguntar se um motivo semelhante poderia ser apresentado para a contaminação por S. marcescens de uma solução de cloreto de benzalcónio implicando na meningite (468). Recentemente, uma estratégia de ingredientes foi descrito (540) para controlar o biofilme por meio da geração de peróxido de hidrogênio na interface biofilme-superfície, em vez de simplesmente aplicando um desinfetante. Neste procedimento, a superfície colonizada incorporada a um catalisador que gerou o ativo composto de um agente de tratamento. Agentes patogênicos Gram-negativos podem crescer como biofilme na bexiga cateterizada e são capazes de sobreviver a concentrações de clorexidina, que são eficazes contra organismos em indivíduos não cateterizados (493, 494). Curiosamente, o agente de permeabilidade EDTA tem apenas um efeito potenciador temporário da bexiga cateterizada, com crescimento bacteriano posteriormente recorrentes (495). B. cepacia recentemente isolado do ambiente hospitalar frequentemente é consideravelmente mais resistente a clorexidina de quando cultivadas em meios de cultura artificial e um glycocalico pode estar associado com resistência intrínseca para o bisbiguanide (360). Legionella pneumophila é frequentemente encontrada nos sistemas de distribuição de água do hospital e Torres de resfriamento. Cloração em combinação com aquecimento contínuo (60 ° C) de entrada de água geralmente é a medida mais importante de desinfecção; no entanto, devido à produção biofilme, contaminar organismos pode ser menos sensível a este tratamento (140). Maior resistência ao cloro foi relatada para Vibrio cholerae, que exprime um exopolisacarideo amorfo, causando a agregação de célula ("rugose" morfologia [336]) sem nenhuma perda de patogenicidade. Um pode chegar a algumas conclusões sobre biofilme. A interação de bactérias com superfícies é geralmente reversível e, eventualmente, irreversível. Aderência irreversível é iniciada pela vinculação das bactérias à superfície através de polímeros de glycocalyx exopolysaccharide. Células irmãs então surgirem pela divisão celular e estão vinculadas dentro da matriz de glycocalyx. O desenvolvimento do aderente microcolonias assim é iniciado, para que, finalmente, é produzido um biofilme contínuo na superfície colonizeda. Bactérias dentro destes biofilme residem em micro desenvolvimento específicas que diferem das células cultivadas em condições laboratoriais normais e assim mostram variações na sua resposta ao anti-sépticos e desinfetantes. Recentes surtos nosocomiais devido a M. chelonae (discutida sob "intrínsecas resistência das micobactérias"), M. tuberculosis (4, 323) e hepatite C (53) enfatizam a importância da formação de pseudobiofilme flexível fibra óptica escopo contaminação. Estes focos foram associados a limpeza inadequada dos escopos, qual comprometido a esterilização subseqüente com glutaraldeído. Enquanto estes organismos não formam uma verdadeira biofilme, a ação reticuladores da glutaraldeído pode causar um acumulo de resíduos insolúveis e microrganismos associados em escopos e automatizadas reprocessos. Biofilme fornecem o exemplo mais importante da adaptação (fenotípica) como fisiológico pode desempenhar um papel em que conferem resistência intrínseca (57). Outros exemplos são também conhecidos. Por exemplo, engordados células de S. aureus produzido pela subcultura repetida em glicerol- contendo mídia é mais resistente à alquil fenóis e benzilpenicilina que as estirpes de tipo selvagem (220). Subcultura destas células na rotina de cultura de mídia resultou em reaquisição de sensibilidade (218). Culturas planctônicas cultivadas em condições de taxas de crescimento reduzido ou limitação dos nutrientes têm células com sensibilidade alterada para desinfetantes, provavelmente em consequência das modificações nas suas membranas exteriores (56, 59, 98). Além disso, muitos microrganismos aeróbios desenvolveram sistemas de defesa intrínsecos que conferem tolerância ao stress (em particular H2O2) in vivo de peróxido. Os chamados oxidativa- estresse ou SOS resposta tenha sido bem estudada e. coli e Salmonella e inclui a produção de enzimas para evitar danos celulares (incluindo peroxidases, catalases, glutathione reductase) e reparar lesões do ADN (por exemplo, exonuclease III) de neutralização (112, 114, 497). Em ambos os organismos, maior tolerância pode ser obtida pelo pré-tratamento com uma dose de subinhibitoria de peróxido de hidrogênio (113, 539). Prétratamento induz uma série de proteínas, muitos dos quais estão sob o controle positivo de uma proteína de sensor/regulador (OxiR), incluindo catalase e glutathione redutase (497) e mais proteínas desnecessários que se acumulam para proteger a célula (338). Resistências ao calor, etanol e ácido hipocloroso também tem sido relatado (81, 128, 335). A resposta de stress oxidativa em bactérias gram é menos bem estudada, mas tem sido descrita tolerância de Bacillus H2O2 variar durante a fase de crescimento (127) e em estirpes mutantes (67, 200). Mecanismos de defesa semelhantes foram descritos por Campylobacter jejuni (185), Deinococcus (528) e Haemophilus influenzae (36). No entanto, o nível de tolerância maior para H2O2 durante a resposta de stress oxidativa não pode arcar com proteção significativa às concentrações usadas em anti-sépticos e desinfetantes (geralmente. 3 %). Por exemplo, B. subtilis mutantes foram descritas para ser mais resistentes a; 0,5 % H2O2 do tipo selvagem e estirpes; 0,34 % H2O2 (200).
Bactéria adquirindo Mecanismos de Resistência.
Como ocorre com antibióticos e outros medicamentos quimioterapeuticos, resistência adquirida anti-sépticos e desinfetantes podem surgir por mutação ou a aquisição de material genético sob a forma de plasmídeos ou transposons. É importante observar que "resistência" da como um termo muitas vezes pode ser usado livremente e em muitos casos deve ser interpretada com alguma prudência. Isso é particularmente verdadeiro com análise MIC. Ao contrário de antibióticos, "resistência" ou um aumento do MIC de um biocida, não necessariamente correlacionar com falha terapêutica. Um aumento de um antibiótico MIC pode pode ter conseqüências significativas, muitas vezes, indicando que o organismo de destino não é afetado pela sua ação antimicrobiana. Maior MIC biocida devido aos mecanismos adquiridos também foram relatados e em alguns casos mal interpretado como indicando a resistência. É importante que questões inclusive a ação pleiotropic da maioria dos produtos biocidas, atividade bactericida, concentrações utilizadas em produtos, pedido de produto direto, efeitos de formulação, etc., ser considerados na avaliação das implicações clínicas destes relatórios.
Plasmídeos e bactérias resistentes a anti-sépticos e desinfetantes.
Chopra (82, 83) examinou o papel de plasmídeos na codificação de resistência (ou maior tolerância) a anti-sépticos e desinfetantes; este tópico foi considerado mais por Russell (413). Concluiu-se que para além de alguns exemplos específicos tais como prata, outros metais e organo mercuriais, plasmídeos não eram normalmente responsáveis pelos elevados níveis de resistência anti-séptica ou desinfetante associado a certas espécies ou estirpes. Desde então, no entanto, houve numerosos relatórios vinculando a presença de plasmídeos em bactérias com maior tolerância clorexidina, QACs e triclosano, (83, 423, 427), bem como para diamidinas, acridinas e brometo de etídio, o tema foi reconsiderado (Tabela 9). Resistência de codificado plasmídeos anti-sépticos e desinfetantes tinha cada vez mais amplamente investigada com mercuriais (orgânicos e inorgânicos), compostos de prata e outros cátions e ânions. Mercuriais deixaram de ser utilizados como desinfetantes, mas sais fenilmercúrico e tiomersal ainda são usados como conservantes em alguns tipos de produtos farmacêuticos (226). Resistência ao mercúrio é plasmídeos borne, inducible e pode ser transferida pela conjugação ou transdução. Mercúrio inorgânico (Hg21) e a resistência de organomercurio é uma propriedade comum de clínicas isolados de S. aureus contendo penicilinase plasmídeos (110). Plasmídeos que conferem resistência aos mercuriais são ambos os espectro estreito, especificando a resistência a Hg+2 e a alguns organomercuriais ou largo espectro, com resistência para os compostos acima e adicionais organomercuriais (331). Sais de prata ainda são usados como agentes antimicrobianos tópicos (50, 443). Codificado plasmídeos resistência à prata foi encontrada no Pseudomonas stutzeri (192), os membros do Enterobacteriaceae (479, 480, 511) e Citrobacter spp. (511). O mecanismo de resistência ainda tem que ser elucidados totalmente, mas pode ser associado a acumulação de prata (152, 511).
(i) Plasmideo-mediated anti-séptico e desinfetante resistência em gram-negativa bactéria.
Relatórios ocasionais analisaram o possível papel de plasmídeos, a resistência das bactérias gram a anti-sépticos e desinfetantes. Sutton e Jacoby (498) observou que plasmídeos RP1 não alterou significativamente a resistência do p. aeruginosa a QACs, clorexidina, iodo ou fenóis clorados, embora maior resistência à hexaclorofeno foi observada. Este composto tem um efeito muito maior no Gram+ do que bactérias gram-, para que ela seja difícil avaliar a importância desta constatação. Transformação deste plasmídeos (que codifica a resistência ao carbenicillin, tetraciclina, neomicina e canamicina) e. coli ou p. aeruginosa não aumentar a sensibilidade desses organismos a uma gama de anti-sépticos (5). Estirpes de Providencia stuartii podem ser altamente tolerantes Hg+2, desinfetantes ativadores (tais como clorexidina e QACs) e antibióticos (496). Nenhuma prova foi apresentada para mostrar que existe uma associação entre a resistência aos antibióticos e resistência desinfetante desses organismos, pseudomonas ou Proteus spp. (492) vinculado ao plasmídeos. Altos níveis de resistência desinfetante foram reportados em outros hospitais isolados (195), Embora nenhum papel claro da resistência especificada pelo plasmídeos emergiu (102, 250, 348, 373, 518). Altos níveis de tolerância de clorexidina e QACs (311) podem ser intrínsecos ou podem ter resultado de mutação. Ele foi proposto (492, 496) que o uso extensivo desses agentes ativadores poderia ser responsável para a seleção de anti-séptico - desinfetante - e estirpes resistentes ao antibiótico; no entanto, há pouca evidência para apoiar esta conclusão. Todos estes estudos demonstraram que era difícil para transferência de clorexidina ou QAC resistência sob mal e que mediada por plasmídeos resistência a esses produtos químicos em bactérias gram- foi um evento improvável. Pelo contrário, plasmídeos R124 altera as proteínas de membrana exterior de OmpF em e. coli e células que contêm este plasmídeos são mais resistentes a um QAC (cetrimide) e a outros agentes (406). Mecanismos de resistência bacteriana de formaldeído e biocidas industriais podem ser plasmídeos codificado (71, 193). Alterações na superfície da célula (proteínas de membrana exterior [19, 246]) e formaldeído desidrogenase (247, 269) são consideradas responsáveis (202). Além disso, o plasmídeos chamado TOM codifica enzimas para degradação de tolueno e fenol em B. cepacia (476).
Relatórios ocasionais analisaram o possível papel de plasmídeos, a resistência das bactérias gram a anti-sépticos e desinfetantes. Sutton e Jacoby (498) observou que plasmídeos RP1 não alterou significativamente a resistência do p. aeruginosa a QACs, clorexidina, iodo ou fenóis clorados, embora maior resistência à hexaclorofeno foi observada. Este composto tem um efeito muito maior no Gram+ do que bactérias gram-, para que ela seja difícil avaliar a importância desta constatação. Transformação deste plasmídeos (que codifica a resistência ao carbenicillin, tetraciclina, neomicina e canamicina) e. coli ou p. aeruginosa não aumentar a sensibilidade desses organismos a uma gama de anti-sépticos (5). Estirpes de Providencia stuartii podem ser altamente tolerantes Hg+2, desinfetantes ativadores (tais como clorexidina e QACs) e antibióticos (496). Nenhuma prova foi apresentada para mostrar que existe uma associação entre a resistência aos antibióticos e resistência desinfetante desses organismos, pseudomonas ou Proteus spp. (492) vinculado ao plasmídeos. Altos níveis de resistência desinfetante foram reportados em outros hospitais isolados (195), Embora nenhum papel claro da resistência especificada pelo plasmídeos emergiu (102, 250, 348, 373, 518). Altos níveis de tolerância de clorexidina e QACs (311) podem ser intrínsecos ou podem ter resultado de mutação. Ele foi proposto (492, 496) que o uso extensivo desses agentes ativadores poderia ser responsável para a seleção de anti-séptico - desinfetante - e estirpes resistentes ao antibiótico; no entanto, há pouca evidência para apoiar esta conclusão. Todos estes estudos demonstraram que era difícil para transferência de clorexidina ou QAC resistência sob mal e que mediada por plasmídeos resistência a esses produtos químicos em bactérias gram- foi um evento improvável. Pelo contrário, plasmídeos R124 altera as proteínas de membrana exterior de OmpF em e. coli e células que contêm este plasmídeos são mais resistentes a um QAC (cetrimide) e a outros agentes (406). Mecanismos de resistência bacteriana de formaldeído e biocidas industriais podem ser plasmídeos codificado (71, 193). Alterações na superfície da célula (proteínas de membrana exterior [19, 246]) e formaldeído desidrogenase (247, 269) são consideradas responsáveis (202). Além disso, o plasmídeos chamado TOM codifica enzimas para degradação de tolueno e fenol em B. cepacia (476).
(ii) Plasmid-mediated anti-séptico e desinfetante resistência em staphylococcus.
Methicillin-S. aureus (MRSA) resistências são das principais causas de Sepse em hospitais em todo o mundo, embora nem todas as estirpes aumentaram virulência. Muitos podem ser referidos como "epidemia" MRSA causa da facilidade com a qual eles podem se espalhar (91, 295, 317). Pacientes particularmente alto risco são aqueles que estão debilitados ou immunocompromised ou que tenham feridas abertas. Ele tem sido conhecido há vários anos que alguns anti-sépticos e desinfetantes são, no âmbito do MIC, um pouco menos inibem as S. aureus estirpes que contêm um plasmídeos que transportem genes codificação resistência ao gentamicina antibiótico a aminoglycoside (tabela 10). Esses agentes biocidas incluem clorexidina, diamidinas e QACs, juntamente com brometo de etídio e acridines (8, 238, 289, 368, 423, 427, 463). De acordo com Mycock (346), MRSA estirpes revelaram um aumento notável na tolerância (pelo menos 5,000-fold) para povidone-iodo. No entanto, não houve nenhuma diminuição da susceptibilidade das estirpes resistentes aos antibióticos para phenolics (fenol, cresol e clorocresol) ou os conservantes conhecidos como parabenos (8). Tennent et al. (505) propôs que maior resistência ao brometo de cetyltrimethylammonium (CTAB) e isotionato propamidine foram vinculadas e que esses agentes ativadores podem estar agindo como uma pressão seletiva para a retenção de plasmídeos codificação resistência a eles. O significado clínico potencial esta conclusão continua a ser determinada. Estafilococos são as bactérias só nos quais foram os aspectos genéticos da mediada por plasmídeos anti-séptica e desinfetante mecanismos resistentes descritos (466). Em S. aureus, estes mecanismos são codificados pelo menos três determinantes da resistência múltipla separado (tabelas de 10 e 11). Foram relatados MIC anti-séptica aumento generalizado entre estirpes MRSA e para ser especificados por duas famílias de gene (qacAB e qacCD) dos determinantes (188, 280, 281, 288, 289, 363-365, 367, 506). A família qacAB de genes (tabela 11) codifica proteínas de exportação próton dependente que desenvolve Homologia significativa aos outros transportadores dependentes de energia como os transportadores de tetraciclina encontrados em vários strains de tetraciclina resistência a bactéria (405). O gene qacA está presente predominantemente sobre a família de pSK1 de multiresistancia plasmídeos, mas também é provável que seja atual sobre a Cromossoma clínicos S. aureus estirpes como um plasmídeos família integrado ou parte dele. O gene qacB é detectado em grande resistência de metais pesados plasmídeos. Os genes qacC e qacD codificar idênticos phenotypes e mostram a restrição site Homologia; o gene qacC pode evoluíram de qacD (288). Interessantes estudos por Reverdy et al (395, 396), Dussau et al. (129) e Behr et al. (31) demonstraram uma relação entre aumento S. aureus MIC para a Oxacilina b-lactâmico e quatro anti-sépticos (clorexidina, cloreto de benzalcónio, hexamine e acriflavine). Um gene de resistência múltipla de codificação não foi encontrado em estirpes sensíveis mas estava presente em 70 % S. aureus estirpes para os quais o MIC de todos os quatro destes anti-sépticos foram aumentadas, 45 % das restantes estirpes resistentes a pelo menos um destes anti-sépticos (31). Codificação maior tolerância QAC os genes podem ser generalizados na espécie Síndrome alimentar - associado (203). Cerca de 40 % de isolados de coágulos negativo estafilococos (CNS) contêm genes qacA tanto qacC, com uma possível vantagem seletiva em que possuam tanto em vez de apenas qacA (281). Além disso, há cada vez mais provas que S. aureus e o CNS tem um pool comum dos determinantes de resistência.
Triclosan é usado no scrubs cirúrgicos, sabonetes e desodorizantes. É ativo contra estafilococos e menos ativo contra organismos mais Gram, especialmente p. aeruginosa, provavelmente por força de uma barreira de permeabilidade (428). Baixo nível de resistência transferível para triclosano foi relatada em estirpes MRSA (88, 90); no entanto, nenhum outro trabalho sobre esses organismos tem sido descrito. Segundo Sasatsu et al. (465), o MIC de triclosano contra estirpes de aureus resistentes e sensíveis S. eram 100 e > 6,400 mg/ml, respectivamente; esses resultados foram contestados porque estas concentrações são bem superiores a solubilidade do triclosano (515), que é praticamente insolúvel em água. Sasatsu et al. (464) descreveu uma estirpe resistente ao alto nível de S. aureus para os quais o MIC de clorexidina, CTAB e butilparabeno foram os mesmos que para uma estirpe resistente de baixo nível. Além disso, o MIC cotado para metilparabeno confortavelmente excede sua solubilidade em água. A maioria destes estudos com estirpes sensíveis e "resistentes" envolvia a utilização de avaliações de MIC (por exemplo, o quadro 6). Algumas investigações analisou os efeitos bactericidas da anti-sépticos. Cookson et al. (89) assinalou que cura de plasmídeos resistência produziu uma queda no MIC, mas não uma diminuição consistente na atividade letal de clorexidina. Existe uma correlação entre o centro e a taxa de ação bactericida de clorexidina (88, 89, 319) e triclosano (90, 319) pobre. McDonnell et al (318, 319) têm descrito aureus methicillin-sensíveis S. (MSSA) e estirpes MRSA com maior triclosano MIC (para 1,6 mg/ml), mas revelou que o MBCs para essas estirpes eram idênticos; estes resultados não foram surpreendentes, Considerando que biocidas (ao contrário de antibióticos) têm vários destinos de celulares. Irizarry et al. (229) comparado a susceptibilidade das estirpes MRSA e MSSA CAP e clorexidina por MIC e métodos de ensaio bactericidas. No entanto, a conclusão deste estudo que MRSA estirpes eram mais resistentes merece comentários adicionais. No âmbito do MIC real bastante elevado, MRSA estirpes foram alguns quatro vezes mais resistente a clorexidina e cinco vezes mais resistente a um QAC (CPC) que eram estirpes MSSA. Em uma concentração em caldo de 2 mg de CPC/ml, duas estirpes MRSA cresceram normalmente com um aumento triplo números viáveis ao longo de um período de teste de 4-h Considerando uma estirpe MSSA mostrou uma diminuição de 97 % de viabilidade. Com isso, os autores concluíram que era razoável a especular que os montantes residuais de anti-sépticos e desinfetantes encontrados no ambiente hospitalar poderiam contribuir para a seleção e manutenção de multiresistencia MRSA estirpes. Irizarry et al. (229) concluiu também que MRSA estirpes são menos sensíveis de estirpes MSSA para exposições crônicas e agudas anti-sépticos e desinfetantes. No entanto, seus resultados com 4 mg/ml CPC não mostram nenhum tal padrão: esta concentração mais elevada, o turbidities (e viabilidade) os dois MRSA e um MSSA estirpes diminuíram a taxas muito semelhantes (se alguma coisa, uma estirpe MRSA parecia ser afetado de forma ligeiramente maior que o MSSA da estirpe). Além disso, os autores afirmam que clorexidina deu resultados semelhantes ao CPC. Por conseguinte, é difícil ver como Irizarry et al. chegou a suas conclusões altamente seletivas.
Mediada por plasmídeos efflux bombas são particularmente importantes mecanismos de resistência para muitos antibióticos (85), metais (349) e ativadores desinfetantes e anti-sépticos tais como QACs, clorexidina, diamidines e acridines, bem como ao brometo de etídio (239, 289, 324-336, 363-368). Recombinantes S. aureus plasmídeos transferidos para e. coli são responsáveis por conferir maior MIC dos agentes ativadores ao organismo Gram (505, 544).
Pingalla (324, 325) demonstrou que um plasmídeo-suportadas, determinante de resistência de etídio de S. aureus clonado em e. coli codifica resistência ao brometo de etídio e QACs, que são expulsos das células. Um sistema semelhante efflux está presente no Enterococcus hirae (326). Sasatsu et al. (463) mostrou que a duplicação da ebr é responsável pela resistência ao brometo de etídio e alguns anti-sépticos. Mais tarde, Sasatsu et al. (466) examinou a origem da ebr (agora conhecida para ser idêntico ao qacCD) em S. aureus; ebr foi encontrado em estirpes resistentes aos antibióticos e - sensíveis de S. aureus, CNS e estirpes enterococcal. As sequências de nucleótidos do fragmento amplificado DNA de estirpes sensíveis e resistentes eram idênticas, e ele foi proposto que nas células resistentes ao anti-séptico havia um aumento do número de cópias do gene ebr (qacCD) cuja função normal foi remover substâncias tóxicas de células normais dos estafilococos e enterococos. Com base no ADN Homologia, ele foi proposto que qacA e relacionados com genes que transportem determinantes da resistência evoluídos de genes pre existentes responsáveis pelos sistemas de transporte celulares normais (405) e que os genes de resistência anti-séptica evoluíram antes da introdução e utilização de produtos antimicrobianos da atualidade e outros anti-sépticos e desinfetantes (288, 289, 365, 367, 368, 405). Baquero et al. (23) fizeram notar que para os antibióticos, a presença de um mecanismo de resistência específica freqüentemente contribui para a seleção de longo prazo das variantes resistentes em condições in vivo. Se baixo nível de resistência à ativadores anti-sépticos, por exemplo, clorexidina, QACs, também pode fornecer uma vantagem seletiva sobre estafilococos que transportem genes qac continua a ser elucidados. A evidência atualmente é controversa e inconclusivos.
Mediada por plasmídeos efflux bombas são particularmente importantes mecanismos de resistência para muitos antibióticos (85), metais (349) e ativadores desinfetantes e anti-sépticos tais como QACs, clorexidina, diamidines e acridines, bem como ao brometo de etídio (239, 289, 324-336, 363-368). Recombinantes S. aureus plasmídeos transferidos para e. coli são responsáveis por conferir maior MIC dos agentes ativadores ao organismo Gram (505, 544).
Pingalla (324, 325) demonstrou que um plasmídeo-suportadas, determinante de resistência de etídio de S. aureus clonado em e. coli codifica resistência ao brometo de etídio e QACs, que são expulsos das células. Um sistema semelhante efflux está presente no Enterococcus hirae (326). Sasatsu et al. (463) mostrou que a duplicação da ebr é responsável pela resistência ao brometo de etídio e alguns anti-sépticos. Mais tarde, Sasatsu et al. (466) examinou a origem da ebr (agora conhecida para ser idêntico ao qacCD) em S. aureus; ebr foi encontrado em estirpes resistentes aos antibióticos e - sensíveis de S. aureus, CNS e estirpes enterococcal. As sequências de nucleótidos do fragmento amplificado DNA de estirpes sensíveis e resistentes eram idênticas, e ele foi proposto que nas células resistentes ao anti-séptico havia um aumento do número de cópias do gene ebr (qacCD) cuja função normal foi remover substâncias tóxicas de células normais dos estafilococos e enterococos. Com base no ADN Homologia, ele foi proposto que qacA e relacionados com genes que transportem determinantes da resistência evoluídos de genes pre existentes responsáveis pelos sistemas de transporte celulares normais (405) e que os genes de resistência anti-séptica evoluíram antes da introdução e utilização de produtos antimicrobianos da atualidade e outros anti-sépticos e desinfetantes (288, 289, 365, 367, 368, 405). Baquero et al. (23) fizeram notar que para os antibióticos, a presença de um mecanismo de resistência específica freqüentemente contribui para a seleção de longo prazo das variantes resistentes em condições in vivo. Se baixo nível de resistência à ativadores anti-sépticos, por exemplo, clorexidina, QACs, também pode fornecer uma vantagem seletiva sobre estafilococos que transportem genes qac continua a ser elucidados. A evidência atualmente é controversa e inconclusivos.
(iii) Plasmid-mediated anti-séptico e desinfetante resistência em outras bactérias gram-positiva.
Coriynebacteria resistentes aos antibióticos pode estar implicado em infecções humanas, especialmente no immunocompromised. ´Grupo JK´ coryneforms (Corynebacterium jeikeium) Verificou-se para ser mais tolerante do que outros coryneforms o brometo de etídio desinfetantes ativadores e hexaclorofeno, mas estudos com derivados plasmídeos contendo e plasmídeo-cured não produzidos nenhuma prova de resistência de plasmidassociated (285). Enterococcus faecium estirpes mostrando alto nível de resistência à vancomicina, gentamicina, ou ambos não são mais resistentes à clorexidina ou outros agentes não antibióticos (9, 11, 20, 319). Além disso, apesar do amplo uso dentário de clorexidina, estirpes de Streptococcus mutans permanecem confidenciais para ele (235). Até à data, portanto, há pouca ou nenhuma evidência do plasmídeo-associados a resistência das bactérias gram nonstaphylococcal anti-sépticos e desinfetantes.
(iv) Mutacional resistencia para antisepticos e desinfetantes.
Mutação cromossômica aos antibióticos foi reconhecida por décadas. Pelo contrário, foram efetuados poucos estudos para determinar se a mutação confere resistência a anti-sépticos e desinfetantes. Ele foi, no entanto, demonstrada há 40 anos (77, 78) que marcescens S., normalmente inibida por QACs, de 100 mg/ml, poderá adaptar a crescer em 100.000 mg de um QAC por mililitro. As células resistentes e sensíveis tinham diferentes características de superfície (mobilidade eletroforética), mas resistência poderia ser perdida quando as células foram cultivadas em mídia QAC-livre. Um problema associado a QACs e clorexidina é a turvação produzida em meios de cultura líquido acima de uma certa concentração (interação com ágar também ocorre), que sem dúvida poderia interferir com a determinação do crescimento. Esta observação é reforçada pelas conclusões apresentadas por Nicoletti et al. (354). Príncipe et al. (383) informou que a resistência de clorexidina poderia ser induzida em alguns organismos, mas não em outros. Por exemplo, p. mirabilis e S. marcescens exibidos 128 e 258-fazer aumentos, respectivamente, na resistência à clorexidina, Considerando que não era possível desenvolver resistência ao clorexidina em Salmonella enteritidis. As estirpes resistentes não revelavam propriedades bioquímicas alteradas da virulência alterada para ratos e algumas estirpes eram resistentes para o cloreto de benzalcónio QAC. Além disso, a resistência de clorexidina manteve-se estável em S. marcescens, mas não em p. mirabilis. Apesar da ampla experimentação com uma variedade de procedimentos, Fitzgerald et al. (148) puderam desenvolver resistência de clorexidina estável de e. coli ou S. aureus. Observações semelhantes foram feitas por Cookson et al. (89), que trabalhou com MRSA e outras estirpes de S. aureus, e pela McDonnell et al. (319), que trabalhou com MRSA e enterococos. Recentemente, foi desenvolvida resistência de clorexidina estável na p. stutzeri (502); essas estirpes revelaram vários níveis de tolerância maior para QACs, triclosano e alguns antibióticos, provavelmente em consequência de uma alteração não especifica do envelope da célula (452). A adaptação e o crescimento de S. marcescens de lentes de contato desinfetantes contendo clorexidina, com resistências a uma QAC, foram descritos anteriormente (166).
Cloroxilenol-resistências de p. aeruginosa foram isolados por exposição repetida na mídia contendo gradualmente o aumento das concentrações do fenólicos, mas a resistência era instável (432). A adaptação do p. aeruginosa para QACs é um fenômeno conhecido (1, 2, 240). Resistência aos tensoativos anfotéricos também foi observada e, curiosamente, resistências de clorexidina foi observado (240). Isto implica que o mecanismo dessa resistência é não especifico e que envolve alterações celulares que modificam a resposta dos organismos a agentes independentes de biocidas. Modificação de membrana exterior é um fator óbvio e, de fato, foi encontrada com QAC-resistente e anfotéricos composto resistente p. aeruginosa (240) e resistente a clorexidina S. marcescens (166). Essas mudanças envolvem perfis de ácidos gordos e, talvez mais importante, proteínas de membrana exterior. Também é pertinente salientar aqui as recentes conclusões do Langsrud e Sundheim (274). Neste estudo, a resistência do p. fluorescens para QACs foi reduzida quando EDTA esteve presente com o QAC (embora o efeito letal foi atenuado após as células foram cultivadas em meio contendo QAC e EDTA); resultados semelhantes foram encontrados com mutantes gerados em laboratório e. coli, para os quais o MIC de triclosano foram aumentados (318). EDTA há muito tempo tem sido conhecida (175, 410) para produzir alterações na membrana exterior de bactérias gram, especialmente pseudomonas. Assim, conclui-se que, novamente, o desenvolvimento da resistência dos associados a alterações no envelope célula, limitando assim a absorção de antisépticos e desinfetantes. Hospital (como para outros ambiental) isolados das bactérias gram- são invariavelmente menos sensíveis a desinfetantes que as estirpes de laboratório (196, 209, 279, 286, 492). Desde que a transferência de plasmideo mediated aparentemente foi eliminada (ver acima), seleção e mutação poderiam desempenhar um papel importante na presença destas isolados. As concentrações de antibióticas sub inibitório podem causar alterações sutis na estrutura exterior bacteriana, assim, estimular o contato célula-a-celula (109); continua a ser testada se concentrações residuais de anti-sépticos ou desinfetantes em situações clínicas poderiam produzir o mesmo efeito. Outro mecanismo de insusceptibilidade foi apresentado, no caso vertente, para explicar a resistência acridine. Ele foi proposto (270, 351) que células proflavine e sensível - resistentes são igualmente permeáveis para o acridine mas que células resistentes possuíam a capacidade de expulsar o corante vinculado. Este é um ponto importante e que foi reforçado pelos mais recentes estudos que demonstram a importância das efflux na resistência das bactérias aos antibióticos (284, 330, 355). Além disso, a resistência múltipla (MDR) é um problema grave em bactérias gram entérica e outros. MDR é um termo usado para descrever os mecanismos de resistência usada pelos genes que fazem parte do genoma do célula normal (168). Estes genes são ativados por indução ou mutação provocada por alguns tipos de stress, e porque eles são distribuídos ubiquitously, transferência genética não é necessária. Embora tais sistemas são mais importantes no contexto da resistência aos antibióticos, George (168) fornece vários exemplos de sistemas MDR no qual um operão ou um gene está associado a alterações na susceptibilidade anti-séptica ou desinfetante; por exemplo, (I) mutações em um locus acr no sistema Acr tornam mais sensível aos antibióticos hidrofóbicas, corantes e detergentes e. coli; (ii) o gene robA é responsável por overexpression de e. coli da proteína RobA que confere resistência aos antibióticos e metais pesados vários (curiosamente, Ag+ pode ser effluxed [350]); (iii) e a proteína MarA controla um conjunto de genes (mar e soxRS regulons) que conferem resistência não só a vários antibióticos, mas também a geradora de superóxido agentes. Moken et al. (333) concluíram que as baixas concentrações de óleo de pinho (utilizado como desinfetante) poderiam selecionar para mutantes e. coli que overexpressed de MarA e demonstraram níveis baixos de resistências aos antibióticos. Exclusão do locus do mar ou acrAB (este último codifica uma bomba de efflux dependem do FPP) aumentou a susceptibilidade de e. coli óleo de pinho; exclusão de acrAB, mas não de mar, aumentou a susceptibilidade de e. coli para cloroxilenol e um QAC. Além disso, a proteína de e. coli MdfA (transportador múltipla) foi recentemente identificada e confere maior tolerância a antibióticos e um QAC (benzalcónio) (132). A importância destes e de outros sistemas de MDR bacteriana susceptibilidade a anti-sépticos e desinfetantes, em particular a questão das resistências com antibióticos, deve ser estudada ainda mais. Neste momento, é difícil de traduzir estas constatações de laboratório para utilização clínica real e alguns estudos demonstraram que as bactérias resistentes aos antibióticos não são significativamente mais resistentes aos efeitos letais (ou bactericidas) de anti-sépticos e desinfetantes que as estirpes sensíveis ao antibiótico (11, 88, 89, 319).
Mecanismos de resistência fúngica anti-sépticos e desinfetantes.
Em comparação com bactérias, muito pouco é conhecido sobre as maneiras em que fungos pode contornar a ação de anti-sépticos e desinfetantes (104, 111, 296). Existem dois mecanismos gerais de resistência (Tabela 12): (I) intrínseca resistência, uma propriedade natural ou o desenvolvimento de um organismo (201); (ii) e adquiridos de resistência. Uma forma de resistência intrínseca, a parede da célula apresenta uma barreira para reduzir ou excluir a entrada de um agente antimicrobiano. As provas a data são um pouco irregular, mas os link de informações disponíveis de célula glucano de parede, espessura da parede e relativamente porosidade para a susceptibilidade de Saccharomyces cerevisiae de clorexidina (tabela 13) (204-208). Protoplastos deste organismo elaborado pela glucuronidase na presença de bmercaptoetanol são lysed por concentrações de clorexidina bem abaixo desses eficazes contra células (inteiras) "normais". Além disso, a idade de cultura influencia a resposta do S. cerevisiae clorexidina; as paredes de células são muito menos sensíveis a fase estacionária que na fase de crescimento logarítmico (208), ocupando muito menos gluconato de clorexidina [C 14] (206). Gale (165) demonstrado um aumento da resistência de Candida albicans para o polyenic B amfotericina antibiótico fenotípica como os organismos introduzida a fase estacionária de crescimento, que foi atribuída às alterações de parede celular envolvendo tighter reticuladores (74). Além disso, qualquer fator de aumento da atividade glucanase maior sensibilidade amfotericina.
A porosidade da parede da célula de levedura é afetada por sua química com a parede atuando como uma barreira ou modulador para a entrada e saída dos diversos agentes. DeNobel et al. (117-119) usado a absorção de fluoresceína isothiocyanurate (FITC) dextrans e o invertase periplasmic enzima como indicadores de porosidade de paredes celulares de leveduras. Intactas S. cerevisiae células foram capazes de endocitose FITC dextrans de 70, mas não de 150. Posteriormente foi desenvolvido um novo ensaio para determinar a porosidade de parede celular relativa na levedura baseada em fuga induzidas em policátions de compostos de absorção de UV. Hiom et al (206, 208) constatou que a porosidade relativa das células diminui com o aumento da idade de cultura e que não havia uma absorção reduzida do gluconato de clorexidina radiolabeled. À medida que aumenta a idade de uma S. cerevisiae cultura, há um aumento significativo da espessura da parede celular, com valores de 0.19, 0,25 e mm 0.31 registrados para células de 1, 2 e 6 - dias de antigas culturas, respectivamente (206). Estas conclusões (tabela 13) podem fornecer uma imagem tentativa dos fatores celulares que modificam a resposta do S. cerevisiae clorexidina. Mutantes mannan de S. cerevisiae mostram um grau de sensibilidade de clorexidina como a estirpe (204) similar. A camada glucano é blindada de b-glucuronidase por mannoproteins, mas este efeito é superar por b-mercaptoetanol (119). O mannoprotein consiste em duas frações, sódio dodecil sulfato-solúvel mannoproteins e sódio dodecil sulfato insolúvel, glucanase-solúveis queridos: o último limite sendo a porosidade da parede celular (119). Assim, glucano (e possivelmente mannoproteins) desempenha um papel fundamental na determinação da absorção e, portanto, a atividade de clorexidina em S. cerevisiae. C. albicans é menos sensível e ocupa menos clorexidina [C 14] global (206), mas apenas alguns estudos com este organismo e moldes foram executados. Leveduras cultivadas sob diferentes condições têm níveis variáveis de sensibilidade ao etanol (176, 402). Células com ácido linoleico enriquecido membranas de plasma são mais resistentes ao etanol, que são células com aqueles enriquecido em ácido oleico, que tem sido inferido que uma membrana mais fluida aumenta a resistência do etanol (6). Não há provas data de efflux anti-séptica (embora ácido benzóico nas células energizados é acreditado para ser eliminado pela fluindo para baixo o gradiente eletroquímica [529]) e nenhuma prova de resistência adquirida pela mutação (exceto para alguns conservantes [436]) ou por mecanismos mediada por plasmídeos (426, 436). Ele é decepcionante que para que alguns estudos rigorosos foram executados com leveduras e moldes e anti-sépticos e desinfetantes (ver Tratado [328] também do Miller sobre mecanismos para chegar ao local de ação). Fungos são geralmente mais resistentes que leveduras (tabela 14) e consideravelmente mais resistente do bactérias não esporuladas (tabela 15). Esporos de fungos, embora mais resistentes que as bactérias não esporuladas, são menos resistentes que esporos de bactérias anti-sépticos e desinfetantes (436). É tentador especular que a composição de parede celular em fungos confere uma elevada resistência intrínseca sobre esses organismos.
A porosidade da parede da célula de levedura é afetada por sua química com a parede atuando como uma barreira ou modulador para a entrada e saída dos diversos agentes. DeNobel et al. (117-119) usado a absorção de fluoresceína isothiocyanurate (FITC) dextrans e o invertase periplasmic enzima como indicadores de porosidade de paredes celulares de leveduras. Intactas S. cerevisiae células foram capazes de endocitose FITC dextrans de 70, mas não de 150. Posteriormente foi desenvolvido um novo ensaio para determinar a porosidade de parede celular relativa na levedura baseada em fuga induzidas em policátions de compostos de absorção de UV. Hiom et al (206, 208) constatou que a porosidade relativa das células diminui com o aumento da idade de cultura e que não havia uma absorção reduzida do gluconato de clorexidina radiolabeled. À medida que aumenta a idade de uma S. cerevisiae cultura, há um aumento significativo da espessura da parede celular, com valores de 0.19, 0,25 e mm 0.31 registrados para células de 1, 2 e 6 - dias de antigas culturas, respectivamente (206). Estas conclusões (tabela 13) podem fornecer uma imagem tentativa dos fatores celulares que modificam a resposta do S. cerevisiae clorexidina. Mutantes mannan de S. cerevisiae mostram um grau de sensibilidade de clorexidina como a estirpe (204) similar. A camada glucano é blindada de b-glucuronidase por mannoproteins, mas este efeito é superar por b-mercaptoetanol (119). O mannoprotein consiste em duas frações, sódio dodecil sulfato-solúvel mannoproteins e sódio dodecil sulfato insolúvel, glucanase-solúveis queridos: o último limite sendo a porosidade da parede celular (119). Assim, glucano (e possivelmente mannoproteins) desempenha um papel fundamental na determinação da absorção e, portanto, a atividade de clorexidina em S. cerevisiae. C. albicans é menos sensível e ocupa menos clorexidina [C 14] global (206), mas apenas alguns estudos com este organismo e moldes foram executados. Leveduras cultivadas sob diferentes condições têm níveis variáveis de sensibilidade ao etanol (176, 402). Células com ácido linoleico enriquecido membranas de plasma são mais resistentes ao etanol, que são células com aqueles enriquecido em ácido oleico, que tem sido inferido que uma membrana mais fluida aumenta a resistência do etanol (6). Não há provas data de efflux anti-séptica (embora ácido benzóico nas células energizados é acreditado para ser eliminado pela fluindo para baixo o gradiente eletroquímica [529]) e nenhuma prova de resistência adquirida pela mutação (exceto para alguns conservantes [436]) ou por mecanismos mediada por plasmídeos (426, 436). Ele é decepcionante que para que alguns estudos rigorosos foram executados com leveduras e moldes e anti-sépticos e desinfetantes (ver Tratado [328] também do Miller sobre mecanismos para chegar ao local de ação). Fungos são geralmente mais resistentes que leveduras (tabela 14) e consideravelmente mais resistente do bactérias não esporuladas (tabela 15). Esporos de fungos, embora mais resistentes que as bactérias não esporuladas, são menos resistentes que esporos de bactérias anti-sépticos e desinfetantes (436). É tentador especular que a composição de parede celular em fungos confere uma elevada resistência intrínseca sobre esses organismos.
Mecanismos de Resistência Viral para Anti-sépticos e Desinfetantes.
Primeiros estudos sobre os efeitos dos desinfetantes sobre vírus foram revistos pelo Grossgebauer (189). Alvos potenciais virais é o envelope viral, que contém lípidos e é uma membrana de unidade típica; o capsídeo, que é principalmente de proteínas na natureza; e o genoma. Uma hipótese importante foi apresentada em 1963 (258) e modificado em 1983 (259), no qual ele foi proposto que viral susceptibilidade a desinfetantes poderia basear-se em se vírus eram "lipophilic" na natureza, porque eles possuíam um envelope de lípidos (por exemplo, herpes simplex vírus [259]) ou "hidrofílicos" porque eles não (por exemplo, o vírus [514]). Lípidos-envelopada vírus foram sensíveis desinfetantes lipophilic-tipo, tais como 2-phenylphenol, tensoativos catiônicos (QACs), clorohexidina e isopropanol, bem como ao éter e clorofórmio. Klein e deforest (259) classificam os vírus em três grupos (Tabela 16), A (contendo de lípidos), B (não lipídeo picornaviruses) e C (outros vírus de não lipídeo maiores do que aqueles no grupo B) e desinfetantes em dois grupos, largo-spectrum aqueles que inativados todos os vírus e lipophilic aqueles que conseguiu desativar picornoviruses e parvoviruses. Proteínas de capsídeo são predominantemente proteínas na natureza e biocidas, como glutaraldeído, hipoclorito, óxido de etileno e peróxido de hidrogênio que reagem fortemente com amino ou grupos de sulfhydryl podem possuir atividade virucidal. Ele deve, no entanto, ser acrescentado que a destruição do capsídeo viral pode resultar na versão de um ácido nucléico potencialmente infeccioso e que inativação viral só seria completa se o ácido nucleico viral também é destruído. Infelizmente, a penetração de anti-sépticos e desinfetantes nos diferentes tipos de vírus e sua interação com componentes virais ter sido pouco estudada, apesar de algumas informações foram fornecidas pelas investigações com bacteriophages (307). Bacteriophages são considerados como "indicador de espécies" para avaliar a atividade virucidal dos desinfetantes (108) e, portanto, poderia desempenhar um papel cada vez mais importante neste contexto; por exemplo, a exposição repetida de e. coli phage f2 ao cloro foi reclamada para aumentar a sua resistência à desinfecção (542).
Thurman e Gerber (509, 510) observaram que muitas vezes foram relatados resultados conflitantes sobre as ações dos desinfetantes em tipos diferentes de vírus e sugeriram que a integridade estrutural de um vírus foi alterada por um agente que reagiu com capsídeo virais aumentando a permeabilidade viral. Assim sistema de desinfecção poderia ser um meio eficiente de inativação viral e, ao mesmo tempo, superar a possibilidade de reativação de multiplicidade (primeiro apresentada por Luria [293]) para explicar uma redução inicial e, em seguida, um aumento o título de disinfectanttreated Fago. Reativação de multiplicidade como um mecanismo de resistência foi apoiado pela observação das jovens e Sharp (546) que clumping de vírus seguinte inativação parcial pelo hipoclorito significativamente aumentado o título phage. Prevê-se como consistindo de danos aleatórios do capsídeo de proteínas ou ácido nucléico de virions clumped, não infectosos, donde complementar de reconstrução de uma partícula infecciosa ocorre por hibridização com o pool de genes dos vírus inativados (298). Outro mecanismo de resistência envolve também a agregação viral, por exemplo, a persistência de infecciosidade do vírus-tratados de formaldeído (458) e a resistência do vírus Norwalk para cloração (249). Uma curva de sobrevivência bifásico típico de porcino e rotavirus expostos ao ácido peracetico também é indicativa da presença de agregados virais (198). Por último, resta a possibilidade de viral adaptação às novas condições ambientais. Neste contexto, Bates et al. (28) descreveu o desenvolvimento do vírus, tendo aumentado a resistência à inativação de cloro. Claramente, ainda há muito a ser aprendido sobre o mecanismo de inativação viral e resistência viral para desinfetantes.
Thurman e Gerber (509, 510) observaram que muitas vezes foram relatados resultados conflitantes sobre as ações dos desinfetantes em tipos diferentes de vírus e sugeriram que a integridade estrutural de um vírus foi alterada por um agente que reagiu com capsídeo virais aumentando a permeabilidade viral. Assim sistema de desinfecção poderia ser um meio eficiente de inativação viral e, ao mesmo tempo, superar a possibilidade de reativação de multiplicidade (primeiro apresentada por Luria [293]) para explicar uma redução inicial e, em seguida, um aumento o título de disinfectanttreated Fago. Reativação de multiplicidade como um mecanismo de resistência foi apoiado pela observação das jovens e Sharp (546) que clumping de vírus seguinte inativação parcial pelo hipoclorito significativamente aumentado o título phage. Prevê-se como consistindo de danos aleatórios do capsídeo de proteínas ou ácido nucléico de virions clumped, não infectosos, donde complementar de reconstrução de uma partícula infecciosa ocorre por hibridização com o pool de genes dos vírus inativados (298). Outro mecanismo de resistência envolve também a agregação viral, por exemplo, a persistência de infecciosidade do vírus-tratados de formaldeído (458) e a resistência do vírus Norwalk para cloração (249). Uma curva de sobrevivência bifásico típico de porcino e rotavirus expostos ao ácido peracetico também é indicativa da presença de agregados virais (198). Por último, resta a possibilidade de viral adaptação às novas condições ambientais. Neste contexto, Bates et al. (28) descreveu o desenvolvimento do vírus, tendo aumentado a resistência à inativação de cloro. Claramente, ainda há muito a ser aprendido sobre o mecanismo de inativação viral e resistência viral para desinfetantes.

Mecanismos de Resistência de Protozoários para Anti-sépticos e Desinfetantes.
Protozoários intestinais, tais como o Cryptosporidium parvum e Entamoeba histolytica, giardia intestinalis, são todos potencialmente patogênicos para os seres humanos e têm um Cisto resistente, transmissível (ou oocyst de Cryptosporidium) (233, 234). Os desinfetantes disponíveis atualmente, ozônio é o mais eficaz cisticida de protozoários, seguido de dióxido de cloro, iodo e cloro livre, os quais são mais eficazes do que os cloraminas (234, 264). As formas de Cistos são invariavelmente os mais resistentes à desinfetantes químicos (Figura 1). As razões para isso são desconhecidas, mas que seria razoável supor que cistos, semelhantes aos esporos, ocupam menos moléculas desinfetantes de solução que formas vegetativas. Alguns estudos recentes têm comparado as respostas dos cistos e trophozoites de Acantamoebíase castellanii para desinfetantes utilizadas nas soluções de lentes de contato e monitorado o desenvolvimento da resistência durante a encistação e a perda de resistência durante o excistação (251-255). Os efeitos letais de clorexidina e de uma hexametilenobiguanida poliméricas eram dependentes de tempo e concentração, e Cistos eram mais resistentes do trophozoites de preencystment ou cistos preexcystment. A "parede" do Cisto apareceu atuar como uma barreira para a aceitação desses agentes, apresentando assim um tipo clássico do mecanismo de resistência intrínsecas (163). Acanthamoebae são capazes de formar biofilme em superfícies como lentes de contato (186). Embora protozoários de biofilme ainda têm que ser estudados extensivamente em termos de sua resposta a desinfetantes, é evidente que eles poderiam desempenhar um papel significativo em uma modulação dos efeitos de agentes químicos.
Mecanismos de Resistência de Priões para Desinfetantes.
As encefalopatias espongiformes degenerativas (TDEs) formam um grupo de doenças neurológicas fatais aos seres humanos e outros animais. TDEs são causados por priões, agentes protéicos anormais que parecem não conter nenhum agente específico de ácidos nucleicos (385). Uma forma resistente à protease anormal (PrPres) de uma proteína normal host está implicada no processo patológico. Priões são considerados altamente resistentes a agentes físicos e químicos (Fig. 1), embora o fato de preparações brutas frequentemente serem estudadas, poderiam avaliar a verdadeira eficácia desses agentes (503). De acordo com Taylor (503), não há atualmente nenhum procedimento de descontaminação conhecido que irá garantir a completa ausência de infecciosidade nos tecidos infectados TDE processados por procedimentos histopatológicos. Priões sobrevivem a tratamento ácido, mas um efeito sinérgico com autoclave além de tratamento de hidróxido de sódio é observado. Formaldeído, óxido de etileno e glutaraldeído (pH ácido) sem buffer têm pouco efeito sobre a infecciosidade, embora guanidina tiocianato, alguns fenóis, hidróxido de sódio e cloro-liberador agentes (especialmente hipocloritos) são mais eficazes (141, 309, 503). Com a informação atualmente disponível, é difícil explicar a resistência extremamente elevada de priões, salvar a comentar que a proteína resistente à protease é anormalmente estável aos processos degradativos.
CONCLUSÕES.
É claro que microrganismos podem adaptar-se a uma variedade de condições ambientais físicas e químicas, e, por conseguinte, não é surpreendente que a resistência ao uso extensivamente de anti-sépticos e desinfetantes foi relatada. Os mecanismos que têm sido estudados, as mais importantes são claramente intrínsecas, em especial a capacidade esporulante, adaptação de pseudomonas e os efeitos de proteção de biofilme. Nestes casos, "resistência" pode ser usada incorretamente e "tolerância," definida como efeitos de desenvolvimento ou de proteção que permitam que os microrganismos sobrevivam na presença de um agente ativo, pode ser mais correta. Muitos desses relatórios de resistência têm frequentemente questões paralelas, incluindo limpeza inadequada, utilização de produto incorreto ou práticas de controle ineficaz de infecção, que não podem ser subestimadas. Alguns mecanismos adquiridos (em especial com a resistência de metais pesados) também se revelaram ser clinicamente significativas, mas na maioria dos casos, os resultados têm sido especulativos. Aumento do MIC foi confirmado, em particular para estafilococos. No entanto, alguns relatórios investigaram ainda maior concentração bactericida ou diluições de utilização real dos produtos, que, em muitos casos, contêm concentrações significativamente superiores de biocidas ou atributos de formulação, o que podem aumentar a eficácia do produto; em alguns casos, alterações no MIC realmente se revelaram e não deverá ser significativo (9, 88, 89, 319, 428). Mecanismos de efflux são conhecidos como importante na resistência aos antibióticos, mas é questionável se o aumento de MIC observado de biocidas poderia ter implicações clínicas para desinfecção de superfície dura ou tópica (423, 428). Ele tem sido especulativo que pode ajudar a baixo nível de resistência a sobrevivência dos microrganismos em níveis residuais de anti-sépticos e desinfetantes; qualquer significado clínico possível continua a ser testado. Com crescentes preocupações sobre o desenvolvimento da resistência do biocida e resistências com antibióticos, é claro que devem ser isolados clínicos sob vigilância contínua e possíveis mecanismos devem ser investigados. Também é evidente que os produtos anti-sépticos e desinfetantes podem variar significativamente, apesar de que contêm níveis semelhantes de biocidas, que sublinha a necessidade de inspeção estreita das alegações de eficácia e metodologia de teste adequado (183, 423, 428). Além disso, um determinado anti-séptico ou desinfetante pode ser mais bem selecionado (como parte das práticas de controle de infecção) com base nas circunstâncias especiais ou surtos nosocomiais; por exemplo, são claramente mais eficazes contra certos agentes ativos Gram de bactérias gram e C. difficile (apesar da resistência intrínseca dos esporos) pode ser eficazmente controlado fisicamente pela limpeza adequada com produtos baseados em QAC. Em conclusão, muito continua a ser aprendido sobre o modo de ação de anti-sépticos e desinfetantes. Embora tenha tido progressos significativos com investigações bacterianas, uma maior compreensão desses mecanismos é claramente necessária para outros agentes infecciosos. Estudos dos mecanismos de ação e resistência microbiana de anti-sépticos e desinfetantes são, portanto, não apenas de significado acadêmico. São associados com o uso mais eficiente desses agentes clinicamente e com o design do potencial dos produtos e compostos mais recentes e mais eficazes.

Tópicos relacionados:
Autores:
PolySell
Recomendar
Comentário
Compartilhar

Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.