(1)Universidade Federal de Lavras, Departamento de Zootecnia, Campus Universitário, Caixa Postal 3.037, CEP 37200-000 Lavras, MG. (2)Universidade Estadual Paulista Júlio de Mesquita Filho, Faculdade de Medicina Veterinária e Zootecnia, Campus Botucatu. (3)Universidade Federal de Viçosa, Departamento de Zootecnia.
Introdução
No Brasil, nos últimos dez anos, houve crescimento substancial do confinamento de animais, por vários motivos, inclusive o de animais alojados por ciclo de engorda em cada unidade (Cervieri et al., 2009). Assim, em razão da capacidade estática destes empreendimentos, há necessidade de se elevar a concentração energética das dietas, pois a alta proporção de volumosos pode não ser viável, pelo baixo teor de matéria seca destes alimentos e pela necessidade de grandes áreas destinadas ao plantio (Machado Neto et al., 2012). No entanto, a elevação da proporção de alimentos concentrados nas dietas aumenta a possibilidade de ocorrência de acidose ruminal; portanto, a utilização de aditivos como a monensina sódica é uma estratégia que pode reduzir os índices deste distúrbio digestivo.
A monensina é responsável por mudanças na microbiota ruminal, como o aumento da produção de propionato e alterações nos mecanismos de saciedade, o que resulta na redução da quantidade de alimento ingerido e aumento da frequência das refeições (González et al., 2012). Portanto, este ionóforo contribui para a fermentação no rúmen e manutenção de um pH mais estável ao longo do dia.
Outra estratégia para reduzir a possibilidade de acidose, em bovinos de corte confinados, pode ser realizada por meio da inclusão de alimentos ricos em lipídeos na dieta. A substituição de carboidratos não fibrosos por lipídeos evita a formação de ácido láctico e a produção elevada de ácidos graxos voláteis (Van Soest, 1994). Todavia, a adição de lipídeos a dietas de bovinos pode alterar a fermentação ruminal e diminuir a digestibilidade da fibra dietética, em razão da supressão das atividades de bactérias celulolíticas e metanogênicas, geralmente gram-positivas (Jenkins et al., 2008). Portanto, a utilização de fontes lipídicas que escapam da degradação ruminal, como as gorduras inertes ou sabões de cálcio, pode ser efetiva para evitar o efeito negativo deste alimento sobre o ambiente ruminal. A utilização de oleaginosas, como o grão de soja, é outra estratégia que pode reduzir os efeitos negativos dos lipídeos sobre a fermentação ruminal, uma vez que estas fontes de ácidos graxos estão parcialmente protegidas da degradação ruminal (Oliveira et al., 2011).
O efeito de determinados ácidos graxos, sobre a expressão de alguns genes, ocorre graças à atividade biológica apresentada por certos lipídeos na dieta, que podem estimular ou inibir genes que codificam enzimas específicas (Jump, 2002). Assim, o uso de gordura protegida pode aumentar a quantidade de ácidos graxos poli‑insaturados absorvidos no intestino e, consequentemente, modular a síntese de RNAm de genes ligados ao metabolismo lipídico. Entre estes genes, o PPARA ("peroxisome proliferator-activated receptor" - receptor ativado por proliferador de peroxissomos alfa) e o SREBP1c ("sterol regulatory element‑binding proteins" - fator de transcrição de proteínas ligantes aos esteroides) apresentam papel fundamental. Os PPARs são uma família de proteínas receptoras nucleares, que são ativadas por certos ácidos graxos e desempenham funções importantes na regulação do metabolismo de nutrientes e homeostase energética do animal (Lemay & Hwang, 2006). A proteína PPARA apresenta função biológica semelhante em ruminantes e não ruminantes, é responsável pela regulação da beta‑oxidação de ácidos graxos e pode ser controlada para melhorar a produção e a saúde dos animais (Bionaz et al., 2013). A proteína SREBP1c atua na regulação da lipogênese e pode desempenhar papel oposto ao da PPARA (Schmitz & Ecker, 2008). Estudos também têm relatado que a expressão da estearoil CoA dessaturase (SCD1) é regulada por fatores associados à SREBP1c (Sampath & Ntambi, 2006). Sua ação reflete a maior síntese de ácidos graxos, que pode influenciar a eficiência de crescimento, além de alterar a composição de ácidos graxos depositados na carne (Kim & Ntambi, 1999).
O objetivo deste trabalho foi avaliar o desempenho, as características de carcaça e suas correlações com as expressões gênicas, em tourinhos.
Material e Métodos
O experimento foi conduzido no setor de Bovinocultura de Corte, da Universidade Federal de Lavras, de junho a setembro de 2009, em Lavras, MG (21º14' S, 45º00'W, a 918m de altitude). Foram utilizados 40 machos não castrados do grupo genético Red Norte, com idade inicial média de 21 meses e peso vivo inicial médio de 359±47 kg. Os animais foram distribuídos em delineamento inteiramente casualizado, com arranjo fatorial 2x2 (duas oleaginosas, com ou sem adição de ionóforo) e 10 repetições por tratamento, e os animais representaram as unidades experimentais. As dietas continham silagem de milho como volumoso, e quatro diferentes tipos de concentrado foram utilizados, com a inclusão de grão de soja moído ou gordura protegida (sabão de cálcio), Megalac‑E, Arm & Hammer, oriunda de soja, (Church & Dwight Company, QGN, Camaçari, BA, Brasil), e a inclusão ou não do ionóforo monensina sódica Rumenpac, (MCassab, São Paulo, SP, Brasil). Portanto, cada tipo de dieta representou um determinado tratamento, e a dose de monensina sódica recebida por cada animal foi de 230 mg por dia (Tabela 1). A mistura da monensina ao suplemento mineral foi realizada semanalmente e ajustada com base no consumo médio de massa de matéria seca, na semana anterior à produção dos concentrados. Tal procedimento foi feito para garantir o consumo médio preconizado. As dietas foram formuladas para atenderàs exigências de ganho de peso diário de 1,4 kg por dia (National Research Council, 2000).
A duração do experimento foi de 84 dias, precedido por um período de 14 dias para adaptação às dietas e instalações. No início do experimento, os animais foram pesados e tratados contra endoparasitas e ectoparasitas (Ivomec, Paulínia, SP, Brasil). Ao longo do experimento, os animais foram pesados a cada 28 dias, após 16 horas de jejum alimentar e hídrico.
Os animais foram confinados em baias coletivas – uma para cada tratamento –, com 30 m2 de área por animal, providas de comedouro e bebedouro de concreto. As dietas foram fornecidas duas vezes ao dia, às 07:00 e às 14:00 h, na forma de ração total, ajustadas diariamente para permitir sobras em torno de 5% do oferecido. O consumo médio de massa de matéria seca do lote foi obtido diariamente, durante todo o experimento, e amostras dos ingredientes do concentrado e da silagem de milho foram semanalmente coletadas, para análises de composição química, com base em amostras compostas.
As análises de massa de matéria seca, proteína bruta e extrato etéreo das dietas foram conduzidas de acordo com Helrich (1990). A concentração de fibra em detergente neutro (FDN) foi analisada de acordo com o método de Goering & Van Soest (1970), e o FDN nos alimentos concentrados foi analisado de acordo com o procedimento descrito por Van Soest et al. (1991). Os carboidratos não fibrosos (CNF) e a energia metabolizável (EM) foram calculados de acordo com o National Research Council (2001).
O abate dos animais foi realizado por meio da técnica de concussão cerebral e secção da veia jugular, seguido de remoção do couro e evisceração, procedimentos aprovados pelo Comitê de ética da Universidade Federal de Lavras (Protocolo 002/09). As carcaças foram identificadas, lavadas, divididas em duas metades que foram pesadas individualmente e levadas à câmara fria, por aproximadamente 24 horas, à temperatura de 1ºC. Após o período de resfriamento, as meias-carcaças foram novamente pesadas para obtenção do peso de carcaça fria.
Para a coleta do músculo longissimus dorsi, entre a 12a e a 13a costela, todos os instrumentos utilizados foram esterilizados, e as amostras colhidas foram lavadas com solução fisiológica de NaCl a 0,9%. Posteriormente, a amostra foi embrulhada em papel alumínio, congelada e transportada em nitrogênio líquido e armazenada a -80°C. A espessura de gordura subcutânea foi medida com auxílio de um paquímetro digital, entre a 12a e a 13a costela, a ¾ da borda medial do músculo longissimus dorsi na meia carcaça esquerda, após 24 horas de resfriamento. Aárea de olho de lombo, também medida entre a 12a e a 13a costela, foi delineada em papel transparência e determinada após leitura em planímetro.
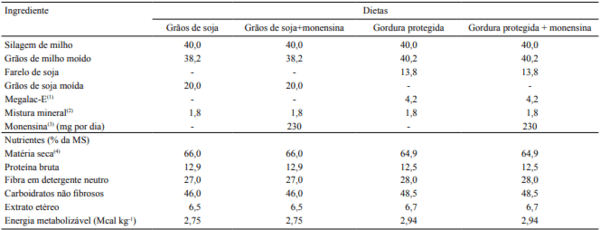
Tabela 1. Composição percentual de ingredientes e composição bromatológica das dietas experimentais com grãos de soja, grãos de soja e monensina, gordura protegida, e gordura protegida e monensina.
(1)Megalac‑E:Arm & Hammer, Church & Dwight Company, QGN, Camaçari, BA, Brasil. (2)Níveis de garantia por quilograma de produto: Ca, 235 g; P, 45 g; S, 23 g; Na, 80,18 g; Zn, 2,38 mg; Cu, 625 mg; Fe, 1,18 mg; Mn, 312 mg; Co, 32 mg; I, 41,6 mg; Se, 11,25 mg; vitamina A, 70,000 IU; vitamina D3, 5,000 IU; vitamina E, 15 IU; e niacina, 3,33 mg. (3)Rumenpac: MCassab, São Paulo, SP, Brasil. (4)Matéria natural.
O desenho dos iniciadores-alvos (PPARA, SREBP1c e SCD1) e endógenos (beta-actina e gliceraldeído 3-fosfato desidrogenase - GAPDH), utilizados como genes de referência ou normalizadores, foi realizado por meio de sequências cadastradas e publicadas no banco de dados público do Genbank, plataforma do National Center for Biotechnology Information (NCBI). O RNA total foi extraído a partir de amostras do músculo longissumus dorsi, com o reagente QIAzol (QIAgen, Valencia, CA, EUA), tratadas com DNase DNA-free (Ambion, Austin, TX, EUA), de acordo com o protocolo do fabricante. Para a análise da expressão gênica quantitativa, por reação em cadeia da polimerase (PCR) em tempo real (RT‑qPCR), utilizouse o modelo ABI PRISM 7500 Real Time PCR (Applied Biosystems, Foster City, CA, USA), com o auxílio do sistema de detecção SYBR Green (Applied Biosystems, Foster City, CA, USA). As condições térmicas de reação foram de 2 min a 50ºC, 10 min a 95ºC, seguidos por 40 ciclos de 15 min a 95ºC e 1 min a 60ºC, finalizadas por 15 s a 95ºC.
Os dados foram coletados e armazenados pelo programa 7500 Fast Software, versão 2.1 (Applied Biosystems, Foster City, CA, USA). Todo o experimento de RT‑qPCR, para cada gene em estudo, foi conduzido a partir de cDNAs diferentes, obtidos a partir de sete repetições biológicas, com três réplicas técnicas para cada uma, e os resultados foram normalizados com uso do CT (ciclo threshold), obtidos pela expressão dos genes de referência beta-actina e GAPDH.
A normalização dos genes foi realizada pela equação ∆CT=CT (gene-alvo) - CT (controle endógeno). Para isso, a calibração foi determinada pela fórmula ∆∆CT=∆CT (amostra) ‑ ∆CT (calibrador), em que o calibrador utilizado foi o CT do gene na dieta menos expressa. A avaliação da quantificação relativa foi realizada pela fórmula 2‑∆∆CT
Os dados foram submetidos à análise de variância pelo PROC GLM do programa SAS 9.3 (SAS Institute, Cary, NC, EUA). As médias foram analisadas pelo teste de Tukey, a 5% de probabilidade. Os coeficientes da correlação de Pearson foram calculados com o PROC CORR do SAS 9.3.
Resultados e Discussão
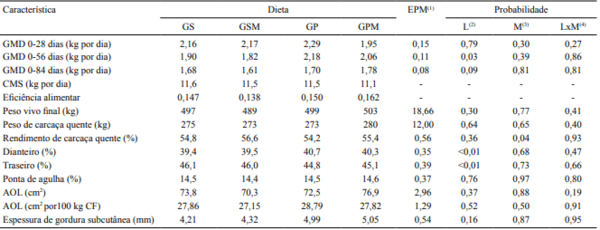
O ganho de peso médio diário, até os 56 dias de confinamento, foi maior nos animais que receberam gordura protegida na dieta do que naqueles que receberam grão de soja moído (Tabela 2). Provavelmente, isto ocorreu em consequência da maior concentração energética das dietas com gordura protegida (Tabela 1). De acordo com Calder et al. (2002), a suplementação com ácidos graxos poli-insaturados pode modular a resposta imune. Estudos prévios mostraram que o estresse, comum no início dos confinamentos, altera a concentração de proteínas de fase aguda do plasma (APP) (Phillips et al., 1989), a relação de neutrófilos:linfócitos e os níveis de noradrenalina e cortisol (Fike & Spire, 2006). Gomes et al. (2013) também verificaram que os animais com melhor eficiência alimentar apresentaram menor teor de cortisol plasmático. Como resposta fisiológica, o aumento do teor sérico das APP pode reduzir as concentrações séricas do fator análogo à insulina 1 (IGF-1), que é um hormônio chave para o crescimento de bovinos de corte (Cooke et al., 2011).
Algumas publicações recomendam que a concentração de extrato etéreo em dietas de ruminantes não deve ser superior a 6% da massa de matéria seca dietética (National Research Council, 2000; Valadares Filho et al., 2002). Entretanto, há possibilidade de aumento da concentração de lipídeos em dietas de ruminantes para níveis superiores a 6% (Zinn & Jorquera, 2007), como as utilizadas no presente estudo, e que foram responsáveis por produzir ganhos de peso elevados em todos os tratamentos. Gunn et al. (2009) realizaram experimento com a utilização de níveis crescentes de grãos de destilaria e mostraram que as dietas com maior teor deste subproduto apresentavam 9,2% de extrato etéreo e possibilitaram ganho médio diário de 1,43 kg por dia.
A inclusão de monensina não promoveu melhorias no ganho de peso dos animais (Tabela 2). Isto pode ser justificado pelo mecanismo de ação deste aditivo, que promove aumento da disponibilidade de energia por unidade de matéria seca ingerida. O fornecimento de monensina resulta em aumento da concentração de propionato no rúmen e reduz as concentrações de acetato. A produção de metano também é diminuída e, assim, o teor de energia metabolizável das dietas é aumentado (Beauchemin et al., 2008; Tedeschi et al., 2011). Portanto, o uso de monensina, em dietas de animais em confinamento, pode melhorar a eficiência alimentar, o que numericamente ocorreu quando se utilizou a dieta com gordura protegida.
Houve menores valores de eficiência alimentar quando as dietas com grão de soja foram utilizadas. Segundo Clary et al. (1993), a adição de lipídeos à dieta pode diminuir a magnitude da contribuição dos ionóforos sobre a fermentação ruminal, já que os ácidos graxos insaturados também atuam inibindo as bactérias gram‑positivas. Portanto, pode ocorrer efeito associativo entre o aditivo e a fonte de lipídeo. Resultados semelhantes ao do presente experimento foram observados por Salinas-Chavira et al. (2009), que não verificaram efeito dos diferentes níveis de monensina sódica sobre o ganho médio diário e a eficiência alimentar.
A inclusão de monensina às dietas de terminação, assim como as diferentes fontes de lipídeos estudadas, não promoveram alterações no peso de carcaça quente, área de olho de lombo e espessura de gordura subcutânea (Tabela 2). No entanto, o uso da monensina proporcionou aumento do rendimento de carcaça quente dos animais, o que pode ser explicado pela maior disponibilidade de energia da dieta para os animais. As fontes de lipídeo influenciaram a proporção dos cortes traseiros e dianteiros das carcaças, e as dietas com grãos de soja proporcionaram maior percentagem de traseiro, em relação à gordura protegida, o que resulta em maior valor das carcaças. Holzer et al. (2000) também verificaram efeito da dieta sobre a proporção de quartos das carcaças, e aqueles animais alimentados com maior teor de energia apresentaram maior percentagem de traseiro, assim como no presente estudo.
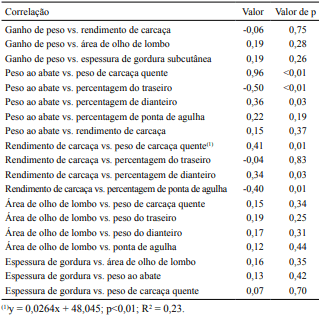
O ganho de peso dos animais não apresentou correlação com o rendimento de carcaça, área de olho de lombo e espessura de gordura subcutânea (Tabela 3). Este resultado é contrário ao apresentado por Block et al. (2001), que verificaram aumento de 0,185 cm2 na área de olho de lombo, para cada alteração de 1 kg no ganho de peso vivo. A área de olho de lombo não apresentou correlação com os pesos dos quartos e a espessura de gordura das carcaças estudadas. Todavia, Suguisawa et al. (2006) encontraram correlações positivas entre a área de olho de lombo e os quartos traseiros e dianteiros, e correlações negativas entre a área de olho de lombo e a gordura de cobertura. Lopes et al. (2012), ao avaliar animais Red Norte e Nelore em confinamento, com pesos semelhantes aos utilizados no presente estudo, verificaram correlação de 0,53 e 0,71 entre a área de olho de lombo e o peso dos cortes do traseiro total e o da alcatra completa (contrafilé, filé‑mignon, maminha, alcatra, capa de contrafilé e picanha), respectivamente. Estes resultados mostraram a possibilidade de se ter um ótimo indicador do valor comercial das carcaças, quando se avalia o rendimento dos cortes desossados.
Tabela 2. Ganho de peso médio diário (GMD), consumo de massa de matéria seca dos lotes (CMS), eficiência alimentar, peso vivo final, peso de carcaça quente, rendimento de carcaça quente, percentagem dos cortes primários, área de olho de lombo (AOL), área de olho de lombo por 100 kg de carcaça fria (AOL por 100 kg CF), espessura de gordura subcutânea e erro‑padrão da média de tourinhos alimentados com grãos de soja (GS) ou gordura protegida (GP), suplementados ou não com monensina (M).
(1)Erro-padrão da média. (2)Efeito para a fonte de lipídeo. (3)Efeito para o uso da monensina. (4)Interação entre lipídeo e monensina.
Houve correlações significativas antagônicas entre o peso dos animais ao abate e as proporções dos quartos traseiros e dianteiros, ou seja, quanto maior foi o peso ao abate dos animais, menor foi a percentagem do quarto traseiro, em relação à carcaça. Este resultado ajuda a explicar os efeitos das dietas sobre as proporções de quartos nas carcaças. Houve correlação positiva entre o peso ao abate e o peso de carcaça quente que, por sua vez, correlacionouse ao rendimento de carcaça. Observou-se que um acréscimo de 50 kg ao peso da carcaça dos animais representaria um aumento em 1,32 pontos percentuais no rendimento de carcaça. Com o aumento do peso de carcaça, os órgãos passam a representar menor proporção do corpo vazio, o que explicaria o maior rendimento de carcaça (Carvalho et al., 2003). Estes resultados são importantes, pois, carcaças com pesos distintos resultam em custos operacionais similares, pois demandam a mesma mão de obra e o mesmo tempo de processamento. Portanto, estratégias que possibilitem o aumento do peso da carcaça colaboram para o aumento da rentabilidade da indústria frigorifica e dos produtores rurais, já que a forma de remuneração adotada no Brasil é o peso de carcaça quente. O rendimento de carcaça também apresentou
Tabela 3. Correlações entre o desempenho, peso ao abate e as características da carcaça de tourinhos, alimentados com grãos de soja ou gordura protegida, suplementados ou não com monensina.
correlação positiva com a percentagem de dianteiro e negativa com a ponta de agulha. Em relação a esta última, animais com menor rendimento de carcaça apresentam maior tamanho do trato gastrointestinal e, consequentemente, maior cavidade abdominal, o que influenciaria o tamanho da ponta de agulha.
A ausência de correlação entre o peso ao abate e o rendimento de carcaça pode ser explicada pelo fato de o peso abate apresentar grande influência do tempo de jejum (Menezes et al., 2011). Provavelmente, o nível de enchimento ruminal pode ter sido influenciado, já que há grande variabilidade individual, quanto à ingestão de massa de matéria seca por bovino alimentado em grupo, o que afetaria as mensurações de peso ao abate, mesmo após 16 horas de jejum.
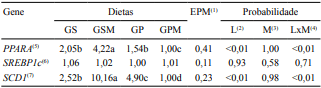
As dietas utilizadas alteraram a expressão dos genes PPARA e SCD1, que se expressaram mais no músculo longissumus dorsi dos animais alimentados com grão de soja e suplementados com monensina (Tabela 4). A explicação para os efeitos das dietas sobre a expressão gênica do PPARA foi dada por Bionaz et al. (2013), ao relatar que diferentes ácidos graxos podem ativar mais ou menos os diferentes isotipos de PPAR. Em relação ao SCD1, os resultados são explicados pela regulação deste gene pelo PPARA. Segundo Miller & Ntambi (1996), elementos de resposta ao PPAR, conhecidos como PPRE ("peroxisome proliferator hormone‑response elements") foram localizados no gene responsável por codificar a SCD1, o que confere capacidade de resposta ao PPARA.
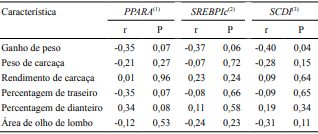
Houve correlação negativa entre o ganho de peso dos animais e a expressão do SCD1 (Tabela 5). Isto pode ser indicativo da maior síntese de ácidos graxos pelos tecidos (Choi et al., 2014). Ebara et al. (2010)
Tabela 4. Expressões gênicas de PPARA, SREBP1c e SCD1 no músculo de bovinos alimentados com grãos de soja (GS) ou gordura protegida (GP), suplementados ou não com monensina (M).
(1)Erro-padrão da média. (2)Efeito da fonte de lipídeo. (3)Efeito do uso da monensina. (4)Interação entre lipídeo e monensina. (5)Receptor ativado por proliferador de peroxissomos alfa. (6)Fator de transcrição de proteínas ligantes aos esteroides. (7)Estearoil CoA dessaturase.
verificaram maior expressão dos genes PPARG e SCD1 quando os animais receberam alimentação com maior teor de energia e proteína, o que se refletiu em maior ganho de peso, mas também em maior deposição de gordura, pois, segundo estes autores, os altos níveis nutricionais levariam à maior diferenciação dos adipócitos no músculo longissimus. Portanto, os valores de correlação negativa entre a expressão dos genes envolvidos no metabolismo lipídico e o desempenho dos animais, no presente estudo, podem ser explicados pelo maior custo energético da deposição de gordura no corpo do animal. Provavelmente, os animais com maior ganho e, consequentemente, menor expressão dos genes estariam depositando menor quantidade de gordura intramuscular. Os animais alimentados com grãos de soja e monensina, que tiveram as maiores expressões de PPARA e SCD1, apresentaram 1,74% de extrato etéreo no músculo longissimus dorsi, enquanto os animais alimentados com gordura protegida e monensina, com menor expressão destes genes, tiveram 2,37% de extrato etéreo.
A compreensão dos papéis fisiológicos dos isotipos de PPAR em ruminantes tem avançado de forma significativa, ao longo da última década, e há evidências suficientes, diretas e indiretas, para concluir que este receptor nuclear é biologicamente relevante nessas espécies (Bionaz et al., 2013). Os resultados encontrados no presente trabalho evidenciam isto, pois, o entendimento dos mecanismos de controle da expressão deste gene poderá ser utilizado no futuro, para modular o desempenho dos animais.
Tabela 5. Correlações de Pearson entre as expressões dos genes PPARA, SREBP1c e SCD1 e o desempenho e características da carcaça, no músculo de bovinos alimentados com grãos de soja ou gordura protegida, suplementados ou não com monensina.
(1)Receptor ativado por proliferador de peroxissomos alfa. (2)Fator de transcrição de proteínas ligantes aos esteroides. (3)Estearoil CoA dessaturase.
Conclusões
1. O uso de gordura protegida aumenta o ganho de peso dos tourinhos Red Norte, no início do confinamento, enquanto a monensina sódica proporciona maior rendimento de carcaça.
2. A expressão do gene SCD1 tem correlação negativa com o ganho de peso dos tourinhos.