Sistema linfóide de frangos de corte
Efeito da janela de nascimento no incubatório sobre a presença de células cd3 positivas no sistema linfóide de frangos de corte oriundos de diferentes pesos de ovos de matrizes de mesma idade
Dentro de uma mesma incubadora ocorrem diferentes períodos de eclosões, chamado de janela de nascimento. Se muito prolongado, esse período provoca jejum e desidratação das aves, comprometendo o seu desenvolvimento. Esse trabalho teve como objetivo avaliar, por imunohistoquímica, a presença de células CD3+ no timo e baço de animais provenientes de dois pesos de ovos, com eclosão em diferentes períodos (janela de nascimento). Foram utilizados ovos de matrizes com 38 semanas de idade, distribuídos em um delineamento experimental fatorial 3 x 2 sendo 3 períodos de janela de nascimento (mais de 32, entre 32 e 16 e 16 e 0 h antes do período padrão de abertura da máquina) e 2 pesos de ovos (leves e pesados). Animais que permaneceram maiores períodos dentro do nascedouro apresentaram menor presença de células CD3+ no timo e baço, sugerindo maior transporte para outros tecidos. Entretanto, maior avaliação deve ser realizada para definir o efeito desse período de espera dentro do nascedouro sobre o desempenho ao longo da vida da ave.
Palavras Chave: Eclosão; Jejum; Sistema imunológico.
Práticas de manejo adotadas pela indústria avícola na fase inicial da ave podem, potencialmente, revelarem-se desafios adicionais para o desenvolvimento de frangos de corte. Fatores como a linhagem e idade das matrizes, condição nutricional, tamanho e peso do ovo e a demora no acesso a água e alimento afetam diretamente o desenvolvimento inicial, podendo ter conseqüências no desempenho final. Dentro de uma mesma incubadora, é possível haver pintainhos com diferenças de tempo de eclosão de 36 a 48 horas, formando a janela de nascimento (Vieira et al., 2005). Após a abertura padrão das máquinas, fatores operacionais do incubatório como sexagem, vacinação e o transporte até as granjas podem aumentar o tempo de jejum e determinar perdas de peso do pintainho de até 10 % (Cançado & Baião, 2002). Animais submetidos a jejum podem entrar em desidratação, cetose, provocar danos à mucosa intestinal, apoptose celular e danos na musculatura peitoral (Yamauchi et al., 1996), pior aproveitamento da gema (Maiorka et al., 2006) e retarda o desenvolvimento do sistema imunológico (Friedman et al., 2003) bem como imunossupressão por estresse (Handy et al., 1991). Apesar de a literatura ter vasta informação dos efeitos do jejum pós eclosão sobre o desenvolvimento das aves, existe pouca informação sobre o que acontece com animais eclodidos precocemente e que permanecem dentro do nascedouro.
Esse trabalho teve como objetivo avaliar a presença de células CD3+ no tecido linfóide de animais provenientes de dois pesos de ovos, com eclosão em diferentes períodos dentro de uma mesma incubadora.
Os animais foram distribuídos a um desenho experimental fatorial 2X3, sendo 2 pesos de ovos (leves X pesados) e 3 períodos de eclosão (aqueles eclodidos antes das 472 h de incubação, entre 472 e 488 h, e entre 488 a 504 h de incubação) que foram nomeados como animais submetidos à mais de 32 h de permanência no nascedouro após eclosão (+32 h janela de nascimento - JN), entre 32 e 16 h de permanência no nascedouro após eclosão (32 h JN) e entre 16 e 0 h de permanência dentro do nascedouro após eclosão (16 h JN).ç
Em cada período de nascimento, o nascedouro foi aberto e 20 pintinhos eclodidos de cada período e de cada peso foram identificados e permaneceram dentro do nascedouro até o momento estipulado para abertura das máquinas de acordo com o procedimento padrão do incubatório.
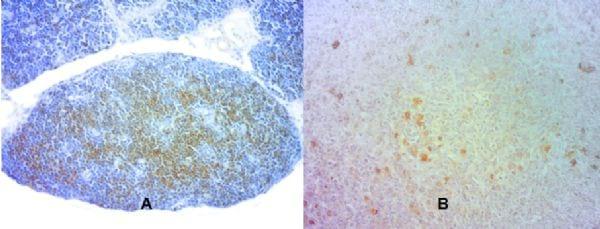
No momento padrão de abertura das máquinas, os animais foram eutanasiados e necropsiados em seguida. Amostras de timo e baço foram coletadas e submetidas a imunohistoquímica para contagem de células CD3+. Foram analisados 20 campos em timo e baço (aumento de 100x). Os resultados foram submetidos à análise de variância e quando houve significância (P<0,05) os fatores foram desdobrados e as médias comparadas pelo Teste de Tukey ao nível de 5 % de probabilidade de erro.
Timo | Baço | |
Fatores principais | ||
Leves | 202,35±18,6 | 13,31±4,10 |
Pesados | 201,28±19,1 | 10,91±10,9 |
+ 32 h | 195,15±11,5 b | 7,55±2,20 |
32 h | 204,2±19,8 ab | 15,02±3,30 |
16 h | 206,1±22,0 a | 13,77±3,50 |
Probabilidades | ||
Peso (P1) | 0,751 | <0,001 |
Período (P2) | 0,021 | <0,001 |
Interação (P1*P2) | 0,602 | <0,001 |
Peso | Período de JN | ||
16 h | 32 h | + 32 h | |
Leves | 16,0 Aa | 14,85 Aa | 9,1 Ab |
Pesados | 11,55 Ba | 15,20 Ab | 6,0 Bc |
Seguindo essa linha de povoamento de células CD3+ no organismo, Mast & Goddeeris (1999) explicam ainda que o baço fornece um microambiente de interação entre células linfóides e não linfóides, e é responsável principalmente por armazenar e transportar linfócitos para circulação e tecidos. No presente trabalho, observa-se que houve interação entre peso de ovos e período de permanência dentro do nascedouro após a eclosão sobre a população de células CD3+ no baço. Animais oriundos de ovos leves que permaneceram mais de 32 h dentro do nascedouro após a eclosão, apresentaram maior proporção de células CD3+ no baço quando comparado aos animais oriundos de ovos pesados que permaneceram eclodidos no nascedouro pelo mesmo período. Pode-se sugerir que os animais oriundos de ovos pesados nascidos precocemente transportaram mais células CD3+ do baço para outros tecidos que os leves. Animais que nasceram no período de 32 a 16 h antes do tempo padrão de abertura das maquinas (32 h JN) não apresentaram diferença na quantidade de células CD3+ no baço com relação ao peso dos ovos, demonstrando que talvez neste período não haja diferença no transporte destas células para outros tecidos entre pintos oriundos de ovos leves ou pesados. Naqueles animais que nasceram próximo ao período padrão de abertura das máquinas (16 h JN) observa-se que pintos oriundos de ovos leves possuem maior quantidade de células CD3+ que pintos oriundos de ovos pesados, sugerindo aqui, mais uma vez maior eficiência de transporte destas células do baço para outros tecidos.
Segundo Handy et al. (1991), aves que permanecem por um tempo superior a 12 horas dentro do nascedouro após a eclosão, já estão sujeitas a processos estressores, devido a maior produção de calor corporal e temperatura excessiva da incubadora, respondendo com uma maior liberação fisiológica do hormônio corticosterona. A permanência elevada desse hormônio pode levar a atrofia do tecido linfóide no timo, bolsa cloacal, baço por apoptose, bem como supressão de resposta humoral e celular (Rogausch et al., 1999). Entretanto avaliando os tecidos do timo e baço microscopicamente das aves neste experimento, não se evidencia apoptose, o que não impede que isso possa ser observado em períodos superiores aos aqui estudados.
O jejum dentro do nascedouro parece não afetar negativamente o desenvolvimento dos órgãos avaliados. Porém, é necessário continuar avaliando o desenvolvimento tecidual nos animais nascidos em diferentes períodos quando esses são submetidos a diferentes condições antes e após o nascedouro, como situações de estresse, temperaturas inadequadas, jejum e desafios a campo.






