1. INTRODUÇÃO
A utilização de aminoácidos sintéticos permite o atendimento das exigências nutricionais em aminoácidos, partindo do princípio de que grãos usados na formulação de dietas não atende de forma satisfatória as exigências das aves, além disso o uso de aminoácidos sintéticos ainda permite formular dietas com teores reduzidos de proteína bruta, teoricamente sem deficiência ou excesso de aminoácidos essenciais, e menor gasto energético na excreção de nitrogênio.
Dentre os aminoácidos essenciais, a metionina se destaca sendo o primeiro limitante em dietas contendo alta proporção de milho e farelo de soja para aves. A exigência deste aminoácido é expressa em metionina+cistina em virtude de parte da metionina ser destinada para síntese de cisteina, que interage por ponte dissulfeto com outra cisteina da cadeia proteica e forma a cistina. Segundo Pinto et al., (2003), a metionina é considerada um aminoácido fisiologicamente essencial, para mantença, crescimento e para o desenvolvimento de penas.
A metionina tem efeito positivo na síntese protéica por atuar em diversos processos que envolvem a expressão de genes relacionados ao crescimento, como maior expressão de mRNA, e maiores níveis de IGF-I circulantes são frequentemente associados a animais que receberam dieta com níveis adequados de metionina (Del Vesco et al., 2013).
Outro aminoácido importante para as aves é a treonina, de acordo com Umigi et. al, (2007), em dietas para aves à base de milho e farelo de soja, a treonina é o terceiro aminoácido limitante, precedido dos aminoácidos sulfurosos e da lisina. É exigido para formação da proteína e manutenção do turnover protéico corporal, além de auxiliar na formação do colágeno, elastina, mucina e produção de anticorpos.
A L-treonina é considerada 100% digestível e está disponível comercialmente, oferecendo maior flexibilidade na formulação de dietas. Sua suplementação permite menor inclusão de alimentos protéicos, acarretando menores excreção de nitrogênio e poluição ambiental (UMIGI et. al, 2007).
De acordo com os fatores citados sobre esses dois aminoácidos torna-se necessário conhecer e compreender o metabolismo de ambos, e os requerimentos nutricionais exigidos pelas codornas japonesas, a fim de praticar uma nutrição de precisão que venha atender as necessidades dos animais, evitando suplementações em excessos ou em deficiências que venham prejudicar as aves ou gerar prejuízos aos produtores.
2. OBJETIVO
O objetivo deste estudo é revisar o metabolismo da metionina e da treonina bem como suas exigências nutricionais para codornas japonesas em diferentes fases de criação.
3. METABOLISMO DA METIONINA
A metionina é o primeiro aminoácido limitante na dieta das aves além de também exercer o importante papel na formulação de dietas para suínos, a forma funcional como nutriente desse aminoácido é a forma isomérica L-Metionina podendo ser encontrada em ingredientes como milho, soja, farinhas de origem animal e outros. Entretanto a forma de como a metionina é normalmente suplementada na dieta é pela fonte sintética na forma seca de DL- Metionina (DL-Met; 99%) ou como DL- Metionina líquida hidróxi análoga (MMTBA, contendo 88% de substância ativa). Segundo Rombola (2008) a metionina possui os isômeros D e L, podem ser convertidas a L- metionina para ser utilizada na síntese de proteína ou no metabolismo intermediário. A forma D é biologicamente inativa, enquanto a forma L é mais comumente encontrada nos tecidos e na forma ativa, dessa forma, os isômeros D das fontes metionínicas deverão ser transformados em L metionina no organismo animal para posterior utilização como componente da proteína (BUTOLO, 2002). Para a conversão dos D-aminoácidos em L-aminoácidos são necessários dois passos: Primeiro o D-isômero deve ser submetido à desaminação oxidativa para o análogo de alfacetoácido correspondente; segundo, este análogo é submetidos a uma reaminação L-específica por meio de uma reação de aminotransferases. Isso não ocorre com a lisina e treonina, pois estas não possuem aminotranferases específicas nos tecidos do animal (D’Mello, 2003).
A função principal da metionina no organismo é a síntese de proteína, onde a cadeia de polipeptídeos é iniciada com este aminoácido. Onde o RNA mensageiro se liga a metionina formando o N-formilmetionil mensageiro para iniciar uma síntese de proteína. A metionina também é doadora de grupos metílicos importantes, para a síntese de colina, lecitina e creatina, além de ser doadora de enxofre, um mineral essencial para crescimento e manutenção das penas e precursora da cistina, que era considerada um aminoácido essencial, entretanto é possível obtê-la de dieta onde não ocorre falta de metionina, pois em condições normais, a metionina pode ser catabolizada e convertida em cistina.
O seu metabolismo é complexo e extremamente importante, pois a partir dele diversos compostos com funções fisiológicas são formados. O seu ciclo pode ser dividido em duas etapas, sendo que em cada uma ocorrem dois processos, entretanto nada impede que ocorram as duas etapas ao mesmo tempo, pois ambas estão interligadas, a primeira é a metilação com posterior remetilação e a segunda é a metilação com posterior transulfuração.
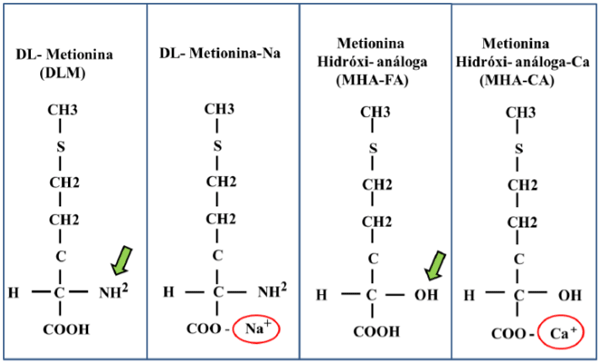
3.1. Estrutura química e Absorção intestinal
A metionina é um aminoácido do grupo apolar e sulfurado, pois contém enxofre no seu radical e pode ser encontrada em 4 formas sintéticas, (Figura 1), DL-Metionina (DLM): mistura racêmica entre as formas L (50%) e D (50%) em pó, apresenta 99% de atividade; DL-Metionina- Na (DLM-Na): mistura racêmica entre as formas L (50%) e D (50%) do sal de sódio na forma líquida, com 40% de atividade; Metionina hidróxi-análoga-ácido livre (MHAAL): apresenta-se sob a forma líquida com 88% de atividade de metionina; E o sal de cálcio de metionina hidróxi-análoga (MHA-Ca): em pó apresenta cerca de 12% de cálcio e 84% de atividade de MHA. Os análogos diferenciam-se da metionina por apresentarem um grupamento hidroxila (OH) no lugar do grupamento amina (NH2), localizado no carbono alfa da molécula (Figura 1).
Figura 1. Estrutura química das de fontes de metionina. Fonte: Criada pelo autor
Os análogos de metionina têm biodisponibilidade diferentes da fonte DL-Metionina, o termo é definido como "a proporção da quantidade do aminoácido ingerido que sofre absorção intestinal e é então utilizada pelo corpo". A utilização e o transporte da metionina absorvida nos tecidos incluem absorção celular e conversão para uma forma que realiza alguma função bioquímica.
Os produtos da digestão proteica apresentam particularidades em sua absorção, principalmente em relação ao sistema de transporte específicos para cada aminoácido (Dalibard et al., 2014). Tal sistema é saturável, por ser dependente de transportadores. Cada aminoácido apresenta uma velocidade de absorção, em função de sua afinidade por seu carreador específico. Os aminoácidos na forma de L-isômeros são mais rapidamente absorvidos que aquelas na forma de D-isômeros, em função da maior afinidade dos carreadores pelos primeiros (SILVA et al., 2014).
Ao chegar no intestino delgado a DL-metionina pode ser absorvida em dois locais: Membrana borda em escova e membrana baso lateral, a DL-metionina pode ser absorvida de maneira ativa, nesses dois locais o que permite que esta seja transportada contra o seu gradiente de concentração, esse transporte é realizado pelo sistema Y+L e pela proteína B0AT-1, (WAGNER et al, 2001) ambos os tipos de transporte são dependentes de sódio. O sistema Y+L faz parte do sistema de transportadores de aminoácidos heterodiméricos que são compostos de duas subunidades, uma proteína de membrana de cadeia leve e uma proteína de membrana de cadeia pesada, para o transporte de metionina este sistema é composto pelas proteínas de transmembrana Y+LAT1 (cadeia leve) e a 4F2hc (glicoproteína de cadeia pesada).
A DL-metionina pode ser ainda absorvida pelo transporte facilitado, pelo sistema de transporte L, sendo também um sistema de transportadores de aminoácidos heterodiméricos destinado ao transporte de aminoácidos neutros e hidrofóbicos, LAT1 (cadeia leve) e a 4F2hc (glicoproteína de cadeia pesada), este transporte é independente de sódio. (HIRST BH, 1992; KUTCHAI HC, 1990). A metionina hidroxi é absorvida de forma passiva, por difusão, o que requer a passagem de um meio com maior concentração da substância para um meio menos concentrado (DIBNER, 1992).
Para ser ter função biológica ativa a MHA precisa ser convertida a metionina, já que ela não possui grupamento amino, de acordo com Martín-Venegas et al. (2006), a conversão bioquímica metionina hidróxi-análoga para DL-metionina segue dois processos enzimáticos: oxidação do carbono alfa, seguido pela transaminação. A primeira reação forma o cetoácido intermediário ácido 2-oxi-4-(metiltio) butanóico ou Ceto-metionina.
Diferentes enzimas catalisam a oxidação dos dois esteroisômeros da DL-MHA. Todavia, a conversão destes ocorre simultaneamente, a fim de produzir o intermediário Ceto-metionina. A enzima específica para L-MHA é a L-2-hidroxi ácido oxidase (L-HAOX), encontrada nos peroxissomos do fígado e rins das aves. A D-MHA requer a enzima mitocondrial D-2-hidroxi ácido desidrogenase (D-HAD) encontrada em vários tecidos, incluindo fígado, rins, músculo esquelético, intestino, pâncreas, baço e cérebro (DIBNER e KNIGHT, 1984). A segunda etapa para conversão a DL-metionina é a transaminação, na qual não constitui um fator limitante no processo de conversão da metionina hidróxi-análoga.
Todas as substâncias citadas MHA e DL-metionina têm dois isômeros (L e D), pois suas moléculas têm o carbono alfa assimétrico, ou seja, apresentam quatro ligantes diferentes. Assim, os isômeros D das fontes metionínicas deverão ser transformados em L-metionina no organismo animal para posterior utilização como componente da proteína, para isso a enzima D-metionina oxidases atua no fígado realizando esta conversão. (BUTOLO, 2002).
3.2. Biossíntese de Metionina
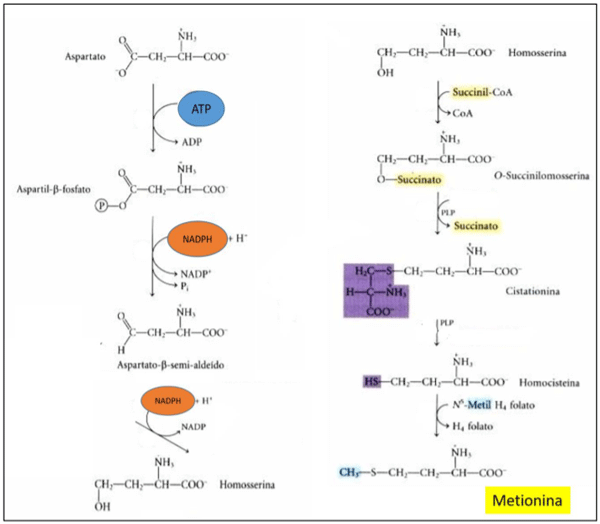
Mesmo sendo um aminoácido considerado essencial, existe uma rota metabólica que acontece a biossíntese da metionina, entretanto a velocidade com que essa rota acontece não é suficiente para atender as exigências dos animais, a metionina é sintetizada apartir de aspartato. Segundo Lehninger, (2018), o aspartato recebe a transferência de um grupo de fosfato, da enzima aspartato quinase, formando o composto Aspartil-β-fosfato, este é reduzido a Aspartato-β-semi-aldeído, esta reação é realizada pela Aspartil-β-fosfato desidrogenase que transfere um hidrogênio da molécula de NADPH para o Aspartil-β-fosfato e retira o fosfato da mesma, o Aspartato-β-semi-aldeído que foi formado nesta reação recebe mais um hidrogênio proveniente de NADPH com atuação da enzima homoserina desidrogensase, formando a homoserina, esta sofre ação da enzima homoserina aciltransferase, onde a enzima faz o acoplamento de uma molécula de succinil na homoserina, formando o O-Succinilomoserina, um intermediário responsável pela formação de cistationina, através da reação realizada pela γ- Cistationina sintase, a cistationina é convertida em homocisteina pela ação da enzima Cistationina-β-liase, essas ultimas reações, só acontece devido a presença de piridoxal fosfato que atua como cofator na ativação das enzimas, a biossíntese de metionina é completada quando um grupamento de metila vindo do N-Metil H4 folato é transferido para a homocisteína, essa reação é realizada pela enzima metionina sintase e é dependente de vitamina b12. Abaixo segue a figura que representa os passos da rota metabólica da biossíntese de metionina.
Figura 2. Rota de síntese de metionina. Fonte: Lehninger, 2018.
3.3. Via de degradação da Metionina, formação da homocisteina e reações de remetilação e transufuração.
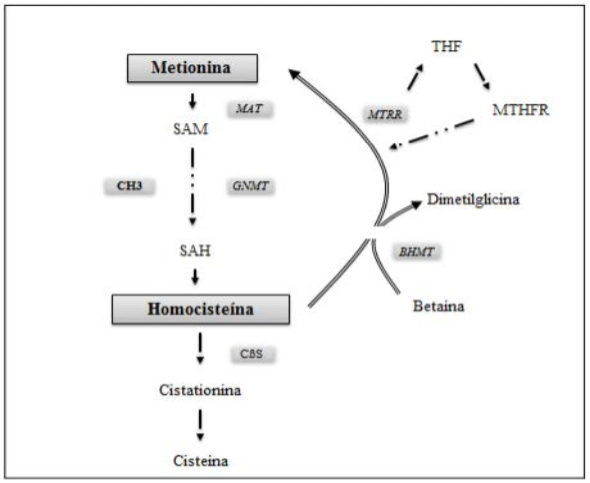
A metionina dietética é degradada em uma rota metabólica envolvendo várias reações químicas, na qual são formados vários metabolitos, dentre eles a homocisteina é um metabólito intermediário no processo de reações de transmetilação da metionina, onde essas reações de ocorrem em todas as células do organismo, quando grande parte da metionina é ativada por ATP para formar S-Adenosilmetionina (SAM). Esta ação é ativada pela enzima Metionina Adenosiltransferase (MAT), a qual utiliza a adenosina do ATP para formar SAM.
A SAM pode ser sofrer ação da enzima Glicina N-metiltransferase (GNMT), a qual atuará quando houver alta concentração de metionina no organismo em função da ingestão do aminoácido essa enzima catalisa a reação que transfere o grupamento metila da SAM para a formação de sarcosina, utilizando como produto a glicina, portanto a SAM passa a ser S-Adenosilhomocisteína (SAH). De acordo com Selhub, (1999), esta reação tem função de regular a taxa de SAM e SAH, a SAM. A S-Adenosilhomocisteína será hidrolisada por meio da ação da enzima SAH-hidrolase formando a homocisteina. Brosnan et. al, (2004) comenta que depois da síntese de homocisteina esse composto poderá seguir duas vias, a via da remetilação ou formação de novo de metionina a partir de homocisteína, que ocorre em todos os tecidos e em parte no fígado, ou ser metabolizada no processo de transulfuração pelo fígado, rins, intestino delgado e pâncreas).
Na remetilação a homocisteína recebe o grupamento metila A homocisteina é convertida em metionina por intermédio de duas enzimas, a metionina sintase (MS) e betaína:homocisteína metiltransferase (BHMT). Pela ação da metionina sintase, enzima dependente de vitamina B12, o metiltetrahidrofolato doa um grupo metil para a homocisteína, que é convertida então em metionina. Já, na reação catalisada pela betaína:homocisteína metiltransferase, o processo se dá de maneira similar, entretanto, neste caso o grupo metil é doado pela betaína.
Nas reações da via de transulfuração a homocisteína sofre ação da enzima Cistationina-β-sintase. γ- Cistationina sintase, ambas ativadas pelo piridoxal 5-fosfato (Vitamina B6), para a formação de cisteína.
Figura 3. Metabolismo da homocisteína e enzimas responsáveis pela transmetilação remetilação e transufuração. Fonte: (Criado pelo autor).
A capacidade do organismo em discriminar quando utilizar a via de remetilação ou de transulfuração denota seu poder de adaptação às diferentes quantidades de metionina disponíveis no organismo, evidenciando uma regulação coordenada entre essas vias (SELHUB, 1999).
Estudos experimentais in vitro sugerem que essa coordenação se dá por pelo menos dois mecanismos: No primeiro mecanismo quando a concentração de metionina está em níveis altos, a SAM atua como inibidor alostérico da Metilenotetrahidrofolato redutase (MTHFR) bem como ativador da enzima Cistationina-β-sintase que é uma enzima da via de transufuração, (FINKELSTEIN et al., 1984), sendo assim a síntese de N-5-metiltetrahidrofolato substrato necessário para as reações de remetilação é suprimida, favorecendo as reações de transulfuração;
O segundo mecanismo é a regulação da concentração intracelular de SAM. No fígado, a SAM é regulado por uma reação catalizada pela enzima GNMT onde esta transfere um grupamento CH3 da SAM para o grupamento amino da glicina, formando sarcosina. Abundantemente encontrada no fígado, a enzima GNMT é fortemente inibida pela N-5-metiltetrahidrofolato, principal doador de grupo de metila para o favorecimento da remetilação e formação de metionina. Neves et al., (2004) relata que dietas ricas em proteínas animais contendo metionina, 70% da homocisteina é catabolizada pela enzima enzima Cistationina-β-sintase (Via transulfuração), nas dietas hipoprotéica, a via da remetilação é favorecida e apenas 10% é catabolizada pela enzima Cistationina-β-sintase.
3.4. Formação de Cisteína
A Metionina e a cisteina são metabolicamente relacionadas via ciclo de transsulfuração, que permite a metionina servir como fonte de enxofre para síntese da cisteina, quando a exigência de cisteína é maior do que a taxa de síntese da mesma, ela passa a ser considerada como aminoácido condicionalmente essencial. As recomendações nutricionais desses dois aminoácidos são expressas como metionina+cistina, pelo fato da metionina participar na síntese de cisteina em um processo irreversível. As pontes dissulfetos envolvem duas cisteínas localizadas em posições específicas da sequencia de aminoácidos das cadeias polipeptídicas das proteínas e forma cistina, portanto, cistina em tese não existe, digerida a proteína restará uma mistura de aminoácidos contendo como aminoácidos sulfurosos metionina e cisteína.
A cistina é um aminoácido sulfurado formado pela ligação de dois átomos de enxofre de duas cisteína, Assim como a metionina Tesseraud et al.(2009) relataram que a cistina é fundamental para a formação de tecidos importantes como pele e penas, por participar da síntese de queratina, proteína estrutural que compõe grande parte desses tecidos. Além de promover a formação de glóbulos brancos e vermelhos ativada pelo sistema hematopoiético. A cistina faz parte do sistema imune, auxiliando na cicatrização e fortalece a formação do tecido conjuntivo e formação de taurina, composto que participa na formação do ácido biliar (Importante na digestão de lipídeos).
Tem sido considerado que no mínimo 55% dos aminoácidos sulfurados na ração devem ser fornecidos na forma de metionina para as aves em todas as fases de criação (Rostagno et al., 2017). Além disso, a metionina e a cistina são consideradas aminoácidos fisiologicamente essenciais para mantença, crescimento e para o desenvolvimento das penas (Pinto et al., 2003). Com relação ao desenvolvimento de penas, Leeson e Summer (1997) descreveram que cerca de 2% da metionina e de 25% da cistina da dieta, são necessárias para o desenvolvimento de penas.
A formação de cistina no organismo faz parte de uma reação irreversível, pois a cistina não pode ser convertida em metionina. Assim, torna-se necessário determinar os níveis adequados destes aminoácidos, a fim de se atender esta interrelação (LEHNINGER, 2018).
No processo de transformação da metionina em cistina a metionina precisa ser convertida em homocisteína, onde este composto segue a via metabólica da transufuração, onde a homocisteina é convertida em cistationina. Aproximadamente 50% da homocisteína é convertida, irreversivelmente, à cistationina, reação catalizada pela enzima cistationina ß-sintetase (CBS), esta enzima depende do fosfato de piridoxal (vitamina B6), para ser ativada. A cistationina é convertida em cisteína onde a cistationina é hidrolisada pela enzima γ- Cistationina sintase, ativada por vitamina B6, para formar cisteína e α-Cetobutirato, a cisteína sofre oxidação e se liga com outra molécula de cisteína através dos seus átomos de enxofre para formar a cistina. Finkelstein, (1998), comenta que grandes quantidades de metionina na dieta, ou de S-adenosil-metiltransferase, a rota de transsulfuração é a mais ativada, havendo maior produção de cisteín ocorrendo principalmente no fígado e nos rins.
3.5. Participação da metionina na via gliconeogênica e na síntese de glutationa
A Gliconeogênese é o processo através do qual precursores como lactato, piruvato, glicerol e aminoácidos são convertidos em glicose (Lehninger, 2018). A metionina pode ser classificada como aminoácido glicogênico, pois no seu metabolismo ela pode ser convertida em succinil- CoA um intermediário do ciclo do ácido cítrico, e posteriormente o succinil- CoA é convertido em ácido pirúvico dando origem a via gliconeogenica.
O caminho metabólico para chegar em ácido pirúvico passa pelas reações de metilação e transufuração, o caminho se segue a partir da cistationina em cisteína após a homocisteínta perder sofrer ação da cistationina beta-sintase receber o esqueleto de carbono da serina, formando a homoserina, esse composto resultante é decomposto em succinil-coA através da enzima homoserina succinil transferase, o succinil-coA é então metabolizado em ácido pirúvico (Parsons& Baker, 1994; Swenson & Reece, 1996).
A biossíntese da Glutationa (GSH) ocorre na maioria dos tecidos a partir de três aminoácidos precursores. Entre estes está a cisteína que durante o metabolismo pode ser sintetizado a partir da metionina através da rota de transsulfuração da homocisteína (Shoveller et al., 2005). A primeira etapa da síntese da GSH, ocorre uma ligação entre os aminoácidos ácido glutâmico e cisteína, por intermédio da enzima γ- glutamilcisteína sintetase, resultando em γ-L-glutamil-L-cisteína, logo pós ocorre uma ligação desse então dipeptídeo com a glicina, pela ação da enzima glutationa sintetase (GSS). De acordo com Huber et al., (2008). Existe um mecanismo de regulação da síntese de GSH, para prevenção de quantidades excessivas de glutationa, onde γ-glutamilcisteína sintetase, pode sofrer um feedback negativo apartir da GSH, sendo este mecanismo responsável para que não haja acúmulo do intemediário, γ-glutamilcisteína.
Há uma estimativa de que cerca de 50% da produção da glutationa é de origem da homocisteína, através da rota de transsulfuração, onde o aumento das condições de estresse oxidativo, é requisitado maior produção de glutationa, e assim, maior atividade da cistationina ß-sintase, ocorrendo maior expressão desta enzima (MOSHAROV et al., 2000). Os resultados de Persa et al. (2004) confirmam que a presença de radicais livres podem induzir a super expressão de CBS e inibir a metionina sintase, estimulando assim a transsulfuração e maior produção de cisteína e glutationa.
Além da importante participação da metionina na síntese da glutationa, alguns estudos demostram o efeito antioxidante direto da metionina sobre o estresse oxidativo (Stadtman et al., 2002; Moskovitz et al., 2001; Levine et al., 2000). As células quando estão sobre o estresse oxidativo, espécies reativas de oxigênio reage com resíduos de metionina formando metionina sulfóxido, no entanto, a maioria das células contém a enzima metionina sulfóxido redutase, a qual cataliza a metionina sulfóxido de volta à metionina.
3.6. Exigências nutricionais de metionina+cistina para codornas japonesas
A metionina desempenha importantes funções no organismo das aves, desde a formação dos tecidos corporais, bem como substancias capazes de promover a manutenção das atividades fisiológicas das aves, portanto a inclusão dietética abaixo do valor de exigido pelas aves pode provocar sérios prejuízos ao animal, como a redução do crescimento, diminuição das funções orgânicas e aumentar a idade da primeira postura.
Entretanto, os prejuízos acontecem também quando a metionina é inclusa em valores superior ao exigido, como reações de antagonismo com outros aminoácidos, toxidez, e ainda de acordo com Parr & Summers, (1991) a metionina adicionada à ração em níveis muito superiores às exigências do animal, apresenta risco de fígado gorduroso na ave, portanto torna-se necessário o desenvolvimento de estudos que indiquem os volores exatos da exigência deste aminoácido para evitar esses problemas.
De acordo com o NRC (1994), as dietas de codornas japonesas devem conter 0,75% e 0,70% de metionina + cistina total nas fases de crescimento e postura, respectivamente, no entanto várias pesquisas são desenvolvidas ao longo dos anos sugerindo valores de exigência diferentes. Algumas tabelas de exigências nutricionais de codornas sugerem níveis de metionina acima das recomendações do NRC (1994) podendo resultar em melhor desempenho, Silva & Costa (2009) e Rostagno et al., (2017), dividem a fase de crescimento em dois períodos (cria e recria) os valores de exigência de metionina+cistina total sugeridos por Silva & Costa nos períodos de cria e recria são de 0,900%, 0,830 e 0,780% nas fases cria, recria e de postura respectivamente, os valores de metionina total sugeridos por Rostagno são de 0,827%, 0,770% e 1,047% nas fases cria, recria e de postura respectivamente.
Os valores de exigência de metionina+cistina nas tabelas de Silva & Costa (2009) e Rostagno et al., (2017), ainda podem ser sugeridos com base no aminoácido digestível, onde acontece uma diminuição na quantidade exigida pelas aves considerando que uma parte da exigência total não será utilizada pelas aves, as recomendações com base na metionina+cistina digestível para de Silva & Costa é de 0,800%, 0,740% e 0,700% nas fases cria, recria e de postura respectivamente. Os valores de de metionina+cistina digestíveis para Rostagno são 0,740%, 0,693% e 0,940% cria, recria e de postura respectivamente.
As tabelas citadas ainda propõem outros valores de exigência diferentes do NRC 1994 em ambas fases de criação, na tabela proposta por Silva & Costa (2009), além da fase de cria e recria, os autores sugerem uma exigência de metionina+cistina digestível no período total de crescimento de 1 a 42 dias de 0,750%. Para a fase de postura os autores ainda incluem a exigência de metionina+cistina na fase de postura II, sugerindo 0,800% e 0,720% de metionina+cistina total e digestível respectivamente. A tabela proposta por Rostagno et al. (2017), ainda vai mais além quanto a exigência de metionina+cistina na fase de postura na qual os autores recomendam valores de exigência de acordo com o peso das aves, 0,942 0,908 e 0,869% de metionina+cistina digestível para animais de 190, 200 e 210g respectivamente e de metionina total são1,047, 1,006 e 0,963% para animais de 190, 200 e 210g respectivamente.
Em um experimento de dose-resposta, com codornas japonesas de 7 a 21 dias de idade, Khosravi et al. (2015) estudaram sete níveis de metionina total (0,38, 0,43, 0,48, 0,53, 0,58, 0,63 e 0,68%) em uma dieta basal com nível de cisteína mantido a 0,39%, para garantir que as dietas experimentais fossem individualmente deficientes em metionina. Os autores conseguiram estimar o melhor nível para ganho de peso de 0,52% de metionina e 0,91% de metionina + cisteína total na dieta.
Um estudo realizado com codornas japonesas de 1 a 42 dias de idade, Abd-Elsamee (2014), testaram dois níveis de PB, baixo e médio (20 e 22%) e associaram com dois níveis de metionina (0,4 e 0,5%) e dois níveis de ácido fólico (1,7 e 3,4 mg/kg diet). Os autores observaram que independentemente do nível de PB na dieta os maiores níveis de metionina testados associados aos níveis de ácido fólico, melhoraram o desempenho, a digestibilidade dos nutrientes, o balanço de nitrogênio, as características da carcaça e a rentabilidade da criação, os autores comentaram que o efeito foi causado pelo processo de remetilação da homocisteína para a metionina, realizado pela ação do ácido, proporcionando um efeito positivo em dietas com baixos teores de metionina. Pinto et al. (2003), estudou os níveis 0,48, 0,53, 0,58, 0,63, 0,68 e 0,75% na dieta de codornas japonesas na fase de crescimento, buscando determinar a exigência de metionina + cistina, na fase de crescimento, sem alterar o nível de lisina digestível. A melhor relação metionina+cistina: lisina para as codornas japonesas em crescimento foi de 0,66, sendo a exigência em metionina + cistina digestível estimada em 0,758%, resultado semelhante ao proposto pela tabela de Silva e Costa (2009).
Outro experimento com objetivo de avaliar a relação entre metionina + cistina:lisina digestível na dieta de codornas japonesas na fase de crescimento (1 a 40 dias) foi conduzido por Lima (2012). As relações entre metionina + cistina e lisina foram de 0,54; 0,60; 0,66; 0,72 e 0,78, podendo concluir que a relação metionina + cistina: lisina digestível de 0,73 (0,766 % de M+C /1,05 % de lisina) na dieta de 1 a 40 dias proporcionou crescimento uniforme e desempenho satisfatório de codornas japonesas na fase de postura.
Scottá et al. (2011) desenvolveram um estudo com o objetivo de determinar o melhor nível de metionina + cistina digestível e a melhor relação metionina + cistina digestível:lisina digestível associados com diferentes níveis de proteína para codorna em postura, formando um esquema fatorial 2x5, dois níveis de proteína bruta (19,5% e 21,5%) e cinco níveis de metionina + cistina digestível (0,60%; 0,67%; 0,74%; 0,81% e 0,88%). Os autores relataram que o nível de 19,5% de proteína, 0,60% de metionina + cistina digestível e relação metionina + cistina digestível:lisina digestível de 0,66% foram suficientes para otimizar a produção. E para o nível de 21,5% de proteína 0,851% de metionina + cistina digestível com relação metionina + cistina digestível:lisina digestível de 0,935% houve melhor produção de ovos.
Codornas japonesas na fase de produção, foram submetidos por Costa et al. (2009) a um ensaio para avaliar a exigência de metionina+cistina digestível necessária para maior produção e melhor qualidade dos ovos, onde o nível estimado de metionina + cistina digestível foi de 0,696%.
Segundo Harms et al. (1999), a metionina é um aminoácido que desempenha um controle no tamanho dos ovos, os autores ainda comentam que a poedeira consome energia para sustentar a quantidade de ovos produzidos, no entanto o peso dos ovos ainda é dependente dos níveis de aminoácidos da dieta, sendo os sulfurados os mais importantes, esta afirmação pode ser confirmada com os estudos de Shafer et al. (1996) no qual os autores evidenciaram um aumento dos sólidos totais dos componentes dos ovos com o aumento dos aminoácidos lisina e metionina, na dieta.
4. METABOLISMO DA TREONINA
A treonina é o terceiro aminoácido limitante em dietas para frangos de corte após a metionina e a lisina, utilizando-se rações a base de milho e farelo de soja. A treonina (Thr) está envolvida em importantes funções biológicas como a manutenção, integridade e imunidade de diferentes mucosas e, como consequência, sua exigência pode variar de acordo com a importância de cada função (Azzam et al., 2011; Mao et al., 2011).
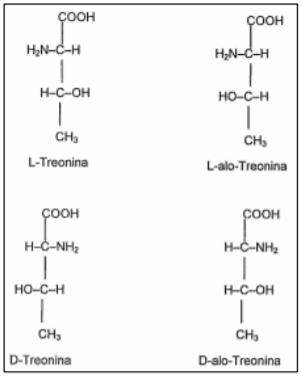
A sua estrutura química (Figura 4), (ácido α-amino-β-hidróxi-n-butírico) foi determinada na década de 30, sendo o último dos 20 aminoácidos naturais a ser conhecido, a sua estrutura contém dois átomos de carbono assimétricos, permitindo a existência de quatro estéreo-isômeros ópticos possíveis: a L e D treonina e a L e D alotreonina (DE BLAS et al., 2000).
A treonina ao contrário dos outros aminoácidos não é transaminada, ou seja, não pode ser sintetizada a partir de outros aminoácidos, porém outros aminoácidos podem ser sintetizados a partir dela como a glicina e a serina. Segundo KIDD et al., (2005) uma vez que aves e suínos não conseguem realizar as reações de transaminação entre os isômeros, da treonina, os mesmos só podem utilizar o isômero L.
Figura 4. Estrutura química dos estéreo isômeros de treonina Fonte: DE BLAS et al. (2000)
A treonina é um aminoácido polar, de estrutura química C₄H₉O₃N, que possui cadeia hidrofílica e contribui, juntamente com a serina, com a hidrofilia das proteínas, quando presente em regiões expostas da cadeia peptídica (De BLAS et al., 2000). A molécula de treonina possui um grupo hidroxila que é capaz de formar ligações com a água caracterizando-se como molécula hidrofílica. Segundo Leeson & Summers (2001), a sua equivalência proteica situa-se em torno de 74% enquanto que sua digestibilidade é de 100%.
4.1. Vias de degradação da treonina e conversão em glicina
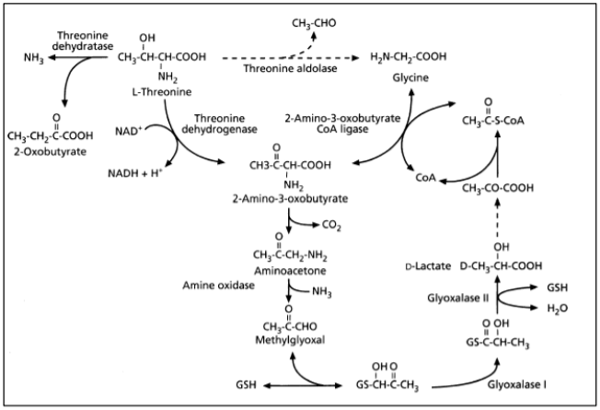
A treonina faz parte do grupo dos aminoácidos cetogênicos, esses aminoácidos recebem essa nomenclatura pois podem ser convertidos em ácidos graxos ou corpos cetônicos, sendo degradados a acetil-CoA ou acetoacetato. A treonina é o último aminoácido descoberto em proteínas e o seu metabolismo em animais não foi totalmente resolvido. Entretanto é geralmente conhecido que a treonina é metabolizada através de três rotas catalisadas por três enzimas diferentes: Treonina-3-desidrogenase, Treonina dehiratase e Treonina aldolase.
Quando acontece atuação da enzima Treonina-3-desidrogenase a treonina é convertida a 2-amino-3-oxobutirato, essa reação é dependente de NAD, e consequentemente acontece a formação do NADH, o 2-amino-3-oxobutirato pode seguir dois caminhos, ser é descarboxilado espontaneamente e formar aminoacetona ou ser convertido em glicina e acetil CoA (Aoyama e Motokawa, 1981). Quando a aminoacetona é desativada, o produto, metilglioxal é convertido em D-lactato na presença de glutationa pela glioxalase I (lactoilglutationa-liase) e glioxalase II (hidroxiacilglutationa hidrolase).
A conversão de glicina e acetil coa, é efetuada pela ação da enzima 2-amino-3-oxobutirato CoA-ligase, que é dependente de piridoxal fosfato, (Ray et al., 1991), essa enzima faz a partição da molécula de 2-amino-3-oxobutirato e forma a glicina, acetil e transfere a coenzima A de sua estrutura para o acetil que foi anteriormente formado.
A segunda e terceira via de degradação da treonina são mais curtas do que a primeira via, a segunda via é efetuada pela enzima Treonina dehiratase essa enzima catalisa a reação de clivagem da treonina em 2-oxobutirato e amônia. A terceira enzima, treonina aldolase catalisa a decomposição de treonina em glicina e acetaldeído, sendo assim a glicina pode ser formada em duas vias de degradação da treonina, abaixo segue a figura que demostra as três rotas de degradação da treonina.
Figura 5. Rotas de degradação da treonina. Fonte: Akagi, 2004
4.2. Absorção intestinal de treonina e participação da formação de mucina
A treonina dietética é absorvida no intestino delgado, principalmente no íleo. Após a absorção, a treonina não passa inteiramente ao sangue da veia porta; uma parte significativa da treonina digestível é utilizada pelo próprio trato digestório.
A treonina ao chegar no intestino pode ser transportada pelo sistema de transporte passivo por difusão facilitada por meio de um carreador, no qual este transporte é independente de sódio, este sistema está presente em dois lugares no intestino, na membrana apical e na baso lateral, nos dois lugares o transporte é realizado por transportadores heterodiméricos, sendo na membrana apical o transporte é realizado pelo sistema b0+ e na baso lateral pelo sistema asc, estes sistemas foram descritos por Wagner et al, (2001) no qual o sistema b0+ envolve a ação de duas proteínas de membrana, a b0+AT (Cadeia leve) e a rbAT (Glicoproteina de cadeia pesada), e o sistema asc, que também envolve os transportadores heterodiméricos é composto pelas proteínas ascAT1 (Cadeia leve) e a 4F2hc (Cadeia pesada). A L-treonina pode ser absorvida por transporte ativo dependente de sódio, através de três proteína de transporte, B0AT-1, ATB0,+ e pela ASCT2. (BROER et al. 2002).
O sistema predominante de transporte de treonina na membrana basolateral é o sistema passivo por difusão facilitada, esse fato se deve por conta da membrana basolateral ser mais permeável aos aminoácidos, do que a membrana borda em escova, no entanto o sistema ativo dependente o Co-transporte Na+, (KUTCHAI HC.1990).
Além da absorção de aminoácidos ser exclusiva do trato gastrintestinal, essa parte do organismo tem uma relação importante com a treonina, pois esse aminoácido é usado para a síntese de mucina, um tipo de proteína responsável pela proteção da mucosa gastrintestinal, além de ser o principal componente desta camada. Segundo Linden et al. (2008), o muco atua como uma camada de proteção do epitélio intestinal, prevenindo contra danos e infecção por bactérias patogênicas. Law et al., (2007) ainda comentam, que o revestimento mucoso do intestino efetuado pela mucina ainda protege o intestino contra ação de toxinas, autodigestão e abrasão física.
Segundo Le Bellego et al. (2002), aproximadamente 50% da treonina fornecida na dieta fica retida em nível intestinal, sendo utilizada principalmente para síntese de mucinas.
Essa camada de gel mucoso, secretada pelas células caliciformes, é constituída por 95% de água e 5% de mucinas, glicoproteínas particularmente ricas em treonina (CORFIELD et al., 2001). Segundo Santos et al., (2013), a produção de mucina está intimamente relacionada aos níveis de treonina na dieta, no qual a sua suplementação dietética em níveis elevados aparentemente podem auxiliar na proteção do epitélio intestinal de pintos de corte, por outro lado Faure et al. (2006), relata que se a treonina for fornecida de forma limitada na dieta a síntese de mucinas intestinais é prejudicada.
Estima-se que mais da metade da treonina consumida seja utilizada em nível intestinal para as funções de mantença (CORZO et al., 2007). Portanto grande parte dos requerimentos de treonina não está ligado a síntese de proteína muscular, mas com funções de relacionadas ao trato gastrintestinal. Segundo Le Bellego et al., (2002) a treonina dietética deve ser fornecida em um nível adequado pois é essencial para permitir uma função digestória da importância das secreções digestórias mantendo a saúde do intestino e para o processo digestório.
4.3. Exigência nutricional de Treonina para codornas japonesas
As codornas japonesas exigem 20 tipos de aminoácidos para realizar as funções vitais de mantença, crescimento e produção, no entanto desses 20 apenas 9 são considerados essenciais, segundo D’Mello (2003) dentre os aminoácidos essenciais apenas lisina e os sulfurosos são os aminoácidos mais estudados em determinação de exigência nutricional, sendo assim os estudos com treonina ainda são menores com relação a esses citados.
Os requerimentos de treonina para codornas japonesas de acordo com as fases de criação, podem ser encontrados em algumas tabelas de exigências nutricionais de aves. Segundo o NRC (1994), os requerimentos de treonina na fase de crescimento são de 0,650% de treonina total e na fase de postura o NRC recomenda 0,740% de treonina total.
Os requerimentos de treonina sugeridos por Silva e Costa (2009) são de 1,020% e 0,870% total e digestível respectivamente na fase de cria, para a recria os valores sugeridos são de 0,960 e 0,820% total e digestível respectivamente, os autores ainda sugerem um valor fixo de exigência para a fase de crescimento total sendo recomendado 1,020% de treonina digestível de 1 a 42 dias. Na fase de postura os autores recomendam valores de exigência para duas fases (Postura 1 e postura 2), na postura 1 os requerimentos são de 0,790% e 0,670% total e digestível respectivamente, na postura 2 são de 0,860% e de 0,730% de treonina total e digestível respectivamente.
Os requerimentos de treonina mais recentes de tabelas nacionais são os sugeridos por Rostagno et, al.(2017), os autores assim como Silva e Costa (2009) dividem a fase de crescimento em cria e recria, estabelecendo valores de exigência para ambas, no entanto eles não utilizaram o valor de exigência único para a fase completa proposto por Silva e costa (2009), para a cria os autores sugerem 0,851% e 0,733% de treonina total e digestível respectivamente, na fase de recria as exigências recomendadas são de 0,850% e 0,734% de treonina total e digestível respectivamente. Na fase de postura os autores sugerem valores de exigência de acordo com o peso das aves, sendo a recomendação de 0,827%, 0,795% e 0,761% de treonina total para aves de 190, 200 e 210g respectivamente, os valores digestíveis são de 0,701%, 0,675% e 0,646%, para as mesmas faixas de peso.
Segundo Kaur et al. (2008) as codornas japonesas diminuiram o consumo de ração, mantendo o ganho de peso, proporcionando melhores resultados de conversão alimentar, quando foram alimentadas com dietas a base de milho e farelo de soja contendo 1,020% de treonina digestível durante o período de 0 a 5 semanas, resultados semelhantes sobre o desempenho de codornas japonesas em crescimento foram descritos por Young et al. (1978), valores iguais ao recomendado por silva e costa (2009), para o período total de crescimento. Resultados semelhantes foram relatados por Samuel et al., (2017) onde verificaram que o peso do primeiro ovo foi maior em codornas que receberam 1,08% de treonina total de 2 a 6 semanas de idade. Benites (2018) realizou vários ensaios para verificar as exigências de treonina na fase de crescimento, o estudo foi dividido em três etapas (1 a 7; 8 a 14 e 15 a 42 dias) no qual foram avaliados cinco níveis crescentes de treonina digestível, (0,58; 0,70; 0,82; 0,94 e 1,06%), o autor não encontrou efeito significativo entre os níveis de treonina digestível em nenhum parâmetro de desempenho em todos os ensaios, contatando que o nível de 0,580% de treonina é suficiente para atender as exigências de treonina digestível para as aves.
Estudos de suplementação de L-Treonina nas rações de codornas japonesas em crescimento, descritos por Baylan et al. (2006) utilizaram seis níveis de treonina total nas dietas, que foram de 0,810; a 1,06%, variando 0,050% de treonina. Em rações contendo 23% de proteína bruta, os autores verificaram que a suplementação da treonina nas rações não influenciou o peso vivo e a conversão alimentar das aves, nem os pesos das partes da carcaça. Os autores concluíram que a suplementação de treonina não afeta o crescimento e que isso pode estar relacionado a uma possível adaptação aos níveis nutricionais de treonina nas rações.
Umigi et. al. (2007) trabalharam com as aves na fase de postura e estudaram os níveis 0,650; 0,700; 0,750; 0,800; 0,850, e verificaram que para proporcionar os melhores resultados de desempenho e de qualidade de ovos, a codorna japonesa exige 0,650% de treonina digestível totalizando um consumo diário de 149,2 mg de treonina digestível.
Ainda na fase de produção de ovos em postura, Shim e Vohra (1984) determinaram as exigências de treonina para codornas japonesas utilizando dietas à base de milho e farelo de soja, suplementadas com aminoácidos essenciais e ácido glutâmico, os autores, sugeriram que as dietas deveriam conter 1,10% de treonina, valor bem acima do recomendado por Rostagno et, al. (2017) e por Silva e Costa (2009). Por outro lado, Shim e Lee (1993) relataram que para ótima produção de ovos e eficiência alimentar, as dietas das codornas na fase de postura deveriam conter 0,63% de treonina. Trabalhos conduzidos por Shrivastav e Panda (1990) levaram a recomendação do nível 0,64% de treonina, esses últimos dois trabalhos citados estão de acordo com as tabelas nacionais. Já o estudo conduzido por Lima et al. (2013) verificaram aumento nos índices de desempenho, com relação de treonina: lisina de 78 ou 0,780% de treonina na alimentação de codornas japonesas, sugerindo um aumento na exigência em relação as tabelas nacionais.
A maioria das pesquisas de exigência de treonina para codornas japonesas relatadas apresentam mais de 10 anos comprovando a grande deficiência de informações deste aminoácido em relação aos primeiros limitantes desta espécie, portanto é necessário atualizar estes dados devido a espécie estar em constante evolução genética.
5. CONCLUSÃO
O metabolismo dos aminoácidos é complexo, portanto é necessário revisar todos os caminhos metabólicos destes nutrientes, para entender o seu comportamento no organismo das aves. O estudo do metabolismo dos aminoácidos associado as revisões de suas exigências nutricionais para codornas japoneses, permitem que o pesquisador obtenha base para formular ideias e hipóteses para melhorar o desempenho das codornas.








.jpg&w=3840&q=75)