Introdução
As exportações brasileiras de carne de frango (considerando todos os produtos, in natura e processados) totalizaram 4,822 milhões de toneladas ao longo do ano de 2022, e as exportações brasileiras de genética avícola, considerando ovos férteis e pintos de um dia, totalizaram 15,638 mil toneladas nos doze meses de 2022, conforme relatório divulgado pela Associação Brasileira de Proteína Animal (ABPA). O desempenho foi 0,3% menor que o registrado em 2021, com 15,691 mil toneladas.
O emprego de biotecnologias na reprodução de aves de produção e silvestres visam objetivos e desafios diferentes, onde por um lado se buscam resultados econômicos, o outro almeja a conservação de espécies raras e ameaçadas. Na avicultura industrial busca-se melhorar a performance reprodutiva de linhas puras, bisavós, avós e matrizes, como fertilidade, produção de ovos, eclodibilidade, além de métodos exequíveis em larga escala para avaliação de reprodutores, matrizes e incubatórios de ovos. Já com aves selvagens busca-se a formação e utilização de bancos de germoplasma, visto que, de todas as espécies aviárias do mundo, aproximadamente 12% se encontram ameaçadas de extinção (NOVAES et al, 2018).
Com o intuito de se minimizar os efeitos de consanguinidade nos planteis das propriedades rurais, este trabalho buscou demonstrar a aplicabilidade da inseminação artificial (IA) a fresco em G. gallus domesticus com duas doses, ejaculado total e, uma dose preestabelecida, 0,3 ml, afim de se responder quantos ovos são fertilizados com uma única dose inseminante e, qual a taxa de eclosão desses ovos quando incubados artificialmente e, desta forma, promover o melhoramento genético nos planteis dos produtores rurais.
Revisão bibliográfica
A experiência de campo tem mostrado que o aumento do peso corporal e lesões musculares ou esqueléticas, resultam em queda na produção de ovos, assim como o envelhecimento das aves também exerce efeitos negativos na aptidão e na produção.
A Inseminação Artificial (IA) em aves pode ser considerada como estratégia complementar de programas de reprodução em cativeiro, preservando genes valiosos de indivíduos para infundir às gerações futuras; reduzindo-se o risco de transmissão de doenças através do transporte de material genético, em vez de transporte de aves entre os bandos e, fornecer uma reposição de material genético para as espécies ainda não ameaçadas, mas que podem ser ameaçadas (LAVOR e CAMARA, 2012).
Na avicultura industrial, algumas formas de se avaliar o desempenho reprodutivo e a qualidade dos reprodutores são o número de ovos e pintainhos produzidos, a capacidade fecundante dos espermatozoides, a sobrevivência dos embriões durante o período de incubação, entre outros (GORDAS et al., 2015)
Os pioneiros na biotecnologia de reprodução avícola foram Burrows e Quinn (1937), que desenvolveram o método de massagem abdominal e pressão na região da cloaca para coletar sêmen de galos. Com a técnica de coletar sêmen de aves, o rápido manuseio e o transporte desse sêmen de um lote de machos para onde se encontram as fêmeas, permitiu flexibilidade para quem trabalha com inseminação artificial e propiciou o desenvolvimento de procedimentos eficientes para preservar o sêmen de aves em condições in vitro por algumas horas (RUTZ et al., 2007).
Para a obtenção de amostras seminais, três métodos podem ser empregados: coleta coletiva, eletro ejaculação e massagem manual (BLANCO et al., 2009). A coleta coletiva depende do uso de machos criados na mão,“imprintados”, que por manterem uma relação estreita com os seres humanos, os reconhecem como parceiros sexuais (PEREIRA, 2014; BLANCO et al., 2009).
Os mesmos autores relatam que a obtenção de sêmen de aves através de eletro ejaculação não é rotineiramente empregada devido ao alto grau de contaminação de fezes e urina na obtenção das amostras de sêmen. E a massagem manual, primeiramente descrita em galos por Burrows e Quinn (1937), consiste na massagem rítmica e concomitante do abdômen e do ventre do animal, resultando em reflexo ejaculatório, representado pela elevação da cauda e intumescimento do falo.
A maior vantagem desta técnica está na possibilidade de utilização em machos reprodutivamente ativos não necessariamente criados na mão, e sua maior desvantagem é a necessidade de condicionamento prévio (PARANZINI et al., 2018). Diversos estudos na avicultura moderna têm sido realizados sobre os aspectos reprodutivos e índices de produtividade.
Andrade et al. (1989) avaliaram as características físicas e o pH do sêmen de 60 ejaculados de 12 galos da linhagem pesada Hubbard White Mountain com 38 semanas de idade e constataram o volume médio de ejaculado em 0,75ml de volume e a concentração média de 1,99 x 106 espermatozoides (sptz) / mm3 e 1,5 x 109 sptz / ejaculado
Murata et al. (1995) realizaram um trabalho para avaliar a utilização de diferentes doses de sêmen (média de 0,04 ml) e a realização da inseminação artificial em intervalos que variaram de 00 até 75 minutos da coleta, onde relataram que a fertilidade não foi afetada pelo tempo entre coleta e aplicação do sêmen, descrevendo taxas médias de 92% de fertilidade.
Celeguini et al. (2001) avaliaram as características seminais de 65 galos da linhagem AgRoss, com idade entre 24 e 71 semanas de idade, separados em dois grupos quanto a presença precoce da crista nessa idade e constataram o volume médio do ejaculado de 0,33ml e por volta da 40ª semana de idade apresentaram o pico da concentração espermática de 5,5 bilhões de sptz/ml.
Pereira e Almeida (2020) realizaram espermogramas em 3 galos (G. gallus domesticus) criados em condições triviais de campo e constataram que o volume médio dos ejaculados foi de 5,2ml com a concentração de 5,1x106 de sptz por mililitro.
Deus (2019) utilizou um reprodutor sem raça definida com idade estimada em 2 anos e peso médio de quatro quilos para um experimento comparativo entre e eficiência da técnica de IA versus Monta Natural e relatou que o volume médio do ejaculado deste macho foi 0,6 ml com a concentração espermática de 4,2x108 do ejaculado.
Quanto a fertilidade, Lake e Stewart (1978) relataram que os sptz são capazes de sobreviver no oviduto das galinhas por 12 dias em média. Leite e Viveiros (2021) citando Brillard, (1993), relataram que esse período se compreenderia entre 8 e 15 dias.
Em 1982, Resende et al. avaliaram a taxa de fertilidade de 50 reprodutoras de corte, alimentas com ração com diferentes teores de energia na dieta e, inseminadas uma vez por semana, durante quatro semanas e obtiveram uma média de 87,25% de fertilidade ao longo do experimento e relataram não terem encontrado significância nos resultados em relação aos teores de energia nas dietas.
Murata et al. (1995) relataram que taxa de fertilidade obtida diariamente, após a IA, atingiu níveis mais elevados no quarto dia (96,22 %), decrescendo a 7,67 % no 19º dia.
Rosas et al. (1995) avaliaram o efeito de diferentes protocolos de IA em 75 fêmeas da raça Plymouth Tech Barred onde no tratamento com uma dose inseminante de 0,03ml no oviduto da galinha obtiveram uma taxa de fertilidade de 85,99% na primeira semana e 59,37% na segunda semana.
Rufino et al. (2014) avaliaram pintainhos oriundo de galinhas de raças semipesadas Plymouth Rock Barrada e Rhode Island Red, que foram inseminadas com 0,025ml do ejaculado dos respectivos machos de suas raças e relataram índices médios de 96,02% de fertilidade e 89,4% de eclodibilidade.
Deus (2019) comparou a taxa de fertilidade e eclodibilidade de 40 galinhas caipiras divididas em 2 grupos, onde 20 fêmeas foram inseminadas com sêmen diluído 1;1,5 em solução de Ringer modificado e estas apresentaram a média de 50% de ovos inférteis e destes 77,2% eclodiram, sob condições de 7 dias de armazenagem dos ovos após a postura.
Quanto ao processo de incubação artificial, o armazenamento de ovos férteis por períodos superiores a 3 - 4 dias ou em condições inadequadas, podem levar à queda da viabilidade embrionária ou perdas na qualidade dos pintinhos (AVIAGEN, 2014).
Os incubatórios industriais dependem de controles e monitoramento das condições de incubação como temperatura, umidade, viragem, ventilação e da automação de diferentes processos, como seleção, desinfecção, vacinação de ovos, entre outros, além da constante preocupação com aspectos sanitários (COBB, 2008).
Materiais e Método
O experimento foi realizado no CECTA (Centro Experimental do Colégio Técnico Agrícola) da ETEC Dr. Carolino da Motta e Silva, em Espirito Santo do Pinhal no Estado de São Paulo, localizado na latitude 22º.10’60” Sul e longitude 46º 45’45’’ Oeste, no setor de avicultura, no período de 21/06/2022 a 10/11/2022.
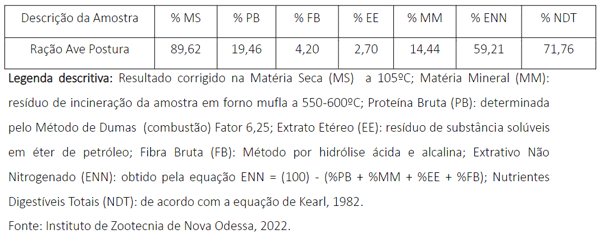
Para este trabalho 25 galinhas de sobre ano, poedeiras Hy-Line Brown foram mantidas em um recinto de 12,0 m2 com livre acesso a água e ração e, na presença macho. As fêmeas após serem inseminadas, eram alojadas em gaiola de 0,40 x 0,25m e 0,40m altura de com adequada oferta de água e ração a vontade. O macho da raça Índio, confinado em uma gaiola de 0,80 x 0,80m e 1,0m de altura e que passou a ser treinado diariamente com a técnica de massagens compressivas, acima descrita, para a realização da coleta de sêmen. A ração disponibilizada para todo o plantel apresenta a composição bromatológica conforme tabela 01 abaixo:
Tabela 01. Composição bromatológica da ração ofertada ás aves ao logo do experimento.
Dois protocolos foram realizados: Tratamento 1 (T1), IA com dose padronizada de 0,3 ml fracionada do ejaculado total a fresco e imediatamente depositado no oviduto de cada fêmea. Assim, mais de uma ave foi inseminada por dia e, Tratamento 2 (T2), IA com o volume total do ejaculado obtido e desta forma, uma única fêmea foi inseminada por dia.
A coleta do sêmen era realizada as 10 horas da manhã, em um recipiente de vidro previamente higienizado e seu volume estabelecido por uma seringa graduada de 0,1 a 1,0ml a qual era o instrumento para o procedimento de IA. A concentração espermática foi determinada pela contagem de células na câmera hematocitométrica de Neubauer numa diluição de 1:1000 em água deionizada e sob microscopia óptica convencional em aumento de 400 vezes (CBRA, 2013), através da média de três doses de sêmen do galo, obtidas em intervalos de 7 dias.
O primeiro ovo coletado para avaliação ocorria 24h após a IA e ao longo dos primeiros dez dias, os ovos de cada matriz eram coletados, identificados e acondicionados por 21 dias na Chocadeira da marca Dove, com temperatura média de 36,5º e umidade relativa do ar em 70%.
Ovoscopia para diagnóstico de fecundidade foi realizado entre o quinto e sétimo dia após a IA. Conforme ocorriam as eclosões na chocadeira, os pintainhos eram pesados e acondicionados em um pinteiro de 0,78m², com dois bebedouros e um comedouro coletivos, conforme recomendações padronizadas nos manuais de criação de aves (COBB, 2008).
O delineamento experimental foi inteiramente casualizado, constituído de dois tratamentos com 10 repetições no T1 e 12 repetições no T2, sendo a unidade experimental uma ave, totalizando 22 aves. As aves do T1 foram reintegradas ao “pool” de matrizes para o T2, que ocorreu após um intervalo de 45 dias. Os parâmetros avaliados foram taxa de fertilidade e taxa de eclosão frente a realização da IA a fresco e, avaliação do peso vivo e do ganho médio de peso frente a heterose aferida.
A taxa de fecundidade dos ovos foi estabelecida em função do número de ovos fertilizados, diagnosticados por Ovoscopia e número de ovos coletados após a IA. A taxa de eclodibilidade foi estabelecida em relação ao número de pintainhos nascidos em relação a postura realizada em 10 dias.
Resultados e Discussões
Aos 21 de junho de 2022, de duas a três aves eram inseminadas “a fresco” com 0,3ml, conforme o volume de sêmen obtido no ejaculado. As galinhas eram capturas dentre o pool de 25 e está prática se repetiu até que 10 fêmeas fossem inseminadas, sempre as 10 horas da manhã e, então, se coletavam 10 ovos de cada fêmea inseminada e se avaliou a fecundidade, por ovoscopia e a eclodibilidade após 21 dias de encubação na chocadeira.
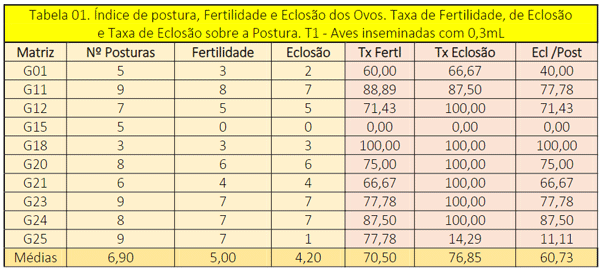
Na tabela 01, os dados são apresentados de forma decrescente em relação a taxa de nascimentos / eclodibilidade, visto ser este o índice esperado em relação a eficácia da técnica, assim, seis aves realizaram a postura de 8,3 ovos em 240h (10 dias), o que corresponde, aproximadamente, a uma postura a cada 29h (matrizes G11, G23, G24, G20, G12, G25). Quatro matrizes se encontraram na média de 5,3 ovos, 1 postura a cada 45,3h ou 1 ovo a cada 1,9 dias, e ainda, a ave G18 adoeceu a partir da terceira postura, contudo, seus três ovos estavam férteis e resultaram no nascimento de três pintainhos.
Ao se avaliar o índice de fertilidade, constatou-se que a matriz G15 mostrou-se infértil e esta não retornou ao experimento para o T2. Assim, a fertilidade média do T1 foi de 70,50%, avaliada pela técnica de ovoscopia e resultou na taxa de eclosão, nascimentos, de 60,73%, como demonstrado na tabela 01.
Dando continuidade ao experimento, aos 24 de agosto de 2022, teve início o Tratamento 2 (T2), onde 12 aves foram inseminadas com 0,9ml, em média, equivalente ao volume total obtido de um ejaculado do macho, sendo uma ave inseminada por dia.
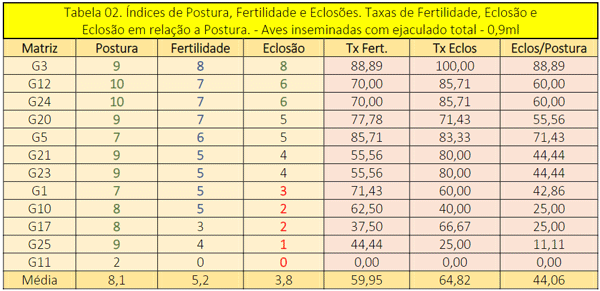
Na tabela 02, organizada em relação aos índices de ovos férteis, doze matrizes foram inseminadas com o volume de sêmen total obtido de cada coleta do ejaculado, assim, uma fêmea era inseminada por dia. Estas aves realizaram a postura média de oito ovos em 10 dias (240h), o que corresponde a 1 ovo a cada 30 horas. A ave identificada como G11 adoeceu no início do tratamento e foi retirada do experimento.
As médias de ovos férteis e de eclosões, nascimentos, foram similares ao T1, não havendo diferença significativa entre os tratamentos, contudo, no T2 a postura ao longo dos dez dias foi mais regular. Tal fato pode ser especulado em função de que o T1 teve início 45 dias final do período de muda das aves enquanto que o T2 foi realizado, cronologicamente, 90 dias depois.
Ao se comparar as taxas de fertilidade e eclosão entre os tratamentos, o T1 foi, respectivamente, 17,26% e 27,61% maior do que as médias obtidas no T2 e os dados mostram que a provável causa está relacionada a viabilidade dos embriões, pois, na postura foi 14,9% maior, assim como o número de ovos férteis no T2, 10,4%.
Rosa et al. (1995) avaliaram diferentes protocolos de IA em galinhas da raça Plymouth Rock Barred e relataram que os melhores índices de fertilidade, 71,6%, foram obtidos com 2 inseminações por semana nas aves, com 0,03ml de sêmen “ a fresco”.
Ao se analisar as médias de fertilidade dos tratamentos, se se desconsiderar as aves G15 que se mostrou infértil e, a G18 e a G11, que adoeceram no início do experimente, os índices de fertilidade dos T1 e T2 foram de 65,4 e 75,63% respectivamente e, desta forma, se equiparam às médias citadas na literatura consultada.
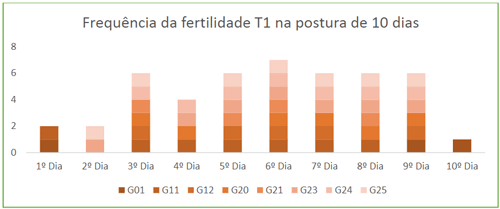
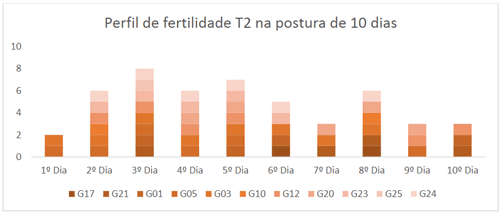
Ao se analisar a frequência da fertilidade dos tratamentos, nos gráficos 01 e 02, observa-se que com a dose inseminante de 0,3ml no T1, o maior número de fêmeas se mostraram férteis ao longo do segundo terço do período de ovos coletados, enquanto que no T2, com a IA de 0,88ml, as aves se mostraram mais férteis no primeiro terço do período analisado.
Gráfico 01. Frequência da fertilidade das aves inseminadas com 0,3ml
Gráfico 02. Frequência da fertilidade das aves inseminadas com 0,9ml
Em pesquisas mais recentes, Rodrigues (2007) avaliou o tempo de armazenamento de espermatozoides na espermateca de galinhas pesadas da raça Cobb acasaladas por monta natural e constatou que ao longo de 23 dias de seu experimento foi possível encontrar grandes quantidade de espermatozoides em todo aparelho reprodutivos das fêmeas. Assim, como se pode contatar nos gráficos acima que as matrizes participaram de ambos os tratamentos (T1 e T2: G01; G12; G20; G23; G24 e G25) apresentaram picos de fertilidade em diferentes períodos nos tratamentos, não é possível se afirmar que o volume de sêmen disponível na espemateca seja determinante para se determinar o grau de fertilidade essas matrizes melhoradas para produção animal, pois parte do processo de desenvolvimento embrionário, assim como a própria eclosão dos ovos dependem de um processo externo que é a incubação dos ovos.
Este fato pode ser comprovado por DEUS (2019) que avaliou a taxas de eclosão e fertilização em galinhas caipiras fertilizadas pelos métodos de monta natural e de inseminação artificial e constatou que não houve diferença estatística entre a fertilização e eclosão nestes processos.
Após o período médio de 21 dias de incubação dos ovos, foram realizadas pesagens semanais de 53 pintinhos no T1 e 58 pintinhos no T2 para o monitoramento na fase de recria.
O peso vivo médio dos pintainhos ao nascimento foi de 29,62g do lote T1 e no T2 com 39,97g em comparação com Nascimento et al. (2015) onde a média de peso ao nascimento foi de 44,48g.
Na primeira semana o peso médio dos pintainhos do T1 e T2 foi de 107g, 35 gramas mais pesados do que o peso médio descrito no manual Hy- Line Bronw e Hy Line W80, ambas as linhagens de postura. O peso médio das aves com duas semanas de vida, o peso médio foi de 177g. Conforme estes manuais, as aves deveriam estar com peso médio 120g, podendo apresentar uma variação de até 50g a menos em regiões de clima tropical.
Já com 3 semanas após o nascimento a média do T1 foi de 291g e do T2 de 244g, nos manuais da Hy-Line a média de peso com 3 semanas seria de 180 até 200g, ou seja, pode se constatar que nos produtos nascidos, a heterose promoveu ganho de 30%, em média, a mais que os peso das pintainhas de linhagens comerciais Hy-Line para postura.
Conclusão
Este trabalho demonstrou que a realização da técnica de inseminação artificial em aves é exequível, prática e possibilitou otimizar o reprodutor para fertilizar todas as fêmeas empregadas no experimento. Promoveu-se o a heterose no plantel, otimizou o ciclo produtivo, a reprodução, incubação e nascimentos em um período específico, o que na prática minimiza custos e mão de obra nas criações de campo. As taxas de fertilização e eclosão estão em média, similares aos citados na literatura e foi possível se determinar que uma dose de sêmen a fresco de 0,3ml ou o de um ejaculado total fertiliza de 6 a 7 ovos em galinhas adultas. Quanto aos produtos nascidos, a heterose promoveu ganho de 30%, em média, a mais que os peso das pintainhas comerciais Hy-Line para postura.
Publicado orginalmente na Revista Faculdades do Saber, 08(18): 1921-1930, 2023. Acesso disponível em: https://rfs.emnuvens.com.br/rfs/article/view/234