coleta sêmen galinhas inseminação artificial IA avícola
Coleta de sêmen e inseminação artificial em galinha
Publicado: 23 de janeiro de 2012
Por: Marco Aurélio da Silva Leite, Zootecnista, Mestrando em Zootecnia, Produção Animal - Reprodução do Departamento de Zootecnia da Universidade Federal de Lavras -UFLA-, MG, e Ana Tereza de Mendonça Viveiros Leal, Médica Veterinária, MSc, PhD, Professora Adjunta do Departamento de Zootecnia da UFLA, MG.
1. INTRODUÇÃO
A Inseminação Artificial (IA) foi a primeira grande biotecnologia aplicada para melhorar a reprodução e a genética dos animais domésticos de produção, e sua aceitação mundial garantiu o impulso para o desenvolvimento de outras tecnologias como a criopreservação e a sexagem de espermatozóides; regulação de ciclo estral; coleta, congelamento, cultura e transferência de embriões e; a clonagem, além de, recentemente, métodos mais efetivos na avaliação de progenitores (FOOTE, 2002). A eliminação da cópula, em qualquer espécie, traz vantagens no campo da experimentação científica, no campo sanitário (importância maior em mamíferos) e finalmente vantagens de aspecto zootécnico, que representam a aplicação da IA no campo prático (MIES FILHO, 1987).
O uso da IA e seu grau de impacto variam entre espécies e entre sistemas de produção, valendo como bom exemplo o caso da bovinocultura, na qual os ganhos genéticos têm grande expressão. A importância das aves como fonte de alimento e o fenômeno da urbanização pós-industrial propiciaram o surgimento de uma avicultura intensiva, conhecida como avicultura industrial. A galinha é o primeiro animal de produção a ser confinado permanentemente em lugar fechado e em grande número, sob sistemas automatizados baseados em intensiva seleção genética e no uso por vezes de antibióticos para tratar as doenças da produção (DAVIS, 2002). Hoje, a indústria das aves está à frente dos outros sistemas de produção animal em especialização e aplicação de tecnologia e é dentre as commodities a que mais contribui no consumo de proteína animal pelo homem.
A evolução tecnológica imprimiu ao sistema industrial de produção avícola um arranjo verticalizado quanto à genética, alto emprego de capital e ganhos econômicos efetivos na produção em escala. A esse contexto é que se insere a maior parte da produção científica sobre Inseminação Artificial avícola. Foi esta a ferramenta que possibilitou a melhoria da seleção genética, a formação dos híbridos verdadeiros e o uso dos reprodutores superpesados.
O início da IA avícola se deu com a descoberta do método de massagem e pressão para coleta de sêmen (BURROWS & QUINN, 1937). O uso do sêmen fresco ou resfriado por algumas horas se tornou possível na prática devido à facilidade da coleta e a proximidade das fêmeas nas grandes fazendas de procriação.
Apesar do sêmen de galos estar entre os primeiros a serem congelados com a descoberta das qualidades crioprotetoras do glicerol (POLGE et al., 1949), essa ferramenta continua apresentando baixas taxas de fertilidade, ainda não encontrando aplicação prática (LAKE, 1986).
A inseminação artificial é uma técnica com enorme potencial de aplicação para aves em geral devido ao controle que propicia sobre a reprodução e à sua relativa simplicidade, no entanto, a aplicação comercial em galinhas se restringe a alguns núcleos de reprodutores da avicultura industrial.
Em condições ótimas de instalações e manejo, espera-se da técnica de IA em si melhoria nos índices de fertilidade, no entanto a utilização ou não de um programa de IA está sujeita à análise econômica pelo balanço entre suas vantagens e desvantagens em relação ao acasalamento natural. Listam-se como vantagens da aplicação da IA sobre a monta natural os seguintes pontos:
- eliminação de acasalamento preferencial;
- a reprodução de linhagens comerciais de monta difícil ou impossível;
- um menor número de machos pelo mesmo de fêmeas (redução de 7-10% para 2-3%);
- o aumento da descendência dos machos de alto valor genético (aumento na pressão e no progresso de seleção);elevação nos níveis de fertilidade (é possível compensar quedas na qualidade espermática e na capacidade de armazenamento da fêmea pelo aumento de concentração da dose inseminante e do número de inseminações, além da garantia de que todas as fêmeas foram inseminadas);
- a redução nos custos de alimentação em 10 a 20% (menor necessidade de energia para a atividade sexual);
- possibilidade de aumentar a capacidade produtiva das instalações já existentes (pode-se dobrar a densidade de criação no galpão ao sair do piso para a gaiola);
- aumento na porcentagem de ovos incubáveis próximo de 2% (devido ao aumento de ovos limpos);
- possível aumento peso final frango (ovo de galinha engaiolada tem peso 1 a 2 g maior).
Já as desvantagens estariam relacionadas:
- aos investimentos iniciais em instalações, equipamentos e treinamento de mão-de-obra;
- demanda e custo de mão-de-obra especializada;
- incidência de pododermatite em aves alojadas em gaiolas (especialmente as de linhagens pesadas).
O objetivo deste boletim é apresentar as bases, descrever as técnicas e levantar aspectos do emprego da coleta de sêmen e inseminação artificial em galinhas, para profissionais e estudantes da área de produção animal. A descrição da técnica nas galinhas de alta produção serve de modelo comparativo para pequenos produtores de sistemas menos intensivos e também para o desenvolvimento da tecnologia em outras espécies de aves.
2. COLETA DE SÊMEN
A coleta de sêmen para a IA é uma operação simples, mas que exige cuidados com relação à manipulação dos animais de forma a evitar qualquer estresse que venha a inibir a obtenção momentânea do sêmen e/ou afetar sua produção subseqüente. Para uma melhor compreensão do processo de coleta por massagem deve-se inicialmente observar algumas características do sistema reprodutivo de um macho.
2.1 Sistema Reprodutivo do Macho
Algumas considerações serão feitas com base na comparação entre os sistemas reprodutivos de aves e de mamíferos.
A característica mais marcante das aves é a localização dos dois testículos dentro da cavidade abdominal, não descendo a um saco externo em nenhuma fase do desenvolvimento do animal. Nos mamíferos, a localização dos testículos externa à cavidade abdominal permite que apresentem temperatura inferior a do corpo, sendo este requisito necessário a uma espermatogênese normal nestes animais. Nas aves não é claro se a espermatogênese se dá às elevadas temperaturas internas do corpo (41 - 43°C), se ocorre algum resfriamento dos testículos pelos sacos aéreos abdominais, se há a concentração desta atividade durante a noite (menor temperatura corporal) ou se essas três possibilidades se conjugam. Os sacos aéreos abdominais circundam os testículos especialmente em suas extremidades craniais. Pela Figura 1, ilustra-se a localização dos testículos no galo.
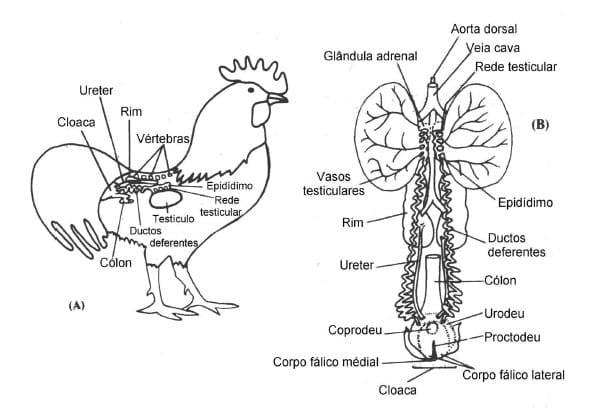
FIGURA 1 Distribuição espacial do aparelho reprodutor do galo (BURROWS & QUINN,1937).
A delicada membrana que cobre os testículos (túnica albugínea) encerra nas aves um emaranhado de túbulos seminíferos que se ramificam e se ligam livremente, de forma diferente ao observado nos mamíferos, onde estão melhor organizados em lóbulos delineados por tecido conjuntivo. Em alguns pontos o emaranhado de túbulos seminíferos encontra os túbulos retos (rete testis) que conduzirão então os espermatozóides até os ductos eferentes e destes até o ducto do epidídimo.
Os testículos além de produzirem os espermatozóides, representam nos galos um reservatório de sêmen devido ao desenvolvimento escasso do epidídimo. Nas aves a maior proporção (>70%) da região tubular extra-testicular é composta pelos ductos eferentes, sendo assim o ducto do epidídimo proporcionalmente menor esem as subdivisões (cabeça, corpo, cauda) e funções próprias a esse ducto nos mamíferos. Essa característica sugere que nas aves os ductos eferentes representam uma componente de maior importância desta região que o ducto do epidídimo, justificando a denominação de região epididimária ao conjunto de túbulos retos, conexões e ducto do epidídimo, como forma de diferenciá-la do epidídimo dos mamíferos.
Os ductos eferentes, em todas as espécies, têm por funções básicas a reabsorção de fluido, secreção protéica, concentração e transporte espermático. Ao contrário
dos mamíferos, o espermatozóide do galo não necessita de maturação no epidídimo ou proporcionada pela secreção de glândulas anexas (as quais não dispõe), nem de capacitação no trato da fêmea para obter capacidade fertilizante, no entanto precisa passar por toda a extensão do trato masculino para obter motilidade suficiente para atravessar a vagina e atingir as glândulas armazenadoras de esperma ou diretamente o óvulo. Espermatozóides coletados da saída dos testículos têm pouca motilidade, da saída da região epididimária têm motilidade um pouco maior e ao final do ducto deferente alcança motilidade máxima.
dos mamíferos, o espermatozóide do galo não necessita de maturação no epidídimo ou proporcionada pela secreção de glândulas anexas (as quais não dispõe), nem de capacitação no trato da fêmea para obter capacidade fertilizante, no entanto precisa passar por toda a extensão do trato masculino para obter motilidade suficiente para atravessar a vagina e atingir as glândulas armazenadoras de esperma ou diretamente o óvulo. Espermatozóides coletados da saída dos testículos têm pouca motilidade, da saída da região epididimária têm motilidade um pouco maior e ao final do ducto deferente alcança motilidade máxima.
Cada ducto deferente na ave é sinuoso em sua extensão de forma comparável à sinuosidade do ducto epididimário dos mamíferos. Próximo à cloaca (Figura 2) os ductos deferentes tornam-se retos e atravessam sua parede para terminar na forma de uma papila na região do proctodeu. Os espermatozóides produzidos em um testículo são conduzidos para a papila do ducto deferente, de maneira distinta para os lados direito e esquerdo.
Todo o aparelho copulatório consiste em um par de papilas dos ductos deferentes, um par de corpos vasculares paracloacais, um par de pregas linfáticas e o falo. Não há um órgão penetrador nas aves, no entanto o falo é a estrutura responsável pelo melhor contato com a vagina no momento da cópula. A ereção deste falo resulta da intumescência dos corpos fálicos laterais e medial (Foto 3) com um fluido derivado do corpo vascular paracloacal, localizado na parede da cloaca (Figura 2).
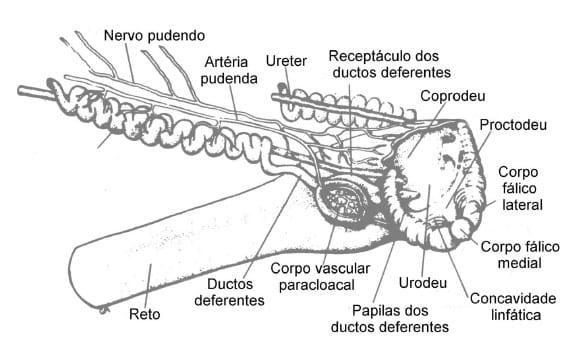
FIGURA 2 Vista lateral da cloaca (LAKE, 1971).
Os corpos vasculares paracloacais são duas estruturas ovais, pequenas e avermelhadas com estreito pedúnculo de conexão até as pregas linfáticas. Apesar dessas pregas linfáticas secretarem mucina (mucopolissacarídeos), não deve haver analogia com nenhuma glândula acessória de mamíferos. Uma espermatogônia de galo após entrar no ciclo espermatogênico, emerge como espermatozóide no canal seminífero após 13 a 15 dias, dito tempo de duração da espermatogênese.
2.2 Escolha do Macho
Significantes avanços genéticos foram conseguidos com frangos de corte em crescimento e conformação da carcaça, no entanto, a performance reprodutiva que não passou por seleção, se tornou crítica para avançar a eficiência produtiva, e critérios de seleção satisfatórios baseados em características do sêmen ainda não foram identificados.
Na escolha dos animais para a participação em um programa de IA o critério mais importante é a fertilidade. Leeson & Summers (2000) registraram que o número de machos produzindo sêmen em um lote é menor do que o esperado se levado em conta somente a condição corporal. Estimativas indicam que somente 60% dos galos contribuem para a fertilidade do lote.
A escolha do macho não deve ser baseada exclusivamente em critérios fenotípicos, para eficiência reprodutiva do programa de IA é imprescindível que os animais sejam avaliados também pela qualidade do sêmen produzido.
Para um macho participar de um programa de IA, os ejaculados são geralmente avaliados quanto ao volume, cor, concentração, viabilidade e motilidade espermática. A escolha dos reprodutores jamais deve ser baseada em um único ejaculado, sendo recomendável a análise de pelo menos três ejaculados sucessivos para permitir uma avaliação mais precisa dos animais. A avaliação deve ser feita em galos jovens (25 a 30 semanas de idade) antes de serem introduzidos no lote. Apesar da utilidade que teria para o controle da fertilidade, nenhuma avaliação é realizada na indústria depois do macho ser aprovado para participar de um programa de IA. Essa situação resulta em parte do tempo gasto com a realização dos testes, da necessidade de técnicos para realizarem esses testes e da dificuldade de se adaptar a realização freqüente dos testes em larga escala.
2.3 Coleta
Antes de se iniciar a coleta do sêmen o animal deve passar por uma toalete, que consiste no corte raso das penas do entorno da cloaca que possam interferir no fácil acesso ao sêmen.
O animal é contido pelas pernas com um das mãos (Foto 1), com a outra mão é feita a massagem. Desta maneira fica evidente a necessidade de um segundo operador que coletará o sêmen enquanto o primeiro executa os movimentos de massagem.
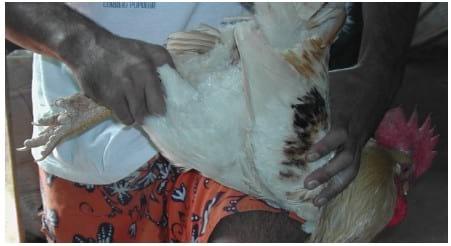
FOTO 1 Maneira de conter um galo para a coleta de sêmen. Enquanto as pernas são presas por uma das mãos, a outra fica livre para realização da massagem.
A massagem dorsal é feita com os dedos opostos percorrendo o dorso da ave paralelamente a coluna vertebral (Foto 2), em suave pressão iniciada na base das asas, descendo pela inserção da cauda até pressionar a região lateral da cloaca(Foto 3). Em um animal treinado após poucos movimentos deve ocorrer a exposição do falo e a liberação de sêmen.
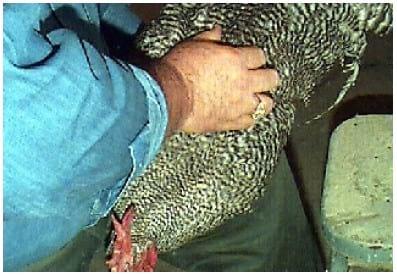
FOTO 2 Massagem da região dorsal, estimulando a liberação do sêmen.
Após ereção do falo também pode ser feito um massageamento das partes moles do abdômen (massagem abdominal) no mesmo sentido da massagem dorsal, mas terminando com o dedo indicador posicionado na parte inferior e o polegar na parte superior da cloaca. Faz-se então pressão da mão contra o animal e simultaneamente pressão da região pericloacal entre os dedos (Foto 4).
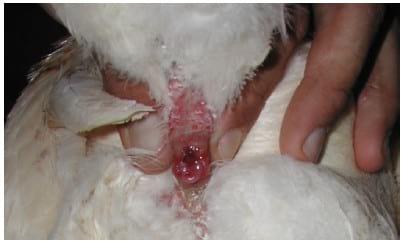
FOTO 3 Cloaca de um galo após os movimentos de massagem dorsal e peri-cloacal onde se evidencia o falo composto pelos corpos fálicos laterais e medial na metade inferior.
Pode-se conseguir que o sêmen seja coletado apenas com a massagem dorsal e pericloacal, sem o massageamento abdominal, tornando o processo mais simples.
Não ha indícios de que há uma maior obtenção de sêmen com uma das massagens sozinha ou com as duas ao mesmo tempo.
Não ha indícios de que há uma maior obtenção de sêmen com uma das massagens sozinha ou com as duas ao mesmo tempo.
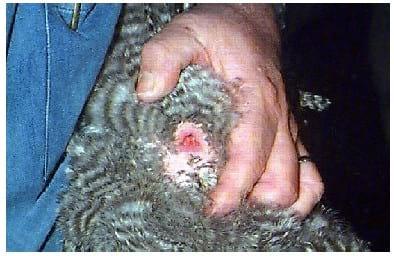
FOTO 4 Posicionamento dos dedos nas partes superior e inferior da cloaca. Pressionamento da mão contra abdômen do animal e da região pericloacal entre os dedos.
O sêmen deve surgir em grandes gotas após cada movimento completo de estimulação, sendo imediatamente coletado. Este deve apresentar-se de cor branca e aspecto leitoso, devendo-se observar a contaminação por excretas que resultam na eliminação do ejaculado. O sêmen deve ser aspirado preferencialmente através de uma seringa estéril diretamente da cloaca evitando contaminações (Foto 5).
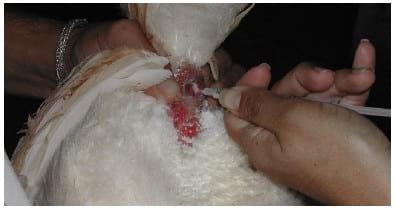
FOTO 5 Aspiração do sêmen diretamente da cloaca.
Uma única pessoa pode massagear e coletar o sêmen se utilizar um frasco coletor com tubos acoplados para aspiração indireta com a sucção da boca. Granjas de grande porte que utilizam IA fazem uso de bancadas especialmente desenvolvidas para conter o macho durante a coleta, o que permite que apenas uma pessoa realize a massagem e aspire o sêmen.
2.4 Fatores que Afetam a Coleta de Sêmen
Os estímulos que levam à copula são complexos e existe uma variação individual muito grande. Desta forma, é natural que o mesmo método de coleta de sêmen funcione para um animal e não para outro. Ainda, alguns técnicos são bem-sucedidos nas coletas de sêmen, enquanto que outros nas mesmas condições não são. Alterações de ambiente que possam estressar os animais na proximidade da hora da coleta podem repercutir negativamente em seus resultados (ruídos não comuns, movimentos bruscos próximos às instalações e na manipulação dos animais, presença de outras pessoas que não da rotina, etc). Um fator importante para o bom estimulo à coleta de sêmen é o bem-estar do animal quanto à sua instalação, podendo este ser colocado em gaiolas individuais, mas com espaço suficiente para uma livre movimentação. Um tamanho de gaiola sugerido por alguns produtores norte-americanos é de 45 cm de largura, 60 cm de profundidade e 60 cm altura, dimensões características de sistemas de criação intensiva.
3. INSEMINAÇÃO
3.1 Sistema Reprodutor da Fêmea
O aparelho reprodutivo da galinha compreende ovário e oviduto esquerdos, pois o conjunto que deveria ocupar o lado direito da cavidade abdominal sofre regressão ainda na fase embrionária. O ovário da galinha apresenta folículos de tamanhos variados e a hierarquia destes é estabelecida principalmente pela regressão dos folículos pequenos (<6-8 mm), com conseqüente recrutamento de novos. Os folículos que ultrapassam 8 mm de diâmetro continuam o desenvolvimento até a ovulação. Uma galinha ovula um folículo a cada 25 horas durante 10 a 15 dias seguidos (esse período é chamado ciclo). A galinha repete esses ciclos ou seqüências de postura indefinidamente. Os ciclos são separados por um intervalo de um ou mais dias, quando há falha na ovulação, e conseqüentemente a galinha deixa de colocar ovo no dia seguinte, para então começar um novo ciclo. O primeiro ovo de um ciclo é colocado ao amanhecer e as oviposições seguintes ocorrem sempre um pouco mais tarde nos dias sucessivos. Durante o pico de produção, o intervalo entre oviposições é de aproximadamente 24 a 26 horas e o último ovo do ciclo (seqüência) é colocado entre 6 e 8 horas após o amanhecer (RUTZ et al., 1996).
Anatomicamente o oviduto é dividido em cinco partes: infundíbulo, magno, istmo, útero e vagina (Figura 3). A parte mais próxima ao ovário é chamada de infundíbulo, e é responsável pela captura do óvulo logo após a sua liberação e é o local de encontro com os espermatozóides para a fecundação. O magno é a região responsável pela secreção de albúmem, sendo esta a parte mais longa do oviduto. O istmo é a região mais curta, onde se formam as membranas da casca. O útero, ou glândula da casca é um órgão muscular e secretório, onde é adicionado fluido ao ovo e ocorre a formação da casca e deposição da cutícula. A vagina serve de passagem para o ovo do útero até a cloaca.
Na região útero-vaginal estão localizadas as glândulas hospedeiras de espermatozóides (Figura 3). Os espermatozóides ali se armazenam após a inseminação artificial ou monta natural, para se deslocarem via ascendente em direção ao infundíbulo. Poucos estudos buscaram o melhor entendimento destes mecanismos e suas vantagens. Segundo Bakst et al. (1994), as glândulas hospedeiras funcionam como mantenedoras da capacitação espermática e, conseqüentemente, das futuras fecundações.
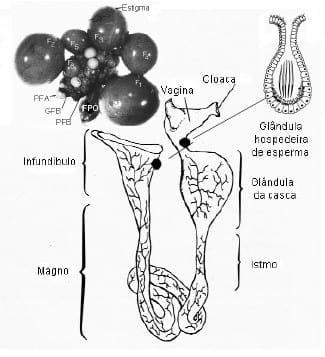
FIGURA 3 Sistema reprodutor da galinha (BAKST et al., 1994).
3.2 Preparo do Sêmen para a Inseminação
Para aumentar o número de galinhas que podem ser inseminadas com o mesmo ejaculado, o sêmen pode ser diluído em uma solução conhecida como Ringer
modificado. A sua composição é:
modificado. A sua composição é:
Cloreto de sódio: 68 gramas
Cloreto de potássio: 17.33 gramas
Cloreto de cálcio: 6.4 2 gramas
Sulfato de magnésio: 2.50 gramas
Bicarbonato de sódio: 24.50 gramas
Água destilada: 10 litros (MARTIN, 2003).
Cloreto de potássio: 17.33 gramas
Cloreto de cálcio: 6.4 2 gramas
Sulfato de magnésio: 2.50 gramas
Bicarbonato de sódio: 24.50 gramas
Água destilada: 10 litros (MARTIN, 2003).
Outro diluidor muito usado na avicultura é o BPSE (Beltsville Poultry Semen Extender), solução comercializada pronta por empresas especializadas em alguns países. O ideal é a diluição em função da concentração de células espermáticas por ejaculado de forma a atingir um número desejado de células por dose inseminante. De uma maneira geral, pode-se diluir o sêmen na proporção de uma parte em duas partes de diluidor. Dessa forma, pode-se utilizar um macho para cada 30 fêmeas, e não um macho para cada 10 fêmeas como ocorre na monta natural. Após a coleta e diluição, o sêmen deverá ser usado para inseminação o mais rápido possível, no máximo uma hora para sêmen fresco ou vinte e quatro horas para sêmen resfriado.
De maneira geral, têm-se inseminado com dose de 100 milhões de células espermáticas vivas, embora o uso de 50 milhões de células não reduza a fertilidade. Já nas últimas semanas de produção de ovos a dose é freqüentemente aumentada para 200 milhões (MCDANIEL, 2002).
3.3 Inseminação propriamente dita
Para ser inseminada, a galinha é contida contra o corpo do inseminador com a cabeça voltada para baixo. A outra mão posiciona o dedo polegar acima e o indicador abaixo da cloaca para que se faça a sua eversão, que é auxiliada por uma leve pressão do animal contra o corpo do inseminador. Com a cloaca evertida introduzse o tubo inseminador (Foto 6) até algum sinal de resistência, então ao mesmo tempo em que o sêmen é introduzido libera-se a pressão e a cloaca retorna a sua posição normal.

FOTO 6 Inseminação de uma galinha com o tubo acoplado a uma pêra de borracha.
O tubo inseminador pode ser uma seringa com um prolongamento (Foto 7) ou um tubo acoplado a uma pêra de borracha (Foto 6).

FOTO 7 Seringa de inseminação usada em galinhas.
Para reduzir o trabalho manual e seu custo elevado, foram desenvolvidos sistemas automatizados próprios para manipulação por um único trabalhador. Em alguns desses sistemas as aves são contidas por pinças hidráulicas, a pipeta é fixa e automática para o volume e para liberação da dose.
3.4 Fertilidade
Há dificuldade em inseminar matrizes fora de produção, porque é difícil fazer a reversão da cloaca, a inseminação artificial deve portanto começar somente quando o lote alcançar 25% de produção.
Após ser inseminada, uma ave permanece produzindo ovos férteis por um período de tempo sem que haja necessidade de outra IA ou cópula. Esse período é conhecido como período fértil e é possível devido ao armazenamento de espermatozóides nas glândulas hospedeiras do oviduto. Nas aves de alta produção, a seleção genética e a regulação do meio ambiente causaram um prolongamento nos ciclos ou seqüências de produção de ovos, sem, entretanto aumentar a
capacidade de armazenamento dos espermatozóides nas glândulas hospedeiras. Há uma variação considerável entre fêmeas quanto à capacidade das glândulas em armazenar os espermatozóides, variando de 3 a 4 dias em galinhas e de 8 a 15 dias em peruas (BRILLARD, 1993). Entretanto, a porcentagem de ovos férteis começa a cair dentro de 5 a 7 dias na galinha e 14 a 21 dias na perua. Assim, é importante inseminar as galinhas uma a duas vezes a cada semana, para garantir a fertilidade dos ovos produzidos.
capacidade de armazenamento dos espermatozóides nas glândulas hospedeiras. Há uma variação considerável entre fêmeas quanto à capacidade das glândulas em armazenar os espermatozóides, variando de 3 a 4 dias em galinhas e de 8 a 15 dias em peruas (BRILLARD, 1993). Entretanto, a porcentagem de ovos férteis começa a cair dentro de 5 a 7 dias na galinha e 14 a 21 dias na perua. Assim, é importante inseminar as galinhas uma a duas vezes a cada semana, para garantir a fertilidade dos ovos produzidos.
Se possível a inseminação deve ser feita após às 3 horas da tarde, pois pela manhã, a maioria das galinhas tem um ovo no oviduto obstruindo a livre passagem de sêmen e, pode-se evitar efeitos do estresse calórico sobre a fertilidade com as galinhas passando menos horas de calor com o sêmen recém-chegado ao oviduto.
4. CONCLUSÕES
Apesar da relativa simplicidade, do melhor controle sobre a reprodução e da elevação nos índices de fertilidade, a Inseminação Artificial tem aplicação comercial restrita a alguns núcleos de reprodutores nas empresas de genética. Em outras espécies de aves de produção, como o peru e a galinha d angola, que têm outras limitações para os índices de fertilidade, a IA já assume maior importância econômica. O balanço entre as vantagens e as desvantagens deve ser feito para a condição de cada granja em particular, lembrando que a IA deve trazer mais vantagens para sistemas que utilizam programas de melhoramento genético.
5. REFERÊNCIAS BIBLIOGRÁFICAS
BAKST, M. R.; WISAHRT, G.; BRILLARD, J. P. Oviductal sperm selection, transport and storage in poultry. Poultry Science Review, Amsterdam, v. 5, p. 117-143, 1994.
BRILLARD. Sperm storage and transport following natural mating and artificial insemination. Poultry Science, Amsterdam, v. 72, p. 923-928, 1993.
BURROWS, W. H.; QUINN, J. P. The Collection of spermatozoa from the domestic fowl and turkey. Poultry Science, Amsterdam, v. 16, p. 19-24, 1937.
DAVIS, K. The plight of birds in the poultry and egg industry. Disponível em: . Acesso em: 9 set. 2002.
FOOTE, R. H. The history of artificial insemination: selected notes and notables. Disponível em: . Acesso em:
29 set. 2002.
29 set. 2002.
LAKE, P. E. The male in reproduction. In: Physiology and biochemistry of the domestic fowl. London: Academic, 1971. p. 1411-1447.
LAKE, P. E. The history and future of the cryopreservation of avian germ plasm. Poultry Science, Amsterdam, v. 65, p. 1-15, 1986.
LEESON, S.; SUMMERS, J. D. Broiler breeder production. Guelph: University Books, 2000.
MARTIN, R. D. Artificial insemination of poultry. Disponível em: . Acesso em: 20 set. 2003.
MCDANIEL, G. R. Manejando los reproductores broilers para obtener máxima fertilidad. Avicultura profesional, [S.l.], v. 20, n. 6, p. 16-17, 2002.
MIES FILHO, A. Inseminação artificial. Porto Alegre: Artmed, 1987. v. 2.
POLGE, C.; SMITH, A. U.; PARKES, A. S. Revival of spermatozoa after vitrification and dehydration at low temperatures. Nature, London, v. 164, p. 666, 1949.
RUTZ, F.; ANCIUTI, M. A.; PAN, E. A. Fisiologia e manejo reprodutivo de aves. Pelotas: UFPel, 1996. Apostila.
Tópicos relacionados:
Autores:

Recomendar
Comentário
Compartilhar
25 de enero de 2019
Gostaria de saber com quantos dias você pode retornar o seme na fêmea novamente nas galinhas de angola?
Recomendar
Responder
12 de marzo de 2018
Preciso de uma consultoria sobre o assunto em pauta, favor informar contato e nome de quem devo procurar para combinar um trabalho.
Fico no aguardo!!
Recomendar
Responder
Granja 22
6 de agosto de 2015
ola bom dia!!!
gostaria de saber s existe alguma vitamina ou medicamento para aumento na produção de semem dos machos adultos e mais velhos. faço a criação de galinhas ornamentais e tenho uns reprodutores que não posso perder a genética, e gostaria de aumentar a proporção de semem para IA.
s puderem me ajudar desde já agradeço.
Recomendar
Responder
17 de agosto de 2014
-muito bacana a explicação
-gostaria de saber se existe a possibilidade de faze-la em gansos
-fico muito apreensivo quando chego no ninho das gansas após a eclosão dos ovos e vejo a baixíssima eclosão dos ovos.
-já tentei em vários segmentos , revistas, associações, obter informações a respeito deste tema e quanto me espanta, nada sobre o assunto.
-no caso de vcs galinhas inseminadas- já vi perus- galinhas angola- patos muscovis- pássaros.
-nada de gansos, sei que não e comercial, mas os patos tb não são tão difundidos em nosso pais, e no sul fazem a inseminação.
-quando entro em contato, nem se manifestam em responder pelo o menos o não- ou não sabemos - ou talvez nunca nem ouvimos falar.
-já entrei ate contato ate com o globo rural, e nem resposta. já que tem uma gama gigante de contatos no pais e eles mesmos noticiaram a inseminação de perus- galinhas de angola etc.
-se puderem me ajudar agradeço imensamente
Recomendar
Responder


Evonik Animal Nutrition
Evonik é uma das maiores empresas de especialidades químicas do mundo.
Link recomendado
31 de marzo de 2014
Muito boa explicação.
O mesmo procedimento pode ser adotado para codornas?
Desde já obrigado.
Recomendar
Responder
11 de diciembre de 2013
Bom dia, excelentes as explicações como também as imagens para procedimento da inseminação artificial em galinha. Parabéns.
Recomendar
Responder

Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.











