Imunidade dos leitões recém-nascidos, interações com MOS e Imunoglobulinas do ovo ( IgY)
Publicado: 14 de junho de 2013
Por: Jose Sidney Flemming, Dr. em Ciências Veterinárias.
1. Introdução :
Os suínos apresentam uma rede complexa com capacidade de reconhecer, repelir e destruir invasores externos, constituído por células, tecidos e moléculas responsáveis por uma reação coordenada: a resposta imune. O sistema imune interage com o estranho (non-self) e preservar o próprio (self). Tem a capacidade de reconhecer estruturas potencialmente agressoras. Esta habilidade é necessária para proteger o organismo contra invasores e agressores como, por exemplo, vírus, bactérias, fungos, toxinas, corpos estranhos, protozoários e células modificadas ou alteradas (ex: células malignas).
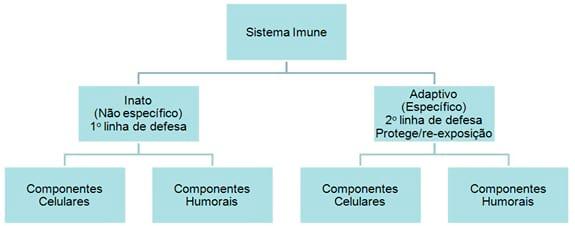
Este sistema é formado por uma primeira linha de defesa denominada mecanismo inato ou inespecífico no qual os mecanismos de defesa em sua maior parte estão presentes e prontos para serem mobilizados em uma infecção. Contudo, não é específico para um antígeno e reage da mesma maneira para uma variedade de organismos. Ele é complementado por uma segunda linha de defesa que protege contra a re-exposição que é o sistema imune adaptativo ou específico. Este requer algum tempo para reagir contra um organismo invasor, é específico para um antígeno e reage somente contra microorganismos que induzem a resposta. Tem memória imunológica. Cada uma dessas linhas de defesa tem componentes celulares e humorais, que exercem a proteção. Existe interconexão entre eles: o sistema imune inato influencia o sistema imune adaptativo e vice-versa.
2. Desenvolvimento da imunidade inata dos leitões
Na fase de gestação, são encontrados nos fetos células linfóides na região do timo, no fígado e sangue periférico bem como algumas manifestações imunológicas após as 4 semanas de gestação. Entretanto, apresentam uma baixa capacidade de produzir anticorpos, face aos fetos estarem bem protegidos de agressores externos pela placenta materna. A placenta, com múltiplas camadas de epitélio coriônico ao mesmo tempo em que protege, representa uma barreira física que dificulta a transferência de imunoglobulinas maternas, assim os fetos nascem imunologicamente despreparados e dependem em grande parte da imunidade transferida via colostro (passiva). A proteção inicial do recém nato é feita por um complexosistema de defesas naturais inato, representado por barreiras anatômicas e mecânicas, moléculas de secreção e componentes celulares tais comobarreiras da pele, dos epitélios, das mucosas, substâncias de secreção, movimento dos intestinos e cílios bronco-pulmonares (proteínas surfactantes da superfície pulmonar); células de fagocitose como neutrófilos e macrófagos que têm a sua ação complementada pelas imunoglobulinas e constituintes do colostro transferidos pela mãe.
Os desafios da morbidade ambiental a que os leitões estão expostos os tornam altamente susceptíveis a microorganismos presentes na maternidade com os quais nunca tiveram contato, gerando desafios com grande dependência das imunoglobulinas maternas oriundas do colostro. Esta importante barreira passiva do colostro permanece alta até certa idade. Leitões com 3 a 4 semanas começam a produzir anticorpos como resposta aos desafios do meio e também dos excretas e contaminação via porca.
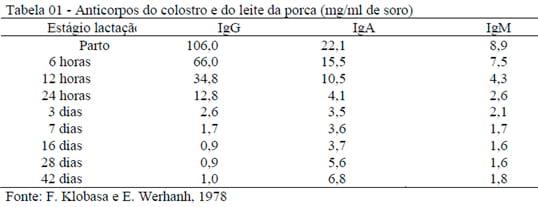
O Colostro é constituído por proteínas, imunoglobulinas, como a IgG (70-80%) , 10-15% de IgM, e 10-15% de IgA. Apresenta ainda, linfócitos dos quais 60 a 80 % são linfócitos T. A IgA secretada é de importância fundamental na proteção da mucosa pulmonar e intestinal. Durante toda a lactação Imunoglobulinas são secretadas em quantidades pequenas propiciando proteção contra as infecções intestinais. Leitões são predispostos a infecções intestinais tendo dependência da imunidade lacto gênica. As maioria Imunoglobulinas Inatas, (IgG) passam do plasma materno para a glândula mamária sem transformações, são absorvidas por um mecanismo de micropinocitose na forma de pequenos glóbulos de tamanhos variados via sítios receptores presentes nas membranas basais das células epiteliais glandulares. O número de sítios de recepção aumenta próximo do parto, atinge seu máximo 3 dias antes do parto, e a absorção é maior nas ultimas porções do intestino delgado. As IgM e IgA do colostro pré e ou no parto são multiplicadas por 3 a 5 vezes em relação ao sangue, o epitélio mamário ÍNTEGRO é fundamental e desempenha um papel vital neste processo de captação.
O colostro apresenta ainda outros importantes constituintes de ação específica tais como as lisozimas, lactoferrina, fosfatase alcalina, gamaglutamil-transferase e outros fatores de crescimento, incluindo o fator de crescimento epidermal-EGF, (Fontes et al., 2007). A lactoferrina faz parte do sistema lactoperoxidase do colostro, contribui acentuadamente como preventivo nas infecções intestinais dos leitões, tem presente um fator anti-tripsínico, que é importante para os recém-natos evitando a destruição das imunoglobulinas. As imunoglobulinas aparecem na circulação sangüínea 3 a 4 horas após a ingestão do colostro e a IgG predominante no início passa para cerca de 11% aos 21 dias de lactação.
A manutenção da imunidade passiva, saúde intestinal, integridade do trato digestório e higidez dos leitões no período compreendido entre a primeira semana (decréscimo das imunoglobulinas do colostro) e o início de funcionamento do seu sistema imune com 3 a 4 semanas é dependente de vários fatores entre eles:
a) barreiras físicas representadas pelassuperfícies epiteliais que formam uma camada impermeável à maioria dos agentes infecciosos, têm a sua ação facilitada pela descamação dos epitélios, facilitam a remoção de bactérias e outros agentes infecciosos. Estes processos são complementados pelos movimentos dos cílios e peristálticos ajudam a manter as vias aéreas e o trato gastrintestinal livres de microorganismos.
b) Substancias de secreçãocomo a saliva previnem infecções da boca, o HCl gástrico tem ação anti-séptica, e ainda pela adesividade do muco que cobre o trato respiratório e gastrintestinal ajuda a proteger os pulmões e o sistema digestivo contra as infecções. Os ácidos graxos da pele inibem o crescimento de bactérias. Lisozimas e fosfolipases encontrados na saliva, secreções nasais e lágrimas, podem destruir a parede celular da bactéria e desestabilizar as membranas bacterianas. Proteínas de baixo peso molecular (defensinas) e agentes surfactantes encontrados nos pulmões e no trato gastrintestinal têm importante atividade antimicrobiana.
c)Fatores biológicos, representados pela flora normal da pele e trato gastrintestinal, que pode prevenir a colonização de estruturas e epitélio por bactérias patogênicas. Leitões devem estabelecer uma eubiose nas fases iniciais de vida com ocupação da mucosa, competição por nutrientes com patógenos, com produção de substâncias antimicrobiana pelas bactérias benéficas (bacteriocinas).
3. Tecido linfóide associado ao intestino ( GALT)
O intestino tem importante ação imunológica e funciona como a principal barreira natural contra invasões microbianas via dieta. Aproximadamente 25% da mucosa intestinal é composta por tecido e células linfóides. O tecido linfóide associado ao intestino (GALT) é formado por nódulos linfáticos, placas de Peyer, macrófagos e linfócitos individuais encontrados nas paredes intestinais. Para lidar com a constante inundação de toxinas e antígenos em potencial, a parede intestinal apresenta um mecanismo altamente organizado e eficiente para o processamento antigênico, imunidade humoral e imunidade celular. Assim, as placas de Peyer e o tecido linfóide associado ao intestino (GALT) reconhecem antígenos através de um mecanismo especializado de amostragem via células (M) das micro-vilosidades contidas no epitélio. As células M recobrem os folículos linfóides no trato gastrintestinal e fornecem um sítio para a amostragem seletiva dos antígenos intra-luminais que ativam e estimulam as células B e T. Os linfócitos ativados a partir dos folículos linfóides deixam o trato intestinal e migram para a lâmina própria e linfáticos aferentes dos linfonodos mesentéricos. Os linfócitos B tornam-se linfoblastos carreadores da imunoglobulina de superfície (Ig A), desempenhando importante função de proteção e imunidade da mucosa. Este é um dos principais mecanismos de proteção imune do trato intestinal onde os plasmócitos da lâmina própria sintetizam e secretam a IgA.
O intestino contém mais de 70% das células produtoras de IgA produzida pelos plasmócitos a qual pode ligar-se a antígenos na superfície da mucosa. A IgA atravessa as células epiteliais para o lúmen por meio de um carreador protéico que a transporta e a protege contra os lisossomos intracelulares. A IgA é resistente à proteólise intraluminal, não ativa à resposta inflamatória e o sistema complemento neutraliza as toxinas bacterianas e a atividade viral da superfície da mucosa, bloqueia a aderência da bactéria no epitélio, reduz a penetração invasiva de antígenos via mucosa exercendo um potente ação protetora. Nos leitões a IgA desempenha importante função protetora para todo o organismo principalmente nas primeiras semanas de vida (Thoreux et al., 2007).
4. Interação dos glucanos e mananos (MOS) com a imunidade
A maioria dos prebióticos afetam beneficamente o hospedeiro por estimular o crescimento seletivo e à atividade de baterias intestinais que constituem a da flora estrófica, reduzindo a presença de microorganismos patogênicos. Dentre as classes de prebióticos mais utilizadas destacam-se os frutoligossacarídeos (FOS), mananoligossacarídeos (MOS) e glucanos. Diversas pesquisas e publicações referem às propriedades destes em modificar a flora intestinal, reduzir a taxa de renovação da mucosa intestinal e estimular o Sistema imune (Abbas, 2000; Guigoz, y. 2003; Wittig et al, 2003). O estímulo imunológico da mucosa favorece a produção de anticorpos IgA, que bloqueiam os receptores e reduzem o número de bactérias patogênicas na luz intestinal (Olah e Vervelde, 2008).
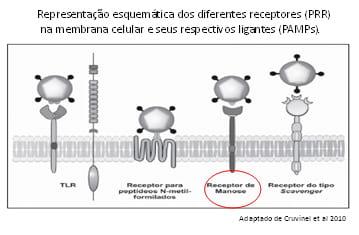
Os mananoligossacarídeos (MOS) parecem ter uma ação efetiva na resposta imunológica, uma hipótese para este mecanismo de ação sugere que moléculas tais como resíduos de manose e lipopolissacarídeos, encontradas na superfície de microorganismos, constituem Padrões Moleculares Associados a Patógenos (PAMPs) que ativam a resposta imune inata, por interação com diferentes receptores conhecidos como Receptores de Reconhecimento de Padrões (RRP), dentre os quais a família dos receptores Toll-like (TLRs) presentes na membranas celulares. Os TLRs se ligam a patógenos e iniciam uma resposta inflamatória ( fig 1). Esses receptores estão presentes nos macrófagos, neutrófilos e células dendríticas. As células dendríticas encontradas nos tecidos epiteliais periféricos do GALT capturam antígenos e viabilizam a sensibilização da resposta imune adaptativa apresentando antígenos aos linfócitos. Estas células constituem uma ponte entre a imunidade inata e a adaptativa, migrando para os linfonodos regionais, nos quais processam e apresentam os antígenos. Este processo promove a liberação de citosinas, ativando a resposta imune adquirida (Collet ,200; Cruvinel,2010). Estes prebióticos também favorecem o crescimento de bactérias eutróficas produtoras de ácido lático, as quais produzem substâncias imunomoduladoras que reagem com o sistema imune em diferentes níveis, incluindo a produção de citosinas, células mononucleares e a fagocitose dos macrófagos, bem como a indução de grandes quantidades de imunoglobulinas, especialmente IgA (Cummings e MacFarlane, 2002 ).
5. Imungologulinas na dieta de leitões
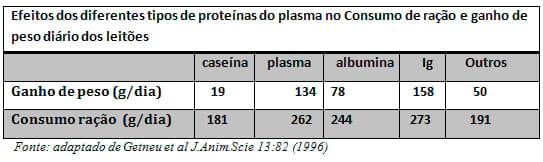
No Brasil, é prática comum o uso de Imunoglobulinas oriundas do plasma suíno ou bovino nas rações pré-iniciais. Está pratica é considerada como elemento chave na dieta por alguns nutricionistas, buscando-se a melhora de ganho e desempenho. O uso tradicional de plasma em rações pré-iniciais oscila entre 3 A 5 % como importante fonte de complementar Imunoglobulinas e aminoácidos (Mavromiclhalis, 2009). Acredita-se que os mecanismos pelos quais o plasma sangüíneo promove esta melhoria no desempenho estejam relacionados a palatabilidade e a sua composição, uma vez que contém 22,5% de imunoglobulinas, 28,0% de albumina e 0,5% de proteínas de baixo peso molecular. A presença de imunoglobulinas pode aumentar a imunocompetência dos animais, prevenirem os danos causados por patógenos na parede intestinal e manter as propriedades digestivas e absortivas do intestino (Pierce et al., 1995; Gattas et al 2008). Contudo, estudos de Gteneu (1996) revistos por Mavromiclhalis (2009) demonstram claramente que apenas frações de plasma de alto peso molecular têm a capacidade de realmente influir no ganho de peso e melhora de desempenho. Variações de 8 a 15% no teor de imunoglobulinas do plasma são decorrentes da sua origem, isto é, plasma de diferentes abatedouros e frigoríficos com diferentes conteúdos e padronizações, que podem levar a variações de qualidade e desempenho dos leitões. Estes fatores associados à proibição de uso de plasma bovino em alguns países pelo risco da BSE, bem como o carreamento de antígenos, levou pesquisadores a uma procura de fontes alternativas de imunoglobulinas (quadro 1) .
6. Imunoglobulinas hiperimunizadas do ovo ( IgY) em dietas de leitões
Uma das principais alternativas de imunoglobulinas avaliadas nos últimos 10 anos é a utilização de imunoglobulinas de ovosque apresentam benefícios e efeitos iguais ou superiores àqueles do plasma animal. Ovos de poedeiras podem ser hiperinunizados contra patógenos específicos de leitões tais como cepas de E. coli enterotoxigenica (ETEC) , produzindo imunoglobulinas (IgY) que reduzem significativamente o escore de diarréias e aumentam a viabilidade e peso dos leitões, aparentemente por inibirem a adesão destes microorganismos nos enterócitos do intestino delgado de leitões recém-natos (Sugita-Konishi, 1996).
Estudos com leitões sadios utilizando imunoglobulinas de ovo (IgY) por pesquisadores no Japão constaram um aumento significativo de ganho de peso e redução do escore de diarréias. Duas horas após sua administração as imunoglobulinas (IgY) são identificadas no soro de leitões recém-natos e seu pico de concentração ocorre 24 horas após a ingestão. As IgY agem efetivamente na terapia e profilaxia de leitões recém-nascidos infectados com ETEC, podendo ser usadas como fonte de anticorpos de baixo custo contra doenças infecciosas (Yokoyama et al., 1993 Mavromiclhalis, 2009).
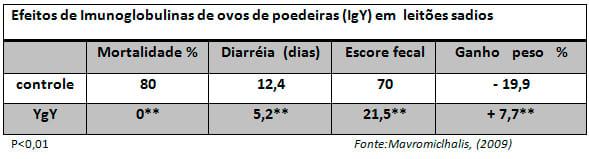
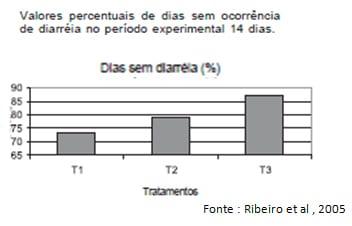
Ribeiro et al (2005) em estudo com leitões recém-natos verificaram que as IgY de gema de ovos de aves hiperimunizadas contra E. coli suína fornecidas via oral foram absorvidas eficientemente já nas primeiras horas após o nascimento, constando um efeito benéfico no controle da diarréia, embora não houvesse mais absorção intestinal.
7. Considerações IgY :
Embora os resultados com imunoglobulinas de ovo de aves hiperimunizados tenham mostrado resultados positivos, alguns inconvenientes podem ocorrer, pois, nem todos os produtos são conservados da mesma forma, podendo apresentar oscilações na sua qualidade. Outro fator importante é a forma como as imunoglobulinas são produzidas, variando desde o uso de coquetéis de microorganismos patógenos que podem gerar produtos onde não se conhece o valor e especificidade exata das imunoglobulinas resultando em efeitos não esperados. È importante a utilização de processos específicos que envolvam a inoculação do ovo com um patogeno específico, identificado e titulado levando à produção de imunoglobulinas específicas e conhecidas, estabelecendo-se padrões de uso com os efeitos desejados.
8. Bilbiografia
ABBAS, A.K. LICHTMAN AH: Cellular and Molecular Immunology. 6th ed. Saunders 2003.
BALLOU, C.E. A study of the immunochemistry of three yeast mannans. The Journal of Biological Chemistry, v.245, p.1197-1203, 1970.
BRANDTZAEG, P. Molecular and cellular aspects of the secretory immunoglobulin system. APMIS, v. 103, n.1, p.1-19, 1995.
CRUVINEL,WM, MESQUITA JÚNIOR,D, ARAÚJOJAP, CATELAN, TT, SOUZA AWS, SILVA,NP, ANDRADE ,LEC Aspectos moleculares e celulares da imunidade inata Ver. Bras. Reumatol.;50(4):434-61. 2010
CUMMINGS, J.H. e MacFARLANE, G.T. Gastrointestinal effects of prebiotics. British Journal of Nutrition, v.87, n.2, p.145-151, 2002.
ENGLISH, P.R. Improving piglet survival, growth to weaning and post weaning performance. In: SEMINÁRIO INTERNACIONAL DE SUINOCULTURA, 3., 1998, São Paulo. Anais... São Paulo: 1998. p.17-36.
GASKINS, H.R. Immunological development and mucosal defence the pig intestine. In: WISEMAN, J.; VARLEY, M.A.; CHADWICK, J.P. Progress in pig science. Nottingham University Press , 1998. p.81-102.
GOMEZ, G.G.; PHILLIPS, O.; GOFORTH, R.A. Effect of immunoglobulin source on survival, growth, and hematological and immunological variables in pigs. J. Anim. Sci., 76, p.1-7, 1998.
GOMEZ, F. E. et al. Parenteral nutrition and fasting reduces mucosal addressin cellular adhesion molecule-1 (MAdCAM-1) Mrna in Peyer´s Patches of Mice. J PEN, v.31, n.1, p. 47-52, 2007.
GUIGOZ, Y. et al. Effects of oligosaccharide on the faecal flora and non-specific immune system in elderly people. Nutrition Research, v.22, n.1, p. 13-25, 2002.
KALESNIKOFF J, GALLI SJ. New developments in mast cell biology. Nat Immunol 2008; 9:1215 23.
KELLEY, K.W.; KENT, S.; DANTZER, R. Why Sick Animals don´t grow: an immunological explanation. In: HOLLIS, G. R. Growth of the pig. CAB International, 1993. p.119-132.
KLOBASA, F.; WERHAHN, E.; BUTLER, J.E. Compositiom of sow milk during lactation. J. Anim. Sci., 64, p.1458-1466, 1988.
KUNKEL EJ, BUTCHER EC. Chemokines and the tissue-specific migration of lymphocytes. Immunity. 2002; 16:1-4.
KANG, W.; KUDSK, K. Is there evidence that the gut contributes to mucosal immunity in humans? J. PEN, v.31, n.3, p.246-258, 2007.
KLASING K.C. Nutritional modulation of resistance to infectious diseases. P. Science, v.77, n.8, p.1119-1125, 1998.
KOGUT, M. H. e KLASING, K. An immunologist’s perspective on nutrition, immunity, and infectious diseases: Introduction and overview. Journal of Applied P. Research, v.18, p.103–110, 2009.
MEDZHITOV R. Origin and physiological roles of inflammation .Nature .454:428-35, 2008.
PARKIN J, COHEN B. An overview of the immune system. Lancet. 2001; 357:1777-89.
PATIE0NCE, J.F.; GONYOU, H.W.; WHITTINGTON, D.L. et al. Evaluation of site and age of weaning on pig growth performance. J. Anim. Sci. 78:1726-1731, 2000.
PIERCE, J.L.; CROMWELL, G.L.; LINDEMANN, M.D. et al. Assessment of three fractions of spray-dried porcine plasma on performance of early-weaned pigs. Journal of Animal Science, v.73, p.81 (Suppl.1), 1995.
KUDSK, K.A. Current aspects of mucosal immunology and its influence by nutrition. Am J Surg, v.183, n.4, p.390-8, 2002.
McKAY, D. M. e PERDUE, M.H. Intestinal epithelial function: The case for immunophysiological regulation. Digestive Diseases and Science, v.38, p.1377– 1387, 1993.
GATTÁS, G; FERREIRA, AS; BARBOSA,FF; et al Plasma sangüíneo em pó em dietas para leitões desmamados aos 14 dias de idade. R. Bras. Zootec., v.37, n.2, p.278-285, 2008
RIBEIRO,ALM; RUDNIK,L, CANAL,CW, KRATZ LR; ,FARIAS,C Uso de Gemas de Ovos de Aves Hiperimunizadas Contra Escherichia coli Suína no Controle da Diarréia Neonatal de Leitões R. Bras. Zootec., v.34, n.4, p.1234-1239, 2005.
SUGITA-KONISHI, Y.S.; SHIBATA,K.; YUN, S.S. et al. 1996. Immune functions of immunoglobulin Y isolated from egg yolk of hens immunized with various infectious bacteria. Bioscience Biotechnology and Biochemistry, v.60, n.5, p.886-888, 1996.
THOREUX, K.; OWEN, R.; SCHMUKER D.L. Functional Foods, mucosal immunity and aging: effect of probiotics on intestinal immunity in young and old rats. Communicating Current Research and Educational Topics and Trends in Applied Microbiology, p.458- 465, 2007.
YOKOYAMA, H.; PERALTA, R.C.; DIAZ, R. et al. Passive protection of chicken egg yolk immunoglobulins against experimental enterotoxigenic Escherichia coli infection in neonatal piglets. Infection and Immunity, v.60, n.3, p.998-1007, 1992.
WITTIG, B.M.; ZEITZ Martin. The gut as an organ of immunology. Int J Colorectal Dis, v.18, n.3, p.181-187, 2003.
YOKOYAMA WM, KIM S, FRENCH AR. The Dynamic life of natural killer cells. 2004; 22:405-29.
Tópicos relacionados
Autores:
Junte-se para comentar.
Uma vez que se junte ao Engormix, você poderá participar de todos os conteúdos e fóruns.
* Dados obrigatórios
Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.
Criar uma publicação





.jpg&w=3840&q=75)