extratos plantas suínos ciência
Uso de extratos de plantas e acidificantes para suínos, o que diz a ciência e a prática atual?
PALAVRAS-CHAVE: extratos de plantas, acidificantes, saúde intestinal, suínos
O uso de principios ativos da natureza vem sendo usado a milhares de anos para o tratamento de diferentes doenças humanas e dos animais, principalmente por suas qualidades antisépticas (Cowan, 1999). Existe uma grande disponibilidade de informação científica que comprovam que o uso profilático de antibióticos traz benefícios no aumento do consumo de alimento, sua eficiencia de utilização e aumento no crescimento dos animais (Doyle, 2001; Dibner e Richards, 2005). Por outro lado, existem também fortes evidências que seu uso em baixa dosagem (promotora de crescimento) pode acarretar em cepas bacterianas resistentes (Budiño et al., 2005) e trazer resíduos aos produtos finais (Chen et al., 2005; Dibner e Richards, 2005; Roselli et al., 2005).
Por isso, em muitos países seu uso como antibiótico promotor de crescimento (APC) vem sendo questionado, como é atualmento o caso que está em discussão no Brasil e da União Européia que desde 2006 criou leis que contralam o uso indiscriminado de antimicrobianos. Após a restrição nesses países, cresceu muito o interesse cientifico pela busca de aditivos alternativos e que garantam o controle de doenças; o bem-estar e a produtividade dos animais (Lallès et al., 2009), além de garantir alimentos mais seguros e saudáveis (Varel, 2002).
Dentre os diferentes produtos disponíveis no mercado (probióticos, prebióticos, minerais organicos, entre outros), os extratos de plantas e acidificantes representam dois grandes grupos de aditivos com promissores efeitos na saúde e bem-estar animal. Portanto, este trabalho centrará uma especial atenção nos resultados científicos publicados (focando em parâmetros de saúde intestinal) e dará uma visão atual do uso prático destes aditivos para a produçao de animais mais saudáveis.
Ainda nos dias de hoje, não somos capazes de identificar e caracterizar a infinidade de compostos ativos que existem disponíveis na natureza para o tratamento das mais distintas enfermidades que atacam os homens e os animais.
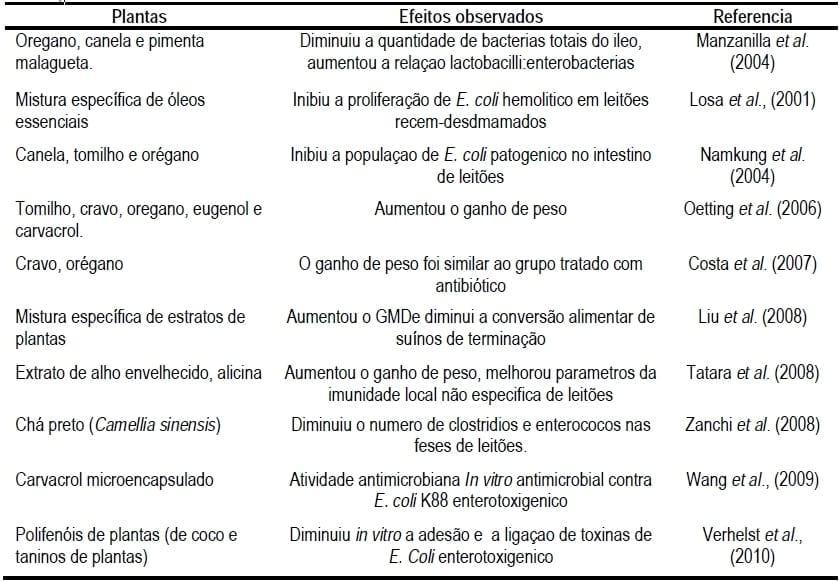
Entretanto, a pesquisa e desenvolvimento de aditivos baseados em extratos de plantas para suínos e aves, focou nos componentes naturais com atividade antimicrobiana, já que acredita-se ser um dos principais modos de ação dos antibióticos promotores de crescimento (Lallès et al., 2009). Porém, existem outros diferentes efeitos descritos, como 1) influencia na função immune (Koh et al., 1998: Boyaka et al., 2001); estimulação de enzimas endógenas (Platel e Srivasan, 1996); 3) antiparásitos (Force et al., 2000); 4) antifúngico (Mahmound, 1994); antiviral (Bishop, 1995; Garcia et al., 2003); 6) estímulo na produção de muco intestinal (Jamroz et al., 2006) e 7) atividade antioxidante (Dorman et al., 2000, Teissedre e Waterhouse, 2000). A sua inclusão na dieta ainda mostrou um efeito interessante de estimular o apetite através do aumento da palatabilidade (Close, 2000; Doyle, 2001, Wenk, 2006). Dado este amplo expectro de efeitos, os extratos de plantas devem ser considerados um dos principais candidatos para ser melhor estudados e empregados no que diz respeito não somente ao desmame dos leitões mas também em outros problemas na criação de animais (Kamel, 2001).
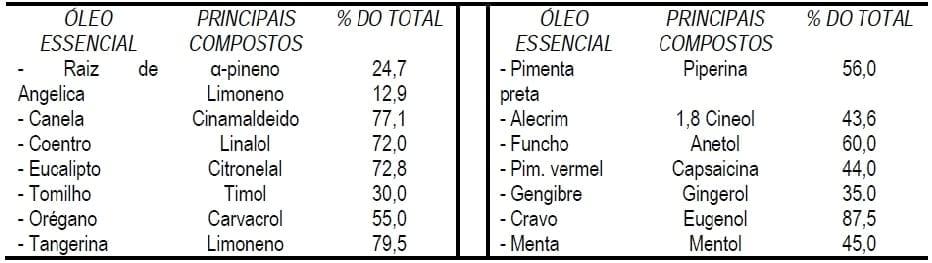
Neste sentido, os óleos essenciais (OE), extraidos das plantas de origem principalmente através do processo de destilação. são preferentemente usados na produção destes aditivos, pois neles estão concentrados os principios ativos das plantas (Windisch et al., 2008). Estima-se que atualmente são conhecidos mais de 3000 OE dos quais aproximadamente 300 (ver Tabela 1 com alguns exemplos), são comercialmente importantes tanto para a indústria de fragâncias e aromas, como para a produção de aditivos para animais (Van de Braak e Leijten, 1999). Além disso, a indústria de produção de OE representa um importante e crescente mercado. Por exemplo, na União Européia sua produção em 1996 era de 60 ton (Greathead, 2003) e em 10 anos apresentou um crescimento de 10 vezes (Brenes e Roura, 2010).
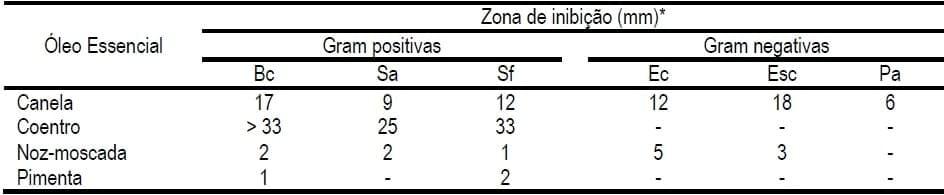
Como mencionado anteriormente, existe um grande interesse por aqueles OE com características bactericidas, já que acredita-se ser um dos principais modos de ação para modular a microbiota intestinal (Dorman e Deans, 2000). Existe uma ampla variedade de estudos que avaliaram esta capacidade, sendo a grande parte deles testados in vitro (Rota et al., 2004). Nestes estudos foram traçadas diversas comparações entre os OE e a concentração mínima inibitória de crescimento de diferentes cepas bacterianas selecionadas (ver Tabela 2 com alguns exemplos). Neles pode-se observar que de maneira geral as bactérias Gram negativas são mais resitentes que as Gram positivas (Chao et al., 2000).
(-) = ausência de inibição. * Quanto maior a zona de inibição, maior potencial bactericida.
Porém, apesar de todos estes modos de ação descritos, ainda existe a necessidade de evidenciar os mecanismos pelos quais cada OE age por separado (Windisch et al., 2008; Brenes e Roura, 2010), visto que muitos dos trabalhos in vivo usaram misturas de distintos OE. Apenas alguns deles, por exemplo demonstraram que o timol e o carvacrol são capazes de desintegrar a membrana de bactérias Gram negativas, liberar a superficie lipopolisacaridea e aumentar a permeabilidade da membrana que acarreta em morte bacteriana (Helander et al., 1998; Xu et al., 2008), mas a maioria deles ainda se desconhece seu mecanismo completo de ação.
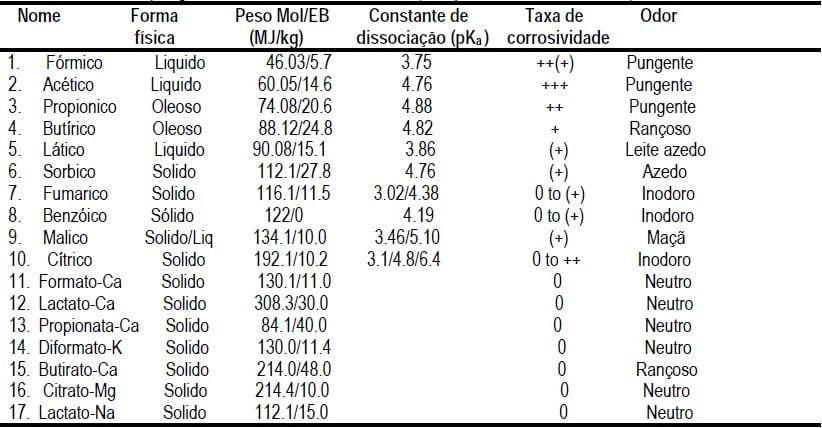
São compostos que possuem a capacidade de baixar o pH de uma solução, podendo ser inorgânicos ou orgânicos (ver tabela 4, com características fisico-quimicas de alguns acidificantes, ordenados por seu peso molecular). Os ácidos orgânicos são amplamente distribuidos na natureza como constituintes de tecidos animais e vegetais, eles ainda podem ser formados a partir da fermentação microbiana de carboidratos predominantemente no intestino grosso dos suínos (Partanen e Mroz, 1999). Já os ácidos inorgânicos (o exemplo mais empregado é o ácido fosfórico) são considerados de mais baixo custo e podem ser associados aos orgânicos para obter sinergismo de efeitos (Jacela et al., 2009). Porém, os orgânicos correspondem a grande maioria dos acidificantes comercialmente disponíveis e testados por serem ácidos mais fracos, menos corrosivos e potencialmente menos tóxicos que os inorgânicos. Portanto este trabalho se centrará mais na apresentação dos resultados destes,
A pesquisa com o uso de acidificantes foi bastante focada em animais jovens, pois segundo Maxwell e Carter (2001), o sistema digestivo de leitões recém-desmamados não é suficientemente desenvolvido para superar o desafio da transição de dietas líquidas (leite materno) para a sólida (cereais farelados), sendo fisiologicamente imaturos por não produzirem suficiente ácido clorídrico (HCl) e assim manter o pH em níveis ótimos (aproximadamente 3,5). Neste pH, a digestão proteica e o crescimento de populações benéficas de bactérias (lactobacilos) são maximizadas e as possíveis bactérias patogênicas são inibidas. Além do desmame, outra fase importante a ser considerada para o emprego de acidificantes é o das fêmeas em fase de gestação/lactação onde se busca a redução do pH urinário para assim inibir o crescimento de bactérias patogênicas que podem causar infecções urinárias (Kluge et al., 2006).
Na tabela 4 se apresenta alguns dos ácidos orgânicos mais comumente empregados na alimentação de suínos. Pode-se observar que a maioria deles se apresentam na forma líquida e, por isso, de mais dificil inclusão na dieta, já as suas formas em sais e alguns como o cítrico e o benzóico se apresentam na forma sólida, são menos corrosivos e também foram descritos por seu possível potencial de melhorar o desempenho e conversão alimentar de leitões recém-desmamados (Overland et al., 2000; Paulicks et al., 2000; Kluge et al., 2006; Torrallardona et al., 2007).
Por último, na tabela 4 também apresenta-se as caraterísticas aromáticas de cada ácido. É um ponto importante a ser avaliado, pois se um ácido possui um odor irritante, repulsivo e com sabor predominantemente azedo, como por exemplo o ácido fórmico e o propionico, podem interferir na palatabilidade e consumo de ração. Enquanto que por outro lado, o ácido lático e o butírico podem ser bastante atrativos aos leitões, por apresentarem um odor lácteo (Fireman, 2010).
Dentre os benefícios sugeridos com a pesquisa da inclusão de acidificantes e seus sais nas dietas de suínos, estão aqueles relacionados com as propriedades antimicrobianas de seus cations e anions, descritos anteriormente (Partanen, 2001). A redução da carga bacteriana pode consequentemente, gerar uma melhora na saúde gastrointestinal. Resultando um aumento no crescimento dos animais por aumento no consumo e melhora na conversão alimentar (Giesting et al., 1991; Overland et al., 2000), pode ainda reduzir a incidencia e severidade da diarréia dos animais (Tsiloyiannis et al., 2001; Owusu-Asiedu et al., 2003), ou para controlar a contaminações e infecções por Salmonella spp. através da ração de (Creus et al., 2007). Além de também ser utilizados para preservar grãos com alta umidade e como inibidores do crescimento fúngico na ração (NRC, 1998).
Outro acidificante amplamente estudado é o ácido benzóico, devido a sua elevada capacidade bactericida Em um estudo comparativo dos diferentes ácidos orgânicos, observou-se por exemplo que o ácido benzóico apresentou um efeito superior aos outros testados na inibição do crescimento tanto de
bactérias ácido láticas como de coliformes no estomago e conteúdo intestinal (Knarreborg et al., 2002). Outro trabalho recente apresentou seu poder bactericida frente a Salmonela spp. (Paulus et al., 2011). Portanto parece ser que este acidficante apresenta um marcado poder bactericida em toda a microbiota intestinal, como foi já comprovado em diferentes experimentos in vivo e que acabaram refletindo em um aumento significativo na performance produtiva (Maribo et al., 2000. Kluge et al., 2006; Torrallardona et al., 2007).
De maneira geral, os relatos científicos apoiam o uso de acidificantes em dietas de suínos, devido ao seu interessante potencial em aumentar a performance produtiva pela melhoria no processo digestivo através de diferentes mecanismos de ação que ainda necessitam ser mais elucidados. Entretanto, seu uso parece ser mais benéfico em animais jovens na fase de transição do desmame para controle de patologias entéricas (Mroz, 2005; Jacela et al., 2009), além de seu papel no controle e prevenção de infecções urinárias (Kluge et al., 2006).
Portanto, existe ainda um promissor caminho pela frente a ser seguido para aqueles que visam a criação de animais mais saudáveis, com o mínimo impacto ao meio ambiente e que garantam a segurança alimentar dos consumidores.
Applegate TJ, Klose V, Steiner T, et al. (2010) Probiotics and phytogenics for poultry: myth or reality? J Appl Poult Res 19, 194-210.
Concordamos plenamente com as colocaçoes de isabella quando se trabalha com a associaçao dos acidos láctico e fórmico levando a um processo de neutralizaçao da açao corosiva do ac. lactico asim como excelentes resultados na prática.
Parabéns Dr. Rafael pelo excelente artigo. Realmente o uso de aditivos precisa ser mais disseminado, pois sua eficácia é inquestionável.
Quanto ao fato do ácido lático ser muito corrosivo, a sua utilização com o ácido fórmico leva a sua esterificação, tornando o produto seguro para utlização sem causar qualquere tipo de corrosão. Em ambiente básico (intestino delgado) ocorrerá a hidrolisação desse éster, permitindo que os ácidos lático e fórmico atuem acidificando o meio, criando o efeito antibacteriano.
A Perstorp (empresa sueca do ramo de ácidos orgânicos) é representada no Brasil pela Vaccinar Nutrição e saúde animal, e possui o produto ProPhorce PH (nas formas de pó e líquido para água de beber) que é justamente a associação do éster e ácido lático e fórmico com os óleos essenciais (também mencionados no artigo). O produto possui excelentes resultados, e terei o maior prazer em explicar sua utilização, bem como mostrar testes e resultados obtidos em vários países do mundo com seu uso.
Coloco-me a disposição para conversarmos!
Um abraço,
Isabella Xavier










.jpg&w=3840&q=75)