INTRODUÇÃO
As afecções entéricas, caracterizadas principalmente pela diarreia, estão dentre as condições mais frequentes nos sistemas de produção de suínos, sendo responsável por perdas significativas para a indústria. Estas perdas são representadas, primariamente, pela redução do ganho de peso médio, elevação dos índices de mortalidade e do uso de medicamentos [14]. Além disto, algumas doenças entéricas são causadas por agentes patogênicos com potencial zoonótico [22], como por exemplo, Salmonella enterica.
Existe uma grande variedade de agentes potencialmente enteropatogênicos causadores de diarreia em suínos nas fases de recria e terminação. As condutas terapêuticas e/ou preventivas contra estes agentes são muitas vezes diferentes, demonstrando, consequentemente, a importância do diagnóstico correto para que sejam adotadas as medidas mais adequadas. Além disto, frequentemente, mais de um agente pode estar envolvido com o problema, o que complica ainda mais o cenário. Assim sendo, tem-se como objetivo discutir as principais medidas de controle de diarreia em animais em recria e terminação, relacionando com agentes envolvidos no processo.
PRINCIPAIS CAUSAS DE DIARREIA.
Vários são os agentes sugeridos como possíveis causas de diarreia em suínos nas fases de recria e terminação. Lawsonia intracellularis causadora da enteropatia proliferativa suína, também conhecida como ileíte, salmonelose suína causada pela Salmonella enterica sorovar Typhimurium, espiroquetose intestinal suína causada pela Brachyspira pilosicoli, disenteria suína causada pela Brachyspira hyodysenteriae, Circovirus suíno tipo 2 (PCV2) causador da circovirose suína e Trichuris suis causador da tricuríase intestinal são as infecções mais prevalentes nesta faixa etária, baseado na literatura internacional [2,17,18]. Stege et al. [17] demonstraram que cepas de Escherichia coli enterotoxigênicas também podem estar presentes em leitões entre 30-50 kg de peso vivo com ou sem sintomas de diarreia.
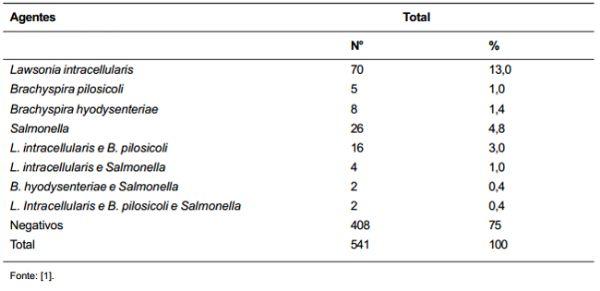
Existem somente dois estudos nacionais sobre a frequência destes agentes em rebanhos brasileiros. No primeiro estudo, Baccaro et al. [1] utilizou o teste da PCR Multiplex para detecção de DNA de L. intracellularis, B. hyodysenteriae, B. pilosicoli e Salmonella sorovar Typhimurium em 541 amostras de fezes de suínos. Estes animais tinham entre 60 e 140 dias de idade, sendo provenientes de 70 granjas de sete diferentes estados brasileiros (São Paulo, Santa Catarina, Paraná, Rio Grande do Sul, Minas Gerais, Mato Grosso do Sul e Goiás). Os resultados obtidos neste estudo, resumidos na tabela 1, representam a frequência destes agentes patogênicos, baseado em amostras individuais de fezes. O agente patogênico mais frequente foi a L. intracellularis (17,4%, detecção individual ou combinada). As frequências individuais das Brachyspiras foram baixas. A detecção de DNA de Salmonella, que foi de 6,6%, não diferencia cepas patogênicas de não patogênicas. Importante salientar que 16 animais (3%) estavam eliminando tanto L. intracellularis quanto B. pilosicoli nas fezes (infecção mista), o que é extremamente importante na recomendação terapêutica nestas propriedades.
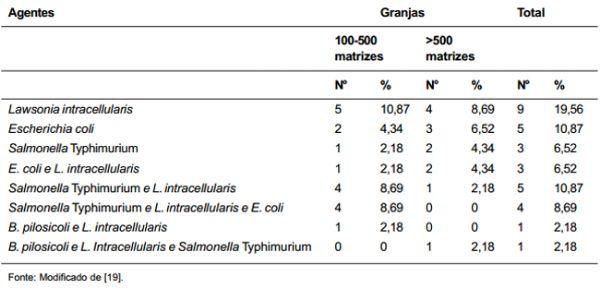
Viott [19] em tese de doutorado recentemente defendida, estudou a prevalência de enteropatógenos de animais de recria e terminação nas quatro principais mesoregiões produtoras de suínos do estado de Minas Gerais (Triângulo Mineiro e Alto Paranaíba; Sul e Sudoeste; Metropolitana de Belo Horizonte; e Zona da Mata). Foram coletadas amostras de fezes de 10 a 15 animais de 46 granjas de ciclo completo, que apresentavam problema de diarreia nas fases de recria e terminação. As amostras de fezes foram testadas pela PCR Multiplex para detecção de DNA de L. intracellularis, B. pilosicoli e B. hyodysenteriae, além de isolamento bacteriano para E. coli e Salmonella, seguidos de tipificação pela PCR Multiplex para fatores de virulência e sorotipificação, respectivamente. Além disto, foi realizado teste parasitológico de flutuação. Na tabela 2 são encontrados os resultados gerais de agentes infecciosos por granja, diferentemente do estudo de Baccaro et al. [1] que trabalhou com resultados individuas dos animais. Mais uma vez, a L. intracellularis foi o agente enteropatogênico mais frequentemente detectado, estando presente isoladamente em 19,6% das granjas estudadas, e em um total de 50.1% dos rebanhos quando também considerada a detecção de mais de um agente na mesma granja. A Salmonella Typhimurium foi o sorovar mais detectado (28,3% das granjas, isoladamente ou em associação). E. coli enterotoxigênica foi o terceiro agente mais detectado, com 10,9% e 26,1% das granjas positivas, isoladamente e/ou em associação, respectivamente. B. pilosicoli somente foi detectada em duas granjas, em associação com outros agentes. Trichuris suis e B. hyodysenteriae não foram detectados em nenhuma amostra.
É importante salientar que tendo conhecimento da frequência de patógenos em diferentes regiões do país, a chance de acerto na conduta terapêutica aumenta significativamente. Assim sendo, mais estudos epidemiológicos deveriam ser conduzidos nos países, para auxiliar o médico veterinário especialista em suínos. Entretanto, estas informações epidemiológicas não eliminam a necessidade de confirmação laboratorial do diagnóstico clínico de cada granja, para confirmar que a conduta terapêutica adotada foi a mais acertada.
CONTROLE DA L. INTRACELLULARIS.
No Brasil, a grande maioria das granjas tem uma combinação de problemas respiratórios, representados principalmente por Mycoplasma hyopneumoniae e agentes bacterianos secundários, e problemas entéricos. Desta forma, os programas medicamentosos preventivos têm de atender ambos os problemas, o que torna a definição deste referido programa bastante difícil. De qualquer forma, quando são discutidos programas medicamentosos para controle de problemas entéricos na recria e terminação, isoladamente ou em associação com problemas respiratórios, o principal agente entérico que é considerado é a L. intracellularis. Esta conduta se justifica baseado nos resultados de frequência de problemas nos suínos nestas fases, como mencionado na seção anterior, bem como ao fato deste agente apresentar manifestação clínica variada, que vai desde subclínica ou inaparente, até aguda seguida de morte por quadro de diarreia hemorrágica.
Existem dois procedimentos básicos utilizados atualmente para o controle da enteropatia proliferativa suína. O primeiro, e mais tradicional, é a utilização de medicação preventiva, em doses terapêuticas. Esta medicação é administrada em pulsos de duas a três semanas, iniciando na entrada da recria, intercaladas com janela sem medicação de três a quatro semanas, para que se permita a exposição controlada dos animais à bactéria [7,9]. Este programa é mais bem empregado quando realizado posteriormente a avaliação de soroperfil do rebanho. Este soroperfil permite a determinação do momento do início da soroconversão. Neste caso, a medicação deve ser utilizada em pulso único, três a quatro semanas antes desta soroconversão [9]. Entretanto, os testes sorológicos não são amplamente disponíveis no Brasil, o que dificulta e limita a utilização desta. As drogas a serem utilizadas nestes pulsos são várias, e a literatura é vasta nesta área de terapêutica para L. intracellularis. Trabalho de revisão recente de França & Guedes [5] aborda com clareza toda a literatura sobre as medicações testadas contra o agente. As drogas tradicionalmente utilizadas vêm sendo tilosina, tiamulina, lincomicina, valnemulina e clortetraciclina, tendo a eficácia de algumas drogas sido confirmada recentemente, como a leucomicina e a tylvalosina [8]. O florfenicol, apesar de ser utilizado para o controle de enteropatia proliferativa a campo, ainda não teve sua eficácia testada em experimentos controlados. Trabalho recente de avaliação de concentração mínima inibitória de diferentes moléculas antimicrobianas, usando diferentes cepas norte americanas e europeias de L. intracellularis demonstrou baixos valores de MIC, que representam bom resultados, para a valnemulina, tiamulina e tilosina [21].
As janelas sem medicação, utilizadas entre os pulsos medicamentosos, são estratégia importante que permitem a exposição dos animais às cepas selvagens (de campo) da bactéria, sem, contudo, ocorrer um quadro clínico evidente. Esta exposição controlada impede que a utilização contínua de medicação nas fases de recria, início e meio da terminação induzam o desenvolvimento da forma aguda, hemorrágica, em animais próximos a idade de abate, por estarem totalmente susceptíveis quando o tratamento medicamento é interrompido. Atualmente, esta ideia de janelas de exposição está começando a ser utilizada no período da creche, por 10 a 14 dias, para que esta exposição ocorra mais precocemente.
O segundo procedimento que pode ser utilizado é a vacinação do rebanho com a vacina comercial com o microrganismo vivo inativado (Enterisol Ileitis) [12]. Esta é uma vacina eficaz recomendada para animais de cinco semanas de idade ou mais velhos. Os resultados publicados têm demonstrado um aumento do ganho de peso diário médio de 30g dia no grupo de animais vacinados. Importante lembrar que, por ser uma vacina viva, é necessária a interrupção de administração de antimicrobianos na ração ou na água, durante um período de sete dias, três antes e três depois do dia da administração da vacina na água. No Brasil, a vacina vem sendo utilizada em alguns rebanhos na fase de maternidade, em animais entre quatro e nove dias de idade. A justificativa para este procedimento é a elevada carga medicamentosa utilizada na creche e o receio de sua retirada.
A faixa etária ideal para utilização da vacina pode ser definida pela sorologia do rebanho, traçando o soroperfil. Entretanto, neste caso, a ideia de administração da vacina é expor o animal as cepas apatogênicas de L. intracellularis, antes que estes sejam expostos as cepas de campo. Assim sendo, a vacinação tem de ser realizada de quatro a cinco semanas antes da data estimada de contacto com as cepas da granja, que é determinada pelo início da soroconversão que ocorre entre duas a quatro semanas após a exposição. Assim sendo, a vacinação tem de ocorrer entre seis e nove semanas antes da soroconversão [20]. A introdução inicial da vacina não deve ser acompanhada por redução imediata do programa de medicação na ração ou água. Mas esta redução pode ser executada após verificação de que o programa esteja funcionando bem.
CONTROLE DA SALMONELLA ENTERICA SOROVAR TYPHIMURIUM.
No caso de surtos da salmonelose entérica, o objetivo do tratamento é a redução da intensidade dos sinais clínicos, diminuição da disseminação da infecção e prevenção da recorrência da doença no rebanho. Como a bactéria é intracelular facultativa, é frequentemente resistente a uma série de moléculas antimicrobianas. Além disto, a maioria dos experimentos de eficácia medicamentosa executados in vivo apresenta o delineamento preventivo e não terapêutico. Assim sendo, o isolamento bacteriano do surto e avaliação de sensibilidade microbiana são fundamentais para se evitar, no mínimo, a transmissão do agente e prevenção de contaminação dos animais ainda não infectados. Mais comumente, o tratamento, preferencialmente administrado na água, deve ser iniciado antes dos resultados dos testes de sensibilidade microbiana estarem prontos. Desta forma, a droga de escolha a ser recomendada ainda na primeira visita a granja deve se basear em experiências prévias ou em resultados de experimentos controlados [6]. Nestes casos, as drogas mais frequentemente utilizadas tem sido gentamicina, neomicina, estreptomicina, ampicilina, apramicina, ceftiofur, trimetoprim-sulfonamida, enrofloxacina e florfenicol [6,11].
Como em outras doenças infecciosas, medidas outras, além de medicação, são importantes para minimizar o impacto da doença. Como animais enfermos são a principal fonte disseminadora do agente no ambiente, estes devem ser eliminados ou isolados. Baias com animais doentes devem receber atenção especial, sendo que, além da medicação oral (solúvel ou na ração) estes animais deveriam receber aplicação de medicação parenteral de largo espectro. Além deste procedimento em animais enfermos, medidas higiênicas de manejo como limpeza de baias, cochos e bebedouros se fazem necessárias, bem como detalhada limpeza e desinfecção das instalações entre lotes. Atenção também deve ser dada a movimentação de pessoal entre baias e galpões, com troca de botas e ou vestuário, para se evitar a disseminação do agente.
Atualmente, a prevenção da infecção não é possível, e trabalhasse com o intuito de reduzir esta carga infectante. Assim sendo, e considerando que um percentual considerável dos animais são carreadores sãos, dois pontos a serem focados na prevenção de surtos são diminuir a carga infectante e maximizar a resistência do animal. Utilização de alimento e alimentação de qualidade e bem manejados reduz as chances de exposição à elevada carga bacteriana. Transporte de animais desmamadas e agrupamento de animais de várias origens em um único lote eleva consideravelmente as chances de surtos pelo stress associado a maior possibilidade de disseminação entre populações de diferentes estatus sanitário.
Estratégias nutricionais preventivas como a utilização de acidificantes (ácidos graxos voláteis), frutooligosacarídeos, prebióticos e probióticos tem apresentado resultados variados, mas demonstram no mínimo um benefício na redução da carga bacteriana e alteração da flora intestinal. A utilização de vacina viva atenuada de S. enterica sorovar Choleraesuis, cepa 54 (SC54), tem também demonstrado benefício na redução da carga bacteriana de S. enterica sorova Typhimurium no íleo e linfonodos mensentéricos de animais experimentalmente infectados [13].
CONTROLE DE ESPIROQUETAS (BRACHYSPIRA SP.)
Tanto o estudo de Baccaro et al. [1] quanto de Viott [19] demonstraram que a frequência de casos de Disenteria Suína é extremamente baixo nas regiões estudadas. Importante lembrar que o uso excessivo de antimicrobianos de forma preventiva, em pulsos ou como promotores de crescimento, podem mascarar a doença e dificultar seu diagnóstico. De qualquer forma, a realidade dos sistemas de produção brasileira indica realmente esta baixa frequência. No caso do diagnóstico de disenteria suína em uma propriedade, as medidas emergenciais seriam a de tratamento parenteral de animais clinicamente doentes e administração de medicação via água, preferencial, ou na ração em todas as faixas etárias. Esta conduta seria somente na fase aguda do processo para reduzir as perdas com mortalidade. Importante lembrar que não existe atualmente nenhum laboratório no Brasil executando avaliação de concentração mínima inibitória para Brachyspiras. Assim sendo, baseado na literatura internacional, as drogas mais frequentemente utilizadas vem sendo a valnemulina, tiamulina, tilosina e lincomicina, tendo tido as pleuromutilinas melhores resultados [10]. Após a redução das perdas nesta fase aguda, a única conduta viável do ponto de vista econômico é a erradicação da doença. Vários estudos já foram realizados demonstrando as perdas econômicas em granjas positivas para disenteria suína que inviabilização a convivência com o problema [16,23]. Para erradicação podem ser utilizados protocolos de despovoamento e repovoamento ou programas sem despovoamento que se baseiam na retirada de todos os animais jovens (abaixo de 10 meses) e medicação com elevadas concentrações de drogas efetivas por períodos de cerca de oito semanas nos animais remanescentes. Em ambos os programas de erradicação a limpeza, desinfecção e desratização das instalações e de regiões adjacentes a granja são essenciais.
As medidas de controle da espiroquetose intestinal, causada pela B. pilosicoli, são muito semelhantes as da disenteria suína, mas a importância da doença e o impacto da mesma são muito inferiores a causada pela B. hyodysenteriae. A sensibilidade microbiana é bem semelhante a da B. hyodysenteriae e foi muito bem sumarizada em publicação recente [3]. O período que requer maior atenção é o das duas primeiras semanas após transferências dos animais para a fase de recria. Os mesmos cuidados relacionados a higiene, limpeza, desinfecção e desratização utilizadas na disenteria suína se aplicam nas infecções por B. pilosicoli. Importante salientar que, como para a infecção por B. hyodysenteriae, não existe vacina comercial eficaz para o controle da espiroquetose intestinal.
CONTROLE DE ESCHERICHIA COLI ENTEROTOXIGÊNICA.
E. coli enterotoxigênica pode estar envolvida com diarreia de leitões até seis a oito semanas pós-desmame, particularmente nas primeiras duas semanas após transferências dos animais da creche para a recria [4]. Nos problemas recorrentes de colibacilose nesta faixa etária, o ideal é a avaliação de sensibilidade antimicrobiana in vitro para a escolha da droga. De qualquer forma, as medicações mais frequentemente utilizadas de forma preventiva tem sido aminoglicosídeos e polimixinas via água, ou fluoroquinolonas, colistina, neomicina apramicina ou lincomicinaespectinomicina na ração [15]. Entretanto, parte mais desafiadora para o sucesso terapêutico ou preventivo é a correta determinação do envolvimento de E. coli com o processo diarreico em animais na recria. Para tanto, é fundamental que seja feita a identificação de fatores de virulência nas cepas de E. coli isoladas de amostras de fezes ou de intestino de animais diarreicos. O simples isolamento, mesmo de cultura pura de E. coli, não é diagnóstico. Além disto, a visualização de colônias cocobacilares de bactérias em intimo contato com a superfície de enterócitos das vilosidades intestinais seriam informações definitivas de causalidade da diarreia. Importante lembrar que, mesmo em granjas com quadros graves de circovirose, a colibacilose causando diarreia no início da recria deve ser encarada como exceção e a não a regra, uma vez que a casuística de diarreia por E. coli nesta fase, comprovada em laboratórios de referências norte americanos, é baixa (Kurt Rossow, University of Minnesota, USA, comunicação pessoal).
CONCLUSÃO
O controle racional das diarreias de recria e terminação não está diretamente relacionado à medicação massiva nestas fases. O primeiro passo para um controle efetivo e melhora no desempenho é a identificação de que o percentual de animais com diarreia está muito elevado e que algo deve ser feito. Em seguida, um diagnóstico clínico baseado na fase, sintomatologia clínica e achados de necropsia deve ser firmado. Estes são aspectos fundamentais para a indicação terapêutica imediata. A confirmação deste diagnóstico clínico deve se basear em resultados laboratoriais de amostras coletadas antes do início do tratamento, bem como resposta clínica consequente da utilização da medicação recomendada. Medicando de forma consciente e obtendo-se confirmação do diagnóstico clínico associado a eficácia terapêutica é a sequência perfeita para um crescimento profissional e maior índices de acertos futuros.
Tabela 1. Resultados obtidos da detecção de L. intracellularis, B. pilosicoli, B. hyodysenteriae e Salmonella em 541 amostras de fezes pela PCR Multiplex.
Tabela 2. Distribuição de prevalência de acordo com o tamanho do rebanho e do tipo de patógeno.
REFERÊNCIAS.
[1]Baccaro M.R., Moreno A.M., Shinka L.T. & Dotto D.S. 2003. Identification of bacterial agents of enteric disease by multiplex PCR in growing-finishing pigs. Brazilian Journal of Microbiology. 34: 225-229.
[2]Batte E.G., McLamb R.D., Muse K.E., Tally S.D. & Vestal T.J. 1977. Pathophysiology of Swine Trichuriasis. American Journal of Veterinary Research. 38: 1075-1079.
[3]Duhamel G.E. 2005. Efficacy of antimicrobial agents for porcine colonic spirochetosis control. Pig Progress. 1: 6-8.
[4]Fairbrother J.M., Nadeau E. & Gyles C.L. 2005. Escherichia coli in postweaning diarrhea in pigs: an update on bacterial types, pathogenesis, and prevention strategies. Animal Health Research Reviews. 6(1):17-39.
[5]França S.A. & Guedes R.M.C. 2008. Antimicrobianos para o controle da enteropatia proliferativa suína. Ciência Rural. 38(1): 288-296.
[6]Griffith R.W., Schwartz K.J. & Meyerholz D.K. 2006. Salmonella. In: Straw B.E., Zimmerman J.J., D´Allaire S. & Taylor D.J. (Eds). Diseases of swine. 9th ed. Ames: Blackwell Publishing, pp.739-754.
[7]Guedes R.M.C. 2004. Update on epidemiology and diagnosis of porcine proliferative enteropathy. Journal of Swine Health and Production. 12(3):134-138.
[8]Guedes R.M.C., França S.A., Machado G.S., Blumer M.A. & Cruz Jr E.C.C. 2009. Use of tylvalosin-medicated feed to control porcine proliferative enteropathy. Veterinary Record. 165: 342-345
[9]Guedes R.M.C. & Gebhart C.J. 2002. Proliferative enteropathy (Ileitis): learning how to use and interpret diagnostic tests. International Pigletter. 19: 23.
[10]Karlsson M., Fellstrom C., Gunnarsson A., Landen A. & Franklin A. 2003. Antimicrobial susceptibility testing of porcine Brachyspira (Serpulina) species isolates. Journal of Clinical Microbiology. 41: 2596-2604.
[11]Kich J.D. 2007. Salmonelose. In: Sobestiansky J. & Barcellos D.E.S.N. (Eds). Doenças dos Suínos. Goiânia: Canone Editorial, pp.196- 203.
[12]Kroll J.J., Roof M.B. & McOrist S. 2004. Evaluation of protective immunity in pigs following oral administration of an avirulent live vaccine of Lawsonia intracellularis. American Journal of Veterinary Research. 65(5): 559-565.
[13]Letellier A., Messier S., Lessard L. & Quessy S. 2000. Assessment of various treatments to reduce carriage of Salmonella in swine. Canadian Journal of Veterinary Research. 64(1): 27-31.
[14]McOrist S. 2005. Defining the full costs of endemic porcine proliferative enterophaty. Veterinary Journal. 170: 8-9.
[15]Mores N. & Moreno A.M. 2007. Síndrome da diarreia pós-desmame. In: Sobestiansky J. & Barcellos D.E.S.N (Eds). Doenças dos Suínos. Goiânia: Canone Editorial, pp. 203-205.
[16]Polson D.D., Marsh W.E. & Harris D.L. 1992. Financial considerations for individual herd eradication of swine dysentery. In: Proceeding of the 12th Congress of the International Pig Veterinary Society (Den Haag, Netherlands). p.510.
[17]Stege H., Jensen T.K., Môller K., Bækbo P. & Jorsal S.E. 2000. Prevalence of Intestinal Pathogens in Danish Finishing pig Herds. Preventive Veterinary Medicine. 46: 279-292.
[18]Suh D.K. & Song J.C. 2005. Prevalence of L. intracellularis, B. hyodysenteriae, and Salmonella in swine Herds. Journal of Veterinary Science. 6: 289-293.
[19]Viott A.M. 2010. Prevalência de enteropatógenos em suínos de recria/terminação em Minas Gerais e desenvolvimento de modelo experimental de Lawsonia intracellularis em camundongos (Mus musculus).146f. Belo Horizonte, MG. (Doutorado em Ciência Animal) – Escola de Veterinária, Universidade Federal de Minas Gerais.
[20]Walter D., Gebhart C., Kroll J., Holck J.T. & Chittick W. 2004. Serologic profiling and vaccination timing for Lawsonia intracellularis. Journal of Swine Health and Production. 12(6): 310-313.
[21]Wattanaphansak S., Singer R.S. & Gebhart CJ. 2009. In vitro antimicrobial activity against 10 North American and European Lawsonia intracellularis isolates. Veterinary Microbiology. 134(3,4): 305-310.
[22]Weneger H.C. & Bager F. 1997. Pork as a source of human Salmonellosis. In: Proceedings of the 2nd International Symposium on Epidemiology and Control of Salmonella in Pork (Copenhagen, Denmark). pp.3-8.
[23]Wood E.N. & Lysons R.J. 1988. Financial benefit from the eradication of swine dysentery. Veterinary Record. 122(12): 277-279.