INTRODUÇÃO
O ergosterol é o mais importante esterol, constituinte natural das células ou membranas miceliais da grande maioria dos fungos. Os maiores níveis são encontrados nas camadas fosfolipídicas da membrana fúngica (SEITZ et al., 1977; PEACOCK & GOOSEY, 1989) onde desempenha importante função estrutural e hormonal na progressão do ciclo celular (GOAD, 1994). A concentração do ergosterol numa massa fúngica é dependente do estágio de desenvolvimento, e em conseqüência da umidade, temperatura e tempo de crescimento.
O ergosterol é praticamente insolúvel em água, mas apresenta boa solubilidade em solventes orgânicos . Possui boa estabilidade na manipulação laboratorial, principalmente, quando conservado em meio alcalino (GESSNER & SMITT, 1996) e protegido da luz ultravioleta (SCHWADORF & MULLER, 1989). A determinação do ergosterol na biomassa fúngica pode ser realizada por espectrofotometria ultravioleta e infravermelha, associadas a métodos cromatográficos como camada delgada, liquida de alta eficiência (SEITZ et al., 1977; REGNER et al., 1994) e gasosa (EVERSCHED et al., 1988). Conforme SEITZ et al. (1977) e BERGMINGHAM et al. (1995) a quantificação do ergosterol tem sido utilizada como indicador da concentração fúngica em sementes e folhas. WEST et al. (1987) e MARTIN et al. (1990) quantificaram o ergosterol de amostras de solo para estimar a biomassa fúngica.
Métodos microbiológicos como contagem de unidades formadoras de colônias são amplamente empregados para estimar a quantidade de biomassa fúngica presente em sementes e alimentos (PITT, 1984; GOURAMA & BULLERMAN, 1995). Porém, os valores das unidades formadoras não refletem exatamente a biomassa fúngica, mas sim a quantidade de esporos fúngicos produzidos. PITT (1984) constatou que o aumento da contagem de células viáveis provenientes da esporulação pode ser de até 10 vezes maior do que a biomassa fúngica e área de colônias fúngicas inoculadas por um período de 4 dias. Contudo, também possuem a desvantagem de não avaliarem fragmentos de micélios não viáveis como também de ser um método muito laborioso e demorado (SCHNÜRER, 1991).
As aflatoxinas são metabólitos secundários produzidos por fungos toxigênicos dos gêneros Aspergillus, capazes de causar diversos efeitos tóxicos em animais (COULOMBE, 1991). Atualmente são conhecidos 18 compostos pelo termo de aflatoxinas, porém 4 delas conhecidas como aflatoxina, B1, B2, G1 e G2 são de interesse médico-sanitário (COULOMBE, 1991). A aflatoxina B1 é a de maior ocorrência e importância toxicológica. São freqüentemente isoladas em cereais e subprodutos destinados à alimentação humana e animal (RODRIGUEZ-AMAYA & SABINO, 2002). Frente às dualidades e dificuldades para determinar o grau de contaminação fúngica presente em cereais, nosso objetivo é avaliar e comparar as duas metodologias e estabelecer uma correlação entre concentração de colesterol e contagem de unidades formadoras de colônias. Em paralelo investigamos a incidência de aflatoxinas e da microflora dominante nas amostras de milho.
MATERIAL E MÉTODOS
Amostras de milho
Foram utilizadas 40 amostras de milho provenientes de empresas agropecuárias do sul do Brasil, nos meses de julho e agosto de 1998. As amostras eram provenientes de milho destinado para a alimentação de aves e suínos, armazenado por aproximadamente 6 meses em diferentes tipos de silos, porém com ambiente controlado por meio de ventilação forçada. Aproximadamente 1 kg de amostra foi enviado ao laboratório, sendo que foram imediatamente trituradas (tamanho da partícula menor que 0,2 mm) e individualmente estocados a -18° C até serem analisadas.
Preparo dos padrões de ergosterol
A solução de ergosterol (Sigma Chemical, St. Louis, EUA) foi obtida a partir de diluição da amostra original (um grama em 100 mL de etanol absoluto) obtendo concentração inicial de 10 mg/mL. A partir desta foram realizadas diluições sucessivas no mesmo solvente para obtenção de amostra utilizada como padrão de rotina (4,0 mg/mL).
Quantificação do ergosterol contido nas amostras
Extração do ergosterol
O procedimento de extração foi realizado conforme a técnica preconizada por YOUNG (1995) com algumas modificações. Adicionaram-se 2 mL de metanol e 500 mL de hidróxido de sódio (2 M) a 250 mg de amostra de milho triturado. A solução foi submetida à irradiação em forno de microondas (1,5 KWh) a 50% da potência (20 e 15 segundos, com 10 minutos de intervalo). O resfriamento da amostra foi realizado a temperatura ambiente por um período de 15 minutos.
Em seguida o pH foi neutralizado pela adição de 850 mL de ácido clorídrico 1 M. Juntaram-se mais 2 mL de metanol para proceder a extração final. Esta foi realizada em triplicata, empregando 3 mL de pentano por vez, sob agitação por 5 segundos. O extrato recuperado foi juntado e evaporado com fluxo de ar quente (60° C) e estocado a -18° C até a quantificação do ergosterol.
Quantificação cromatográfica do ergosterol
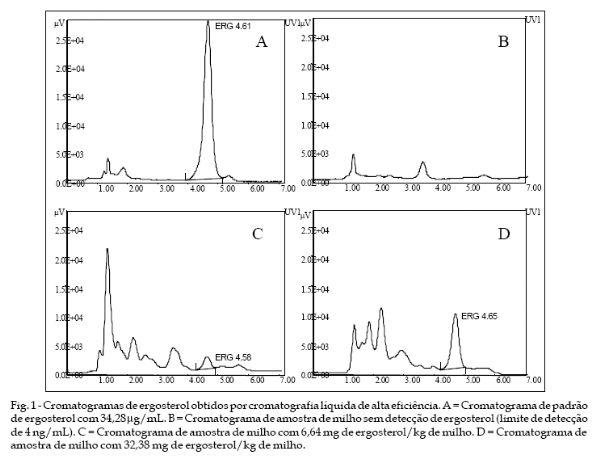
O ergosterol foi analisado por cromatografia líquida de alta eficiência (CLAE) utilizando metodologia adaptada das técnicas preconizadas por MILLER et al. (1983), NAEWBANIJ et al. (1984) e SCHNÜRER (1991). O extrato purificado foi resuspendido em 500 mL de metanol, sendo 20 mL injetados no sistema cromatográfico. A quantificação foi realizada através de HPLC (GBC, Scientific Equipment Pty, Victoria, Austrália) utilizando metanol como fase móvel a um fluxo de 1 mL/minuto por uma coluna cromatográfica Lichrospher RP18 5 mm, 125 x 4,6 mm (Merck, Darmstadt, Alemanha). A coluna foi acoplada a uma pré-coluna e mantida a uma temperatura constante de 45°C. O ergosterol foi identificado com detector de ultravioleta com comprimento de ondas fixado em 330 nanômetros. O tempo de retenção cromatográfica do ergosterol foi de aproximadamente 4,6 minutos. A quantificação foi realizada através da medida da área do pico correspondente ao ergosterol contido na amostra, comparado com a área do pico correspondente ao padrão de ergosterol.
A recuperação do método foi testada em triplicata, com 4 níveis de ergosterol (1,7 - 13,6 mg de ergosterol por grama de milho) analisado conforme metodologia descrita. A recuperação média foi de 99,6%. O limite de quantificação foi estipulado através de diluições e análises sucessivas de ergosterol. A menor concentração detectada em triplicata, cujos picos apresentaram oscilações a partir da linha de base na razão de 5:1 foi tida como limite de quantificação, que correspondeu a 0,11 mg/g. As amostras que apresentaram concentrações de ergosterol superiores a 13,6 mg/g de milho foram diluídas e novamente analisadas.
Metodologia da avaliação das unidades formadoras de colônias.
As contagens das unidades formadoras de colônias fúngicas (UFC) foram realizadas a partir de amostras do milho triturado (tamanho das partículas menores que 0,2 mm) conforme metodologia adotada por SWANSON et al. (1992). A uma alíquota de 10 g foram adicionados 90 mL de solução de trabalho estéril (1 gota de tween 80 em 1 L de água destilada mais 1,25 mL de solução (34 g de fosfato de potássio em 1 L de água sendo pH corrigido para 7,2). O conteúdo foi agitado por um período de 15 minutos. Alíquota de 1 mL de cada diluição foi colocada com 9 mL de solução de trabalho e agitado por 30 segundos. Em seguida, diluições sucessivas até 10-5 foram realizadas. Semearam-se 0,1 mL de cada diluição, com auxílio de alça de platina, em placas de Petri contendo 20 mL de DRBC (GOURAMA & BULLERMAN, 1995). O cultivo foi incubado em estufa a temperatura constante de 25°C por um período de 7 dias e observadas diariamente. As placas que apresentavam entre 15 e 150 colônias foram utilizadas para estudar a contagem, sendo o resultado expresso em unidades formadoras de colônias por grama de amostra (MISLEVIC et al., 1992). As colônias fúngicas foram identificadas e classificadas por gênero (RAPER & FENNELL, 1965; NELSON et al., 1983; SAMSON & PITT, 1985).
Análise da aflatoxina
A análise da aflatoxina foi realizada em amostra de milho previamente triturado (tamanho das partículas menores que 0,2 mm), juntando-se 50 g desta com 270 mL de metanol mais 30 mL de cloreto de potássio a 4%. A extração foi realizada sob liquefação em Blender por um período de 5 minutos e passado em papel filtro Watman número 4. Alíquota de 150 mL foi adicionada à mesma quantidade de sulfato de amônia a 30% mais 20 g de celite. A solução foi homogeneizada e novamente passada em papel filtro Watman número 4. Juntouse uma alíquota de 150 mL a mesma quantidade de água deionizada. Adicionaram-se, em duplicata, 10 mL de clorofórmio por vez, agitou-se por 3 minutos e após 15 minutos de decantação coletaram-se 5 mL. Em seguida as duas frações de clorofórmio foram juntadas e evaporadas com fluxo de ar. As amostras foram estocadas a -18° C até a análise. A quantificação foi realizada por cromatografia em camada delgada conforme metodologia preconizada por SOARES & RODRIGUES-AMAYA (1989).
Avaliações estatísticas
As avaliações dos resultados experimentais obtidos foram realizadas empregando-se a estatística descritiva (média, desvio padrão). Os coeficientes de correlação (p < 0,01) foram determinados por regressão simples. Os dados foram analisados empregando programa estatístico Statgraphics versão 3.0, 1997 (Startgraphics Manugistics, Rockville, EUA).
RESULTADOS E DISCUSSÃO
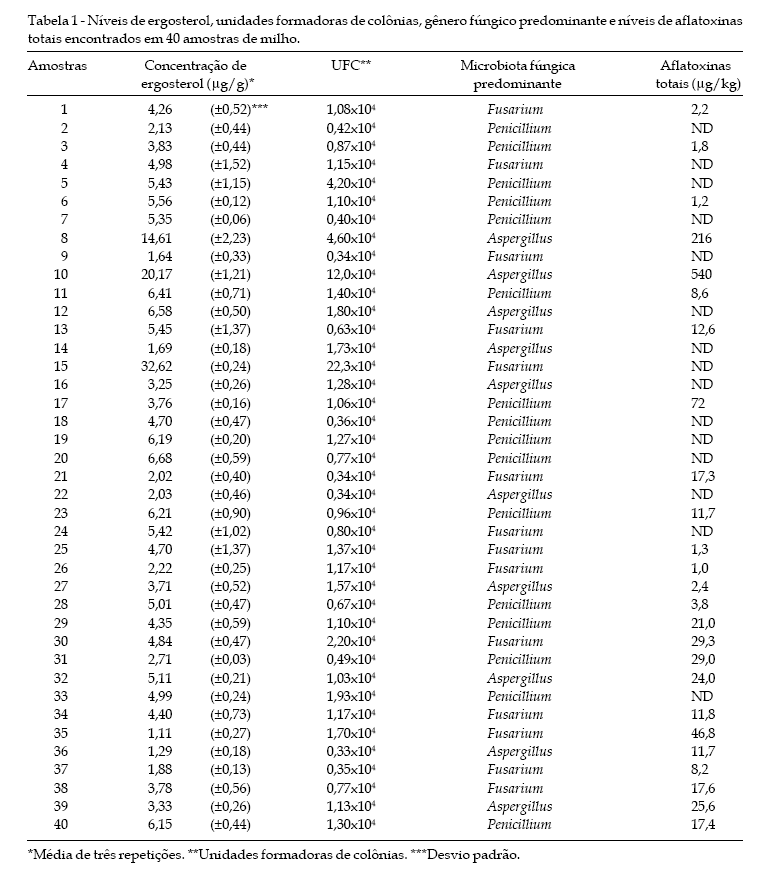
Os níveis de ergosterol obtidos da análise por cromatografia líquida de alta eficiência (Fig. 1) de 40 amostras de milho, naturalmente contaminadas, variaram de 1,11 a 32,62 mg/kg, apresentando uma média geral superior a 5,5 mg/kg (Tabela 1). Apenas 3 amostras apresentaram índices de contaminação maiores de 8 mg/kg, indicativo de intenso desenvolvimento fúngico e qualidade duvidosa do cereal, conforme conclusões de PIVA et al. (1998). A concentração média de ergosterol nos grãos de milho indica importante desenvolvimento fúngico na maioria das amostras, pois conforme SEITZ & POMERANZ (1983), grãos de milho saudáveis possuem geralmente concentrações de ergosterol inferiores a 3 mg/kg. A concentração máxima de ergosterol encontrada em amostra de milho no presente trabalho, em todos os casos não atingiu limites máximos detectados por YOUNG (1995) (92,9 mg/kg) e SEITZ et al. (1977) (200 mg/kg) em grãos de milho severamente afetados. Obteve-se concentrações moderadas, similares as de SEITZ et al. (1982), que encontraram níveis máximos de 44 mg/ kg. Concentrações de 9,4 a 10,0 mg/kg foram obtidas por CAHAGNIER et al. (1983) e de 13,98 mg/kg foram detectados por NAEWBANIJ et al. (1984). SCHWABE et al. (1992), citam uma variação de 0,6 a 56,0 mg/kg em diversos cereais e uma média de 3,3 mg/kg em milho, inferior ao nível médio registrado em nosso estudo.
Analisando 34 amostras deste cereal, SCHUH & AWADMASALMEH (1992) determinaram níveis de 1,0 a 48,0 mg/kg, com média de 3,0 mg/kg de ergosterol e 1 x 105 unidades formadoras de colônias/g de milho, com a presença de Aspergillus, Fusarium, Penicillium e Cladosporium.
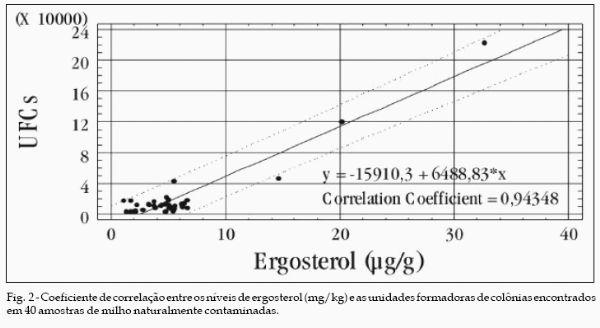
A correlação entre a concentração de ergosterol e unidades formadoras de colônias fúngicas nas amostras de milho apresentaram uma correlação de 0,94 (P < 0,01) (Fig. 2). Conforme CAHAGNIER et al. (1983) esta é uma correlação muito boa sendo também compatível com as concentrações encontradas por estes pesquisadores.
Concluíram em seus estudos que a correlação pode variar de acordo com os cereais analisados, sendo de aproximadamente 0,91 para o milho e de 0,99 para o arroz com umidade relativa do ar acima de 80%. MILLER et al. (1983) e SCHWABE et al. (1992), também encontraram altas correlações entre estas duas medidas da contaminação fúngica. No entanto SCHNÜRER (1991), SCHUH & AWAD-MASALMEH (1992) e SCHNÜRER (1993) alertam que uma significativa correlação entre ergosterol e contagens fúngicas poderá não ser encontrada.
Isto poderia ser creditado à mudanças fisiológicas e autólise micelial parcial que podem afetar drasticamente o conteúdo de ergosterol da massa micelial residual. Conforme BÖRJESSON et al. (1992), em determinado estágio de crescimento fúngico e a variação das unidades formadoras de colônias fúngicas entre as diferentes espécies a concentração de ergosterol pode não aumentar na mesma proporção, o que não foi verificado no presente experimento.
Das 40 amostras analisadas, 25 (62,5%) apresentaram aflatoxinas, com concentrações variando de 1 (limite de quantificação) até 540 mg/kg (Tabela 1). Os níveis encontrados são relativamente baixos, apesar da porcentagem das amostras contaminadas ser bastante alta. Com relação a presença de aflatoxinas em alimentos destinados ao consumo animal, o Ministério da Agricultura estabeleceu limite máximo de 50 μg/kg (BRASIL, 1988). Das amostras analisadas em nosso experimento, somente 3 (7,5%) apresentaram concentrações das toxinas superiores ao limite máximo tolerado. A correlação (P < 0,01) entre a concentração de ergosterol e presença de aflatoxinas nas amostras de milho foi relativamente baixa, ficando em torno de r = 0,4, indicando que a quantidade de aflatoxinas presente nas amostras não depende significativamente da concentração de massa fúngica presente.
CONCLUSÕES
A concentração de ergosterol detectada por cromatografia líquida de alta eficiência, em 40 amostras de milho variou de 1,11 até 32,62 mg/kg, apresentando média de 5,5 mg/kg. A correlação entre concentração de ergosterol e unidades formadoras de colônias fúngicas é alta (r = 0,94), indicando boa equivalência entre as técnicas para a avaliação do grau de contaminação fúngica em milho.
A correlação entre presença de aflatoxinas e concentração de ergosterol apresentou-se bastante baixa, apresentando um r = 0,4%.
REFERÊNCIAS BIBLIOGRÁFICAS
ALMEIDA, A.P.; O RSI, R.B.; CORRÊA, B.; M ALLOZZI, M.; SAWAZAKI, E.; DUARTE, A.P.; SORDI, G.; CASTRO, J.L.; BORTOBELETTO, N. Microbiota fúngica de três híbridos de milho recémcolhidos. In: SEMINÁRIO SOBRE A CULTURA DO MILHO "SAFRINHA", 3., 1995, Assis, SP. Anais. Assis: Instituto Agronômico, 1995. p.123-128.
BERMINGHAM, S.; MALBY, L.; COOKE, R.C.A. A critical assessment of the vality of ergosterol as an indicator of fungal biomass. Mycol. Research., v.99, n.4, p.479-484, 1995.
BÖRJESSON, T.; S TÖLLMAN, U.; S CHNÜRER, J. Volatile metabolites produced by six fungal species compared with other indicators of fungal growth on cereal grains. Appl. Environm. Microbiol., v.58, n.8, p.2599-2605, 1992.
BRASIL - Leis e decretos. Ministério da Agricultura. Portaria n. 7 de 9 de novembro de 1988, Diário Oficial da União, Brasília, de 9 de novembro de 1988, Seção I, p.21.968.
CAHAGNIER, B.; RICHARD-MOLARD, D.; POISSON, J. Évolution de la teneur en ergostérol des grains au cours de la conservation-une possibilité d´évaluation quantitative et rapide de leur mycoflore. Sci. Alim., v.3, n.2, p.219- 244, 1983.
COULOMBE, R.A. Aflatoxins. In: SHARMA, R.P. & SALUNKHE, D.K. (Eds.), Mycotoxins and phycotoxins. Boca Raton: CRC Press, 1991. p.103-144.
EVERSHED, R.P.; SPOONER, N.; PRESCOTT, M.C.; G OAD, L.J. Isolation and characterisation of intact steryl ferulates from seeds. J. Chromatogr., v.440, p.23-35, 1988.
GESSNER, M.O. & S CHIMITT, A.L. Use of solid-phase extraction to determine ergosterol concentrations in plant tissue colonized by fungi. Appl. Environm. Microbiol., v.62, n.2, p.415-419, 1996.
GOAD, L.J. The effects of antifungal compounds on growth and sterol metabolism in plants and protozoa. Biochem. Soc. Trans., v.22, p. 269-635, 1994.
GOURAMA, H. & BULLERMAN, L.B. Relationship between aflatoxin production and mold growth as measured by ergosterol and plate count. Lebensm. Wiss. - Technol., v.28, n.2, p.185-189, 1995.
INTERNATIONAL COMISSION ON MICROBIOLOGICAL SPECIFICATIONS FOR FOODS. Microbiological ecology of foods. New York: American Public Health Association, 1984. 914p.
MARTIN, F.; DELARUELLE, C.; HILBERT, J.L. An improved ergosterol assay to estimate fungal biomass in ectomyrrhizas. Mycol. Research, v.94, n.8, p.1059-1064, 1990.
MILLER, J.D.; YOUNG, J.C.; TRENHOLM, H.L. Fusarium toxins in field corn. I. Time course of fungal growth and production of deoxynivalenol and other mycotoxins. Can. J. Bot., v.61, p.3080-3087, 1983.
MISLEVIC, P.B.; BEUCHAT, L.R.; COUSIN, M.A. Yeast and Molds. In Compendium of methods for the microbiological examination of foods. In: VANDERZANT, C. & SPLITTOESSER, D.S. (Eds.). New York: American Public Health Association, 1992.
NAEWBANIJ, M.; SEIB, P.A.; BURROUGHS, R. Determination of ergosterol using thin-layer chromatography and ultraviolet spectroscopy. Cereal Chem., v.61, n.5, p.385- 388, 1984.
NELSON, P.E.; TOUSSON, T.A.; MARASAS, W.O.F. Fusarium species. An illustrated manual for identification. London: The Pensylvania State University Press, 1983.
PEACOCK, G.A & GOOSEY, M.W. Separation of fungal sterols by normal-phase hingh performance liquid chromatography-application to the evaluation of ergosterol biosynthesis inhibitors. J. Chromatogr., v.469, p.293-303, 1989.
PITT, J.I. The significance of potentially toxigenic fungi in foods. Food Technol. Austrália, v.36, n.5, p.218-219, 1984.
PIVA, G.; PIETRI, A.; PALLARONI, L. Micotoxin contamination of maize harvested in Northern Italy. In: SIMPÓSIO: FROM QUALITY FEED TO QUALITY FOOD. VENUE: UNIVERSITY OF VETERINARY MEDICINE, 1998, Vienna, Áustria. Proceedings. Vienna: Biomin Gesunde Tierernährung International, 1998. p.49.
RAPER, K.B. & FENNELL, D.I. The genus Aspergillus. Baltimore: Willians & Willkins, 1965.
REGNÉR, S.; SCHNÜRER, J.; JONSSON, A. Ergosterol content in relation to grain kernel weight. Cereal Chem., v.71, n.1, p.55-58, 1994.
RODRIGUEZ-AMAYA, D.B. & SABINO, M. Mycotoxin research in Brazil: the last decade in review. Braz. J. Microbiol., v.33, n.1, p.1-11, 2002.
SAMSON, R.A. & PITT, J.I. Advances in Penicillium and Aspergillus Systematics. New York: Plenum Press, 1985. (Nato ASI Series, 102) SCHNÜRER, J. Comparison of methods for estimating the biomass of three food-borne fungi with different growth patterns. Appl. Environm. Microbiol., v.59, n.2, p.552-555, 1993.
SCHNÜRER, J. Distribution of fungal biomass among fine bran, coarse bran, and flour from wheat stored at four different moisture levels. Cereal Chem., v.68, n.4, p.434- 437, 1991.
SCHUH, M., & AWAD-MASALMEH, M. Investigations on the incidence of deoxynivalenol, zearalenone, microbial status and ergosterol content in feed stuffs. In: CONGRESS OF THE PIG VETERINARY SOCIETY. 12., 1992, Viena, Áustria. Anais. Viena: International Pig Veterinary Society, 1992, p.666.
SCHWABE, M.; KAMPHUIS, H.; TRÜMNER, U. Comparison of the latex agglutination test and the ergosterol assay for the detection of moulds in foods and feedstuffs. Food Agric. Imnunol., v.4, p.19-25, 1992.
SCHWADORF, K. & MÜLLER, H.M. Determination of ergosterol in cereals, mixed feed components, and mixed feeds by liquid chromatography. J. Assoc Anal. Chem., v.72, n.3, p.457-462, 1989.
SEITZ, L. M.; MOHR, H. E.; BURROUGHS, R. Ergosterol as an indicator of fungal invasion in grains. Cereal Chem., v.54, n.6, p.1207-1217, 1977.
SEITZ, L.M. & POMERANZ, Y. Ergosterol, Ergosta-4, 6, 8 (14), 22-tetraen-3-one, ERG Peroxide, and chitin in ergoty barley, rye, and other grasses. J. Agric. Food Chem., v.31, n.5, p. 1036-1038, 1983.
SEITZ, L.M.; SAUER, D.B.; MOHR, H.E. Storage of high-moisture corn: fungal growth and dry matter loss. Cereal Chem., v.59, n.2, p.100-105, 1982.
SOARES, L.M.V. & RODRIGUES-AMAYA, D.B. Survey of aflatoxins, ochratoxin A, zearalenone, and sterigmatocystin in some brasilian foods by using multi-toxin Thin- ayer Chromatographic method. J. Assoc. Anal. Chem., v.72, n.1, p.22-26, 1989.
SWANSON, K.M.J.; BUSTA, F.F.; PETERSON, E.H.; JOHNSON, M.G. Colony count methods. In: VANDERZANT, C. & SPLITTSTOESSER, D.F. (Eds). Compendium of methods for the microbiological examination of foods. Washington: American Public Health Association, 1992 p.75-96.
WEST, A.W.; GRANT, W.D.; SPARLING, G.P. Use of ergosterol, diaminopimelic acid and glucosamine contents of soils to monitor changes in microbial populations. SoilBiol. Biochem., v.19, n.5, p.607-612, 1987.
YOUNG, J.C. Microwave-assisted extraction of the fungal metabolite ergosterol and total fatty acids. J. Agric. Food Chem., v.43, n.11, p.2904-2910, 1995.