Biossíntese Terpenóides Lippia
Variabilidade sazonal e biossíntese de terpenóides presentes no óleo essencial de Lippia alba (Mill.) n. e. brown (Verbenaceae)
Publicado: 27 de junho de 2012
Por: Francisco Maikon corrêa de barros; eduardo de oliveira zambarda; berta Maria Heinzmann; carlos augusto Mallmann
INTRODUÇÃO.
Lippia alba (Mill.) N. E. Brown (Verbenaceae) é uma planta medicinal nativa da América do Sul, conhecida popularmente como falsa-melissa. Infusões, banhos e xaropes, preparados com suas fo-lhas ou raízes, são utilizados na medicina popular para o tratamento de distúrbios estomacais, afecções das vias respiratórias, no combate à hipertensão e como sedativo.
Entre os metabólitos secundários descritos para L. alba en-contram-se flavonóides, taninos, iridóides, saponinas triterpênicas, resinas, mucilagens e óleo essencial.
Variações qualitativas e quantitativas dos principais componentes do óleo essencial desta espécie têm levado a sua separação em qui-miotipos ou raças químicas: citral, carvona, linalol – 1,8-cineol, entre outros. Adicionalmente, a influência de fatores abióticos como luz, temperatura, água, solo e altitude sobre a biossíntese de certos constituintes vegetais, especialmente os terpenóides, foi comprovada em diferentes espécies vegetais. A variabilidade na composição do óleo essencial das folhas de L. alba foi demonstrada anteriormente em função das diferentes regiões do ramo vegetal, das épocas e horários de coleta, bem como da metodologia empregada na sua extração. No entanto, até o momento, não há trabalhos publicados interligando, por meio de dados meteorológicos, as variações observadas aos fatores abióticos.
O presente trabalho teve como objetivo avaliar a variação do teor e da composição química do óleo essencial das folhas de L. alba, provenientes de cultivo e coletadas nas diferentes estações do ano, relacionando as variações observadas com dados meteorológicos de temperatura, insolação, umidade relativa e chuva acumulada. As possíveis rotas biossintéticas para os mono e sesquiterpenóides presentes no óleo essencial também são discutidas.
PARTE EXPERIMENTAL
Material vegetal
Para a realização dos experimentos foram utilizadas as folhas de Lippia alba (Mill.) N. E. Brown (Verbenaceae), quimiotipo linalol-1,8-cineol, provenientes de cultivo no Horto da Prefeitura Municipal de São Luiz Gonzaga, RS, Brasil. As coletas foram realizadas no período médio de cada estação (janeiro, abril, julho e outubro) du-rante o ano de 2005. A espécie foi identificada pelo botânico G. D. Zanetti, do Departamento de Farmácia Industrial da UFSM. Material testemunha encontra-se depositado no Herbário do Departamento de Biologia da UFSM, sob o registro SMDB nº 10.050.
Extração e análise do óleo essencial
O óleo essencial foi extraído a partir do material vegetal fresco, submetido à hidrodestilação em aparelho clevenger por 2 h, conforme a metodologia descrita na Farmacopéia Brasileira. O rendimento das extrações foi calculado com base na relação entre volume e peso, e expresso em porcentagem (% v/p).
A análise do óleo essencial foi realizada por cromatografia ga-sosa acoplada à espectrometria de massas (CG/EM) em um sistema hifenado Agilent 6890, equipado com um detector seletivo de massas série 5973. Parâmetros de análise: split inlet 1:100; gás carreador: He (1 mL/min); coluna capilar de sílica fundida HP5-MS (Hewlett Packard, 5% fenilmetilsiloxano, 30 m x 0,25 mm, espessura do filme: 0,25 µm); programa de análise: 40 ºC (Ti) por 4 min, 40-260 ºC, 4 ºC/ min; temperatura do injetor: 220 ºC; temperatura da interface: 250 °C; energia de ionização: 70 eV; banco de dados: NIST, 1998.
Os componentes do óleo essencial foram identificados com base no índice de retenção (IR), determinados através da utilização de uma curva de calibração de uma série homóloga de n-alcanos (C8-C32) injetados nas mesmas condições cromatográficas das amostras e nos modelos de fragmentação dos espectros de massas, sendo ambos comparados com dados da literatura.
A concentração dos constituintes foi calculada através da área integral de seus respectivos picos, relacionada com a área total de todos os constituintes da amostra, obtida pela análise utilizando o cromatógrafo gasoso (Tabela 2).
Levantamento dos dados meteorológicos
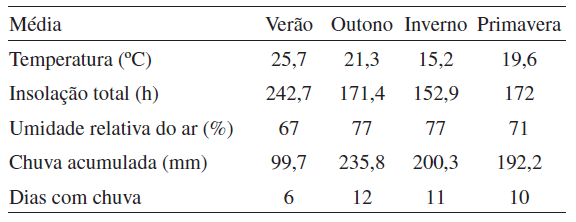
Os dados meteorológicos de temperatura, insolação, umidade relativa do ar e índice pluviométrico foram obtidos a partir dos registros do Instituto Nacional de Meteorologia (INMET), o qual mantém uma estação de observação na cidade de São Luiz Gonzaga. Os dados foram tabulados e utilizados, para fins de comparação, com as variações quantitativas e qualitativas observadas para o óleo essencial de L. alba.
RESULTADOS E DISCUSSÃO
O rendimento do óleo essencial obtido nas diferentes extrações foi de 0,67% em janeiro (verão), 0,60% em abril (outono), 0,33% em julho (inverno) e 0,40% em outubro (primavera) (Figura 1). Os resultados encontram-se de acordo com os dados publicados na lite-ratura, que mostram variações de rendimento para o óleo essencial de L. alba na ordem de 0,1-1,0%, bem como a influência das diferentes épocas de coleta sobre os teores. Dessa forma, no verão ocorrem os maiores teores de óleo essencial, os quais decaem no outono até atingir valores mínimos no inverno. A partir deste ponto, os teores voltam a crescer em direção à primavera e ao verão.
Figura 1. Perfil quantitativo do óleo essencial das folhas de Lippia alba (Mill.) N. E. Brown coletada em São Luiz Gonzaga, RS, Brasil, nas diferentes estações de 2005
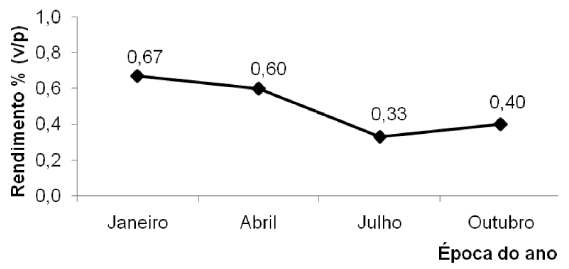
A correlação dos resultados apresentados na Figura 1 com os dados meteorológicos (Tabela 1) permite aferir que a combinação de fatores típicos à estação do verão no sul do país (altas temperaturas, longos períodos de insolação, baixos índices de umidade relativa do ar e de precipitação) favorece o aumento da produção de óleo essencial. No inverno, por sua vez, sob condições de baixas temperaturas, curtos períodos de insolação e elevados índices de umidade relativa do ar e de precipitação, ocorre diminuição dos teores. Resultados semelhantes foram obtidos para L. alba quimiotipo citral – limoneno coletada no Ceará, porém em épocas distintas, onde uma estação chuvosa, popularmente conhecida como inverno (janeiro – junho), e outra seca, denominada de verão (julho – dezembro), são bem definidas na região. As estações de transição, outono e primavera (Figura 1), com características mistas entre as duas outras estações do ano (Tabela 1), refletem também teores intermediários de óleo essencial.
Segundo Tavares et al., os teores de óleo essencial em L. alba podem variar em função do seu ciclo fenológico, sendo que para esta espécie a maior produção de óleo ocorre fora do período de floração. Entretanto, as evidências apontam que as condições climá-ticas também constituem um forte fator de influência. Para L. alba coletada em Caxias do Sul - RS, os rendimentos do óleo extraído (0,10-0,37%) ficaram abaixo daqueles encontrados em São Luiz Gonzaga (0,33-0,67%). Caxias do Sul – RS apresenta, reconhecida-mente, temperaturas médias mais baixas, quando comparadas àquelas de São Luiz Gonzaga (Tabela 1), sendo este um dos prováveis fatores que corroboram com as diferenças de rendimento observadas.
Tabela 1. Dados meteorológicos das quatro estações do ano de 2005 em São Luiz Gonzaga
Os componentes dos óleos essenciais de L. alba obtidos das fo-lhas coletadas nas quatro estações do ano de 2005 são apresentados na Tabela 2. Ao todo foram identificados 42 constituintes. Os óleos analisados são compostos basicamente por mono e sesquiterpenóides. Linalol e 1,8-cineol foram os constituintes majoritários em todas as estações do ano, indicando o quimiotipo da espécie na população de plantas estudada. Percentagens semelhantes de linalol (50,0-79,2%) e 1,8-cineol (7,3-14,1%) foram encontradas para os óleos essenciais obtidos das folhas de L. alba coletadas em Caxias do Sul. O tercei-ro constituinte em maior proporção varia de acordo com a estação da coleta, consistindo do germacreno D (verão e primavera) ou da cânfora (outono e inverno) (Tabela 2).
A porcentagem relativa de monoterpenóides hidrocarbonados variou na faixa de 1,7-4,0%, enquanto que, no caso dos monoterpe-nóides oxigenados, a variação foi de 68,4-81,0%. Já para os sesqui-terpenóides hidrocarbonados, a concentração variou de 3,9-20,8%, enquanto que os sesquiterpenóides oxigenados se apresentaram em porcentagens que variaram de 2,4 a 6,5%.
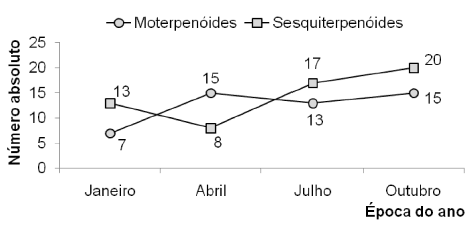
Os resultados indicam que a sazonalidade afeta de maneira distinta a biossíntese do número de estruturas das duas principais classes de terpenóides presentes no óleo essencial de L. alba (Figura 2). Enquanto que, em janeiro, foi observado o predomínio de estruturas sesquiterpe-noídicas com relação às monoterpenoídicas, em abril prevaleceram os constituintes de estrutura monoterpenoídica. Já nos meses de julho e outubro o número de sesquiterpenóides voltou a predominar.
Uma projeção gráfica mostra, nas proximidades de fevereiro e junho, pelo menos dois momentos em que o número de mono e sesquiterpenóides seriam provavelmente equivalentes. Os dados demonstram que, ao longo do ano, a diversidade química dos constituintes aumentou gradativamente, sendo 20 em janeiro, 23 em abril, 30 em julho e 35 em outubro (Tabela 2, Figura 2). Este aumento pode ser atribuído à versatilidade catalítica das enzimas terpeno-sintetases, que freqüentemente produzem múltiplos produtos a partir de um único substrato. Coincidentemente, a estação em que ocorre a maior diversidade química no óleo essencial (primavera) também corresponde ao período de maior floração observado para esta espécie (Figura 2).
Cabe ressaltar que nem sempre o favorecimento na produção de uma determinada classe química, mono ou sesquiterpenóide, vem acompanhada do aumento da porcentagem relativa de seus cons-tituintes individuais. É o caso do linalol, um monoterpenóide que, do verão para o inverno, tem sua porcentagem relativa diminuída (Tabela 2), enquanto que ocorre um aumento do número absoluto dos constituintes de estrutura monoterpenóide ou este permanece praticamente constante. (Figura 2). Algumas hipóteses poderiam justificar essas observações. Entre elas encontra-se o fato de que as plantas, através de mecanismos de controle da rota biossintética, favorecem a produção de determinados constituintes, dependendo de suas necessidades.
Tabela 2. Constituintes químicos do óleo essencial de Lippia alba (Mill.) N. E. Brown nas quatro estações do ano de 2005
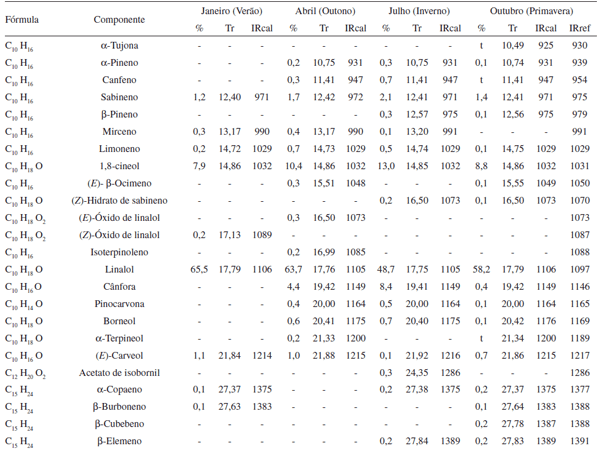
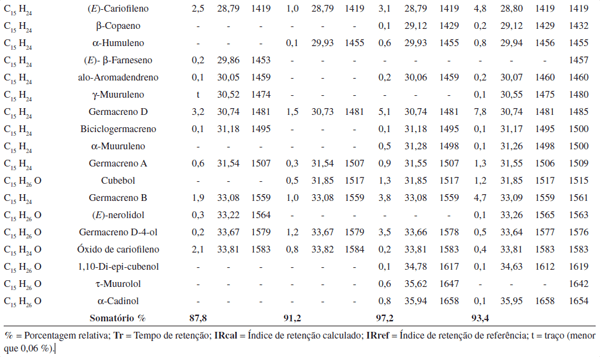
Figura 2. Variabilidade sazonal das principais classes constituintes do óleo essencial das folhas de Lippia alba (Mill.) N. E. Brown coletadas em São Luiz Gonzaga, RS, Brasil, em 2005
Os terpenóides, em especial mono e sesquiterpenóides, apresen-tam diversas funções nos vegetais. As mais conhecidas dizem respeito aos efeitos de proteção contra herbívoros e agentes microbianos, bem como atração de polinizadores. Outras funções, ainda pouco estabe-lecidas para a maioria dos derivados isoprênicos, envolvem efeitos de termo-proteção, proteção a danos oxidativos, foto-respiração a altas temperaturas e baixas concentrações de O2, alelopatia e foto-proteção. De acordo com Bouvier et al., o β-ocimeno parece ter um papel chave na defesa contra herbívoros, resistência a patógenos e tolerância a altas temperaturas. Este monoterpenóide foi identificado no óleo essencial obtido das folhas coletadas em abril (outono) e em outubro (primavera) (Tabela 2). Segundo Schnee et al., o (E)-β-farneseno, encontrado no óleo de L. alba extraído no verão, também atuaria em processos de defesa ao ataque de herbívoros.
As condições climáticas podem beneficiar a biossíntese de um constituinte terpenoídico por uma espécie vegetal, através do favoreci-mento de sua atividade enzimática. Para a terpeno-sintetase denominada TPS1, isolada e expressa em Escherichia coli, a qual produziu linalol, entre outros constituintes, determinou-se que a temperatura ótima de reação está entre 30 e 37 ºC. Portanto, o fato da temperatura ser um fator importante para a atividade enzimática, e esta ser uma variável da sazonalidade, pode justificar o aumento do rendimento de óleo essencial, bem como da produção de certos constituintes, em épocas do ano que apresentem temperaturas mais elevadas.
Há pelo menos duas vias envolvidas na biossíntese dos terpe-nóides: uma via citosólica ou rota do mevalonato (MVA) e outra plastidial ou rota do 5-fosfato de 1-desoxi-D-xilulose (DXP). Ambas conduzem à produção de isômeros do isopreno, o difosfato de isopentenila (IPP) e/ou o difosfato de gama, gama-dimetilalila (DMAPP), os quais constituem os monômeros a partir dos quais se originarão os diferentes terpenóides. A partir da condensação de uma molécula de IPP com DMAPP forma-se o difosfato de geranila (GPP), precursor dos monoterpenóides. A condensação de uma nova molécula de IPP e do GPP leva ao precursor dos sesquiterpenóides, difosfato de farnesila (FPP). A possível rota biossintética dos principais mono e sesquiterpenóides encontrados no óleo essen-cial de L. alba é apresentada no Esquema 1, elaborado com base nos dados disponíveis na literatura. Da mesma forma que ocorre com os produtos intermediários, os compostos finais das rotas biossintéticas são apresentados em estruturas planas, uma vez que a metodologia empregada para a análise do óleo essencial não permite a determinação da configuração absoluta dos constituintes. Entretanto, geralmente ocorre simetria nos mecanismos de reação, o que possibilita a formação dos diferentes enantiômeros por meio de rotas paralelas. A numeração dos carbonos mencionados nesta discussão é relativa ao GPP e FPP.
A biossíntese dos monoterpenóides (Esquema 1) tem início com a ionização do difosfato de geranila (GPP) [1]. A desprotonação do C4 do cátion linalílico [2], resultante desta ionização, leva à obtenção do E-β-ocimeno [3]. Sua hidratação, por sua vez, dá origem ao linalol [4]. Uma proposta para a biossíntese do óxido de linalol [6] con-siste na hidroxilação do linalol [4] pela ação das enzimas do citocromo P-450 via intermediário 6,7 epóxido de linalol [5].38,39 Além desta, foi demonstrado que a auto-oxidação do linalol [4], pela sua exposição ao oxigênio do ar, também conduz ao óxido de linalol [6].
A isomerização do GPP [1], obtida com a migração do gru-pamento difosfato do C1 para o C3, resulta no difosfato linalílico (LPP) [7]. A subseqüente rotação da ligação C2-C3 e ionização resultam no isômero do cátion linalíco [2´], que difere do primeiro por apresentar características espaciais favoráveis à ciclização molecular. Desta forma, além de formar o β-mirceno [8] pela perda de próton no C10, a ciclização do isômero do cátion linalílico [2´], entre C1 e C6, conduz ao cátion α-terpinílico [9], um intermediário chave da biossíntese dos monoterpenóides cíclicos (Esquema 1).
A desprotonação do C8 do cátion α-terpinílico [9] favorece a produção do limoneno [10],14,20 cuja hidroxilação por enzimas do citocromo P-450 origina o E-carveol [11]. Quando a saída do próton ocorre no C6, forma-se o terpinoleno [13] que, por iso-merização, passaria a isoterpinoleno [14]. Muitos terpenóides são produtos diretos das enzimas terpeno-sintetases, enquanto outros são obtidos após transformações secundárias, o que parece ser o caso do isoterpinoleno [14]. A literatura também descreve sua formação mediante a biotransformação do isolimoneno [12] pela bactéria desnitrificante Alcaligenes defragans a qual, entre outros, utiliza limoneno [10] como substrato. Embora não exista a comprovação desta rota em vegetais, em L. alba o limoneno [10] ocorre em maior quantidade no mês de abril, que também é o único mês em que foi identificado o isoterpinoleno [14] (Tabela 2). Entretanto, em função da escassa literatura sobre este aspecto, não se pode descartar a pos-sibilidade do isoterpinoleno [14] ser formado por outra via, como a partir do terpinoleno [13], já demonstrada através de isomerização físico-química44 (Esquema 1).
Via cátion α-terpinílico [9], a biossíntese dos constituintes α-tujona [15], sabineno [16] e Z-hidrato de sabineno [17] inicia com a migração de hidreto do C6 para o C7 e segue com o ataque eletrofílico do C6 aos elétrons dupla ligação entre C2-C3, para formar um intermediário bicíclico de carga positiva no C3. A partir deste, a desprotonação do C4 ou C10 leva a formação, respectivamente, de α-tujona [15] e/ou sabineno [16]. Já a hidratação explica a formação do Z-hidrato de sabineno [17] (Esquema 1).
A hidratação do cátion α-terpinílico [9] gera o α-terpineol [18] o qual, por heterociclização, produz o 1,8-cineol [19] (Esquema 1).
A ciclização eletrofílica do cátion α-terpinílico [9] gera os cátions pinílico [20] e bornílico [25]. A desprotonação do cátion pinílico [20] no C4 e/ou C10 conduz, respectivamente, ao α-pineno [21] e/ou β-pineno [22]. As ações das enzimas do citocromo P-45015, sobre o β-pineno [22], em um processo análogo à biossíntese da car-vona, formam o pinocarveol [23], cuja desidrogenação oxidativa resulta na pinocarvona [24] (Esquema 1).
Um rearranjo do cátion bornílico [25] do tipo Wagner-Meerwein gera o cátion canfílico [26] que, por desprotonação do C10, leva ao canfeno [27]. Alternativamente, o cátion bornílico [25] pode capturar um grupo difosfato formando o difosfato de bornila [28], o qual é convertido em borneol [29]. A oxidação enzimática do borneol [29] origina a cânfora [30]. Em contrapartida, a acilação enzimática do borneol [29], em semelhança ao que ocorre com outras substâncias, resultaria no acetato de isobornila [31] (Esquema 1).
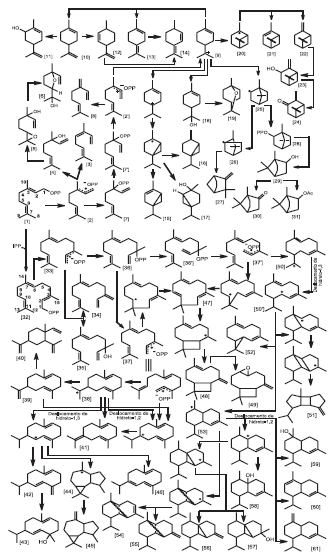
Como pode ser notado no Esquema 1, o linalol [4] é um dos primeiros constituintes a ser biossintetizado. O fato de sua biossíntese envolver poucas etapas pode contribuir para sua presença em altas concentrações no óleo essencial de L. alba. Comparando as porcentagens relativas de alguns monoterpenóides (Tabela 2), observa-se que a do linalol diminui no inverno, enquanto que as de outros compostos como o α-pineno, canfeno, sabineno, 1,8-cineol, cânfora, pinocarvona e borneol aumentam. Associadas aos efeitos de uma maior ou menor atividade enzimática, estas observações também levam a supor que exista algum mecanismo de controle da rota biossintética. É possível que, em épocas de temperatura elevada (Tabela 1), uma maior taxa de volatilização do linalol direcione sua biossíntese na elaboração de maior quantidade do produto. Já em períodos de baixas temperaturas ocorreria o contrário, restando assim mais substrato (GPP) para ser transformado nos demais monoterpenóides citados.
A formação dos sesquiterpenóides tem início (Esquema 1) com ionização do difosfato de farnesila (FPP) [32]. O cátion resultante [33] pode ser desprotonado no C15 para formar E-β-farneseno [34] ou pode sofrer hidratação para formar E-nerolidol [35]. A migração do grupamento difosfato de C1 para C3 em [33] resulta no difosfato de nerolidila (NPP) [36]. A partir deste ponto, a biossíntese dos demais sesquiterpenóides desenvolve-se via ionização direta e/ou rotação da ligação entre C2 e C3 e posterior ionização do isômero NPP [36´].
A ionização direta do NPP [36] e sua subseqüente ciclização entre C10-C1 leva à formação do cátion germacrílico [38]. A saída de um próton, por vezes associada a um deslocamento intramolecular de hidreto, conduz à formação dos germacrenos A [39], B [41], D [42] e C [46]. A nova protonação destes constituintes no C6 conduz à obtenção de estruturas do tipo eudesmano, enquanto que a protonação no C3 leva aos derivados do tipo azulano ou guaiano, como o alo-aromadendreno [45]. Outro constituinte também obtido pela via dos germacrenos é o germacreno-D-4-ol [43], obtido provavelmente pela hidratação do germacreno D (Esquema 1).
O β-elemeno [40] pode ser considerado um subproduto originado durante o processo de extração do óleo essencial por hidrodestilação e análise por cromatografia gasosa, pois, sob condições ligeiramente ácidas ou de aquecimento, este constituinte é facilmente obtido a partir do germacreno A através do rearranjo de Cope33 (Esquema 1).
A ciclização do cátion NPP [37] entre C11-C1, associado à desprotonação do C9, leva à formação do α-humuleno [47]. Quando esta ciclização vem acompanhada da formação de uma ligação adicional entre C2-C10, além da desprotonação do C15 forma-se o E-β-cariofileno [48]. A via do isômero do NPP [37´] também pode ser utilizada para a formação deste constituinte, bem como do E-β-farneseno [34] apresentado anteriormente. O óxido de cariofileno [49], por sua vez, mostrou ser um subproduto da auto-oxidação do E-β-cariofileno [48] pela sua exposição ao oxigênio do ar (Esquema 1).
A ciclização do isômero do NPP [37´] entre C10-C1 conduz à formação do cátion germacradienílico ou (E, Z)-germacrílico [50]. Adotando como ponto de partida este cátion [50], a seqüência de reações envolvendo deslocamento intramolecular de hidreto, ciclização entre C7-C1, ciclização entre C6-C2 e desprotonação do C15 levaria à formação do β-bourboneno [51] (Esquema 1).
O isômero do cátion germacradienílico [50´], obtido após o deslocamento de hidreto, pode ciclizar entre C6-C1, formando o cátion cadinílico [53] ou, através da saída de um próton e adicional ciclização entre C1 e C11, originar o biciclogermacreno [52] (Esquema 1).
A partir do cátion cadinílico [53], por meio de uma ligação entre C2-C7, forma-se um intermediário tricíclico que, desprotonado, leva aos constituintes α-copaeno [54] e/ou β-copaeno [55]. Através da migração de hidreto-1,2 do carbocátion cadinílico [53] e ciclização entre C2-C6, origina-se outro intermediário tricíclico capaz de formar, por desprotonação do C-15, o β-cubebeno [56] e, provavelmente, pela reação com água, o cubebol [57]. Alternativamente, o mesmo cátion cadinílico [53], por deslocamento de um hidreto, seguido da adição de água, forma o 1,10-di-epi-cubenol [58]. Cane e Ke25 demonstraram experimentalmente que o átomo de oxigênio do grupo hidroxila do epicubenol, um isômero do 1,10-di-epi-cubenol [58], deriva exclusivamente da água. Segundo estes autores, a reação do cátion cadinílico [53] com a água levaria à formação dos isômeros do cadinol, como τ-murulol e/ou α-cadinol [59]. Em contrapartida, de maneira análoga ao que ocorre quando da formação de outros derivados de esqueleto cadinano, a saída de um próton do cátion cadinílico [53] conduziria à biossíntese do α-muuruleno [60] e/ou γ-muuruleno [61] (Esquema 1).
AGRADECIMENTOS
À Farmacopéia Brasileira pelo apoio e ao Instituto Nacional de Meteorologia (INMET) – Distrito de Porto Alegre pelo fornecimento dos dados meteorológicos. Apoio financeiro: CAPES e CNPq.
REFERÊNCIAS
1. Biasi, L. A.; Costa, G.; Cienc. Rural 2003, 33, 455.
2. Stasi, L. C.; Oliveira, G. P.; Carvalhaes, M. A.; Queiroz-Junior, M.; Tien, O. S.; Kakinami, S. H.; Reis, M. S.; Fitoterapia 2002, 73, 69.
3. Pascual, M. E.; Slowing, K.; Carretero, E.; Mata, D. S.; Villar, A.; J. Ethnopharmacol. 2001, 76, 201.
4. Matos, F. J. A.; Machado, M. I. L.; Craveiro, A. A.; Alencar, J. W.; J. Essent. Oil Res. 1996, 8, 695.
5. Castro, D. M.; Ming, L. C.; Marques, M. O. M.; Rev. Bras. Pl. Med. 2002, 4, 75.
6. Atti-Serafini, L.; Pansera, M. R.; Atti-Santos, A. C.; Rossato, M.; Pauletti, G. F.; Rota, L. D.; Paroul, N.; Moyna, P.; Rev. Bras. Pl. Med. 2002, 4, 72.
7. Lima, H. R. P.; Kaplan, M. A. C.; Cruz, A. V. M. C.; Floresta Ambient. 2003, 10, 71.
8. Nagao, E. O.; Innecco, R.; Mattos, S. H.; Medeiros Filho, S.; Marco, C. A.; Rev. Ciên. Agron. 2004, 35, 355.
9. Stashenko, E. E.; Jaramillo, B. E.; Martinez, J. R.; J. Chromatogr., A 2004, 1025, 93.
10. Farmacopéia Brasileira, 4ª ed., Atheneu: São Paulo, 2000.
11. Adams, R. P.; Identification of essential oil components by gas chromatography/quadupole mass spectroscopy, Allured Publishing Corporation: Illinois, 2001.
12. Terblanché, F. C.; Kornelius, G.; J. Essent. Oil Res. 1996, 8, 471.
13. Tavares, E. S.; Julião, L. S.; Lopes, D.; Bizzo, H. R.; Lage, C. L. S.; Leitão, S. G.; Rev. Bras. Farmacogn. 2005, 15, 1.
14. Köllner, T. G.; Schnee, C.; Gershenzon, J.; Degenhardt, J.; Plant Cell 2004, 16, 1115.
15. Dudareva, N.; Pichersky, E.; Gershenzon, J.; Plant Physiol. 2004, 135, 1893.
16. Cheng, A.; Lou, Y.; Mao, Y.; Lu, S.; Wang, L.; Chen, X.; J. Integr. Plant Biol. 2007, 49, 179.
17. Owen, S. M.; Peñuelas, J.; Trends Plant Sci. 2005, 10, 420.
18. Bouvier, F.; Rahier, A.; Câmara, B.; Prog. Lipid Res. 2005, 44, 357.
19. Schnee, C.; Köllner, T. G.; Gershenzon, J.; Degenhardt, J.; Plant Physiol. 2002, 130, 2049.
20. Dewick, P. M.; Nat. Prod. Rep. 2002, 19, 181.
21. Bohlmann, J.; Steele, C. L.; Croteau, R.; J. Biol. Chem.1997, 272, 21784.
22. Bohlmann, J.; Meyer-Gauen, G.; Croteau, R.; Proc. Natl. Acad. Sci. U. S. A. 1998, 95, 4126.
23. Bouwmeester, H. J.; Gershenzon, J.; Konings, M. C. J. M.; Croteau, R.; Plant Physiol. 1998, 117, 901.
24. Bouwmeester, H. J.; Konings, M. C. J. M.; Gershenzon, J.; Karp, F.; Croteau, R.; Phytochemisty 1999, 50, 243.
25. Cane, D. E.; Ke, N.; Bioorg. Med. Chem. Lett. 2000, 10, 105.
26. Croteau, R.; Felton, M.; Karp, F.; Kjonaas, R.; Plant Physiol. 1981, 67, 820.
27. Croteau, R.; Satterwhite, D. M.; Cane, D. E.; Changn, C. C.; J. Biol. Chem. 1988, 263, 10063.
28. Hackl, T.; König, W. A.; Muhle, H.; Phytochemisty 2004, 65, 2261.
29. Hallahan, T. W.; Croteau, R.; Arch. Biochem. Biophys. 1988, 264, 618.
30. Hallahan, T. W.; Croteau, R.; Arch. Biochem. Biophys. 1989, 269, 313.
31. Heyen, U.; Harder, J.; FEMS Microbiol. Lett. 1998, 169, 67.
32. Isaksson, D.; Doctoral Thesis, Mid Sweden University, Sweden, 2006.
33. Kraker, J.; Franssen, M. C. R.; Groot, A.; König, W. A.; Bouwmeestr, H. J.; Plant Physiol. 1998, 117, 1381.
34. Lamarti, A.; Badoc, A.; Deffieux, G.; Carde, J. -P.; Bull. Soc. Pharm. Bordeaux 1994, 133, 100.
35. Little, D. B.; Croteau, R. B.; Arch. Biochem. Biophys. 2002, 402, 120.
36. Mau, C. J. D.; Croteau, R.; Phytochem. Rev. 2006, 5, 373.
37. Novak, J.; Bitsch, C.; Pank, F.; Langbehn, J.; Franz, C. M.; Euphytica 2002, 127, 69.
38. Pichersky, E.; Raguso, R. A.; Lewinsohn, E.; Croteau, R.; Plant Physiol. 1994, 106, 1533.
39. Raguso, R. A.; Pichersky, E.; Plant Species Biol. 1999, 14, 95.
40. Sköld, M.; Borje, A.; Harambasic, E.; Karlberg, A.; Chem. Res. Toxicol. 2004, 17, 1697.
41. Sköld, M.; Karlberg, A.; Matura, M.; Börje, A.; Food Chem. Toxicol. 2006, 44, 538.
42. Steele, C. L.; Crock, J.; Bohlmann, J.; Croteau, R.; J. Biol. Chem. 1998, 273, 2078.
43. Wise, M. L.; Savage, T. J.; Katahira, E.; Croteau, R.; J. Biol. Chem. 1998, 273, 14891.
44. Yadav, M. K.; Chudasama, C. D.; Jasra, R. V.; J. Mol. Catal. A: Chem. 2004, 216, 51.
Tópicos relacionados
Autores:
Junte-se para comentar.
Uma vez que se junte ao Engormix, você poderá participar de todos os conteúdos e fóruns.
* Dados obrigatórios
Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.
Criar uma publicação


