1 Introdução
As aflatoxinas, metabólitos secundários produzidos por certos fungos do gênero Aspergillus, podem causar vários efeitos tóxicos em animais (COUNCIL FOR AGRICULTURE SCIENCE AND TECHNOLOGY, 2003). A exposição humana e de animais às aflatoxinas ocorre predominantemente pela ingestão de alimentos e rações contaminados, especialmente cereais e grãos, como milho, trigo, amendoim, entre outros. Dezoito diferentes tipos de aflatoxinas foram identificados, mas somente as aflatoxinas B1 (AFB1), B2 (AFB2), G1 (AFG1) e G2 (AFG2) foram detectadas como contaminantes naturais de rações e ingredientes, sendo a AFB1 a toxina de maior toxicidade (MOSS, 1998).
A contínua ingestão de AFB1 por animais em lactação leva à excreção de aflatoxina M1 (AFM1) no leite (PARK; POHLAND, 1986). Os efeitos tóxicos carcinogênicos da AFM1 têm sido extensivamente demonstrados em espécies de laboratório (RILEY; PESTKA, 2005), portanto, a International Agency for Research on Cancer (1993) classificou a AFM1 no Grupo 2 (um provável carcinógeno humano). A taxa de transferência de AFB1 da ração para o leite de vacas está situada entre 1 e 3%, com uma transferência média de 1,7%, embora estes valores possam variar de acordo com vários fatores como o nível de AFB1 ingerido, produção de leite, saúde individual e sensibilidade às aflatoxinas (JOUANY; DIAZ, 2005). Frobish etal. (1986) observaram AFM1 no leite de vacas lactantes, 12 horas após o consumo de ração contaminada, com uma transferência média de 1,74% do total de AFB1 ingerida na ração. Patterson, Glancy e Roberts (1980) e Price et al. (1985) encontraram resultados semelhantes em vacas leiteiras, observando taxas de transferência de 2,2 e 1,6%, respectivamente.
No Brasil, a ocorrência de AFM1 em leites pasteurizados e esterilizados (longa-vida) é variável (GARRIDO et al., 2003; JUSSARA, 2000; MARTINS, J. L. S.; MARTINS, I. S., 1986; OLIVEIRA; ROSMANINHO; ROSIM, 2006; SABINO; PURCHIO; ZORZETTO, 1989; SYLOS; RODRIGUEZ-AMAYA; CARVALHO, 1996), mas os níveis observados geralmente se encontram abaixo do limite de tolerância (0,5 µg.L–1) determinado pelas normas vigentes (BRASIL, 2002a). A ocorrência de AFB1 em ingredientes para rações do gado leiteiro é relativamente frequente no Brasil (RODRÍGUEZ-AMAYA; SABINO, 2002), porém são poucos os trabalhos que avaliam a ocorrência de AFB1 na ração fornecida ao gado leiteiro e de AFM1 no leite em condições de campo. Sendo assim, o objetivo do presente trabalho foi verificar a ocorrência de aflatoxinas em rações e leite produzidos em propriedades leiteiras do Estado de São Paulo.
2 Material e métodos
2.1 Amostragem
Seis propriedades leiteiras de leite tipo B, localizadas em áreas próximas aos municípios de São Carlos e Ribeirão Preto, região nordeste do Estado de São Paulo, foram utilizadas para a amostragem. Todas as propriedades leiteiras amostradas utilizavam rações à base de soja e milho, produzidos e armazenados localmente. Outros ingredientes utilizados eram: caroço de algodão, sorgo, forragem, silagem de milho, cana-de-açúcar, polpa cítrica, cevada e trigo. Não foram observadas diferenças significativas nos ingredientes das rações de cada fazenda durante as coletas. Em cada fazenda, cinco alíquotas de 500 g de ração foram colhidas de diferentes áreas do cocho de alimentação. Portanto, as cinco líquotas foram representativas da ração disponível para as vacas em lactação imediatamente após a ordenha. As alíquotas foram adicionadas em uma mesma embalagem de polipropileno estéril para constituir uma amostra de 2,5 kg de ração colhida em cada propriedade.
Após a ordenha de todos os animais em lactação, retirou-se uma amostra de 500 mL de leite do tanque de refrigeração, que foi colocada em um frasco estéril. Esta amostra, juntamente com a amostra de ração colhida na mesma propriedade, foi acondicionada em caixa isotérmica e transportada com gelo até o laboratório para serem analisadas em um prazo de até 24 horas. Os procedimentos para a colheita das amostras foram repetidos cinco vezes em cada propriedade, uma vez por mês, nos meses de outubro de 2005 a fevereiro de 2006, totalizando 30 amostras de ração e 30 de leite analisadas.
2.2 Análise de aflatoxina na ração
A determinação de aflatoxinaB1 nas amostras de ração foi efetuada em duplicata, seguindo-se os procedimentos preconizados pela empresa fabricante de colunas de imunoafinidade (Aflatest, Vicam®, Watertown, MA, EUA) e quantificação através de cromatografia líquida de alta eficiência (CLAE). A amostra de ração (2,5 kg) foi previamente triturada e homogeneizada em um moinho (Marconi, Piracicaba, Brasil). Em seguida, a amostra analítica (50 g) foi colocada em um blender, juntamente com 5 g de NaCl e 100 mL de metanol-água (80 + 20). Após a agitação em alta velocidade (1 minuto), o extrato foi filtrado em papel de filtro e recolheram-se 10 mL em um béquer. Foram adicionados ao extrato 40 mL de água ultrapurificada (Milli-Q, Millipore, Billerica, MA, EUA) e a mistura completamente homogeneizada foi filtrada (filtro de microfibra, 1,5 µm, Millipore). Recolheram-se 10 mL para passagem através de coluna de imunoafinidade, adaptada a um suporte para extração em fase sólida, conectado a um sistema de vácuo (fluxo de 1-2 gotas/segundo). Após a eluição da amostra, a coluna foi lavada através da passagem de 10 mL de água Milli-Q. Em seguida, foi passado 1 mL de metanol (grau CLAE), de maneira a eluir as aflatoxinas, recolhendo o eluato em frasco âmbar. O eluato foi diluído com 1 mL de água Milli-Q, para formar uma solução de metanol-água (50 + 50), semelhante à fase móvel utilizada na corrida cromatográfica (SCOTT, 1990).
A separação e a quantificação das aflatoxinas foram conduzidas em um sistema de cromatografia líquida (Shimadzu?, Kyoto, Japan), equipado com detector de fluorescência (excitação: 360 nm e emissão: 440 nm) e coluna Shim-pack CLC-ODS (5 µm) 4,6 × 250 mm, precedida de pré-coluna Shim-pack (5 µm) 4 × 10 mm. Foram injetados 20µL da amostra filtrada (membrana filtrante PTFE, 0,45 µm, Millex, Millipore, Billerica, MA, EUA) e foi utilizado metanol-água (45 + 55) como fase móvel, com fluxo de 0,8 mL/minuto. A quantificação da aflatoxina B1 nas amostras foi realizada através da interpolação das áreas dos picos cromatográficos, obtidos nas amostras, na equação de regressão da curva de calibração.
O padrão de AFB1 (Sigma-Aldrich, St Louis, MO, EUA) foi dissolvido em solução de benzeno-acetonitrila (98 + 2), a qual foi calibrada espectrofotometricamente (λ = 350 nm) para obtenção da concentração exata das toxinas. Após a calibração, foram transferidos, para um frasco, 200 µL do padrão, que foi evaporado até a secura sob fluxo de nitrogênio e ressuspendido em volume conveniente de metanol grau CLAE, de maneira a obter uma solução de trabalho contendo aproximadamente 1,0 µg AFB1 mL–1. Estas soluções foram utilizadas no preparo dos padrões da curva de calibração (concentrações aproximadas de 2,5, 5,0, 10,0 e 20,0 ng.mL–1), a qual foi construída através da injeção de 20 µL da solução padrão. O tempo de retenção foi de aproximadamente 6,8 minutos para a AFB1.
2.3 Análise de aflatoxina M1
A extração e purificação das amostras para a determinação de AFM1 foram realizadas em duplicata de acordo com as recomendações de Tuinstra, Roos e van Trijp (1993), com adaptações propostas pelo fabricante das colunas de imunoafinidade (Aflatest®, Vicam, Watertown, MA, EUA), como descrito por Oliveira etal. (2006). Em síntese, a amostra analítica (25 mL) foi previamente aquecida a 37 °C, adicionada de 1 g de NaCl e submetida à centrifugação (2.500g, 15minutos), após o que foi passada diretamente através de coluna de imunoafinidade, sendo adaptada a uma seringa de vidro e conectada a um sistema de vácuo (fluxo de 2-3 mL/minuto). Após a eluição da amostra, a coluna foi lavada através da passagem de 20 mL de água ultrapurificada (Milli Q, Millipore)-metanol (9:1, v/v). Em seguida, passou-se 1 mL de metanol, de maneira a eluir a AFM1, recolhendo-se o eluato em frasco âmbar. O eluato foi diluído com água ultrapurificada até formar uma solução de metanol-água (7:3, v/v), semelhante à fase móvel utilizada na corrida cromatográfica. A identificação e quantificação de resíduos de AFM1 foram conduzidas com a injeção de 20 µL dos extratos das amostras em sistema CLAE sob as mesmas condições descritas para a análise de aflatoxinas em rações, exceto pela fase móvel isocrática, a qual foi constituída de metanol-água (7:3, v/v) com fluxo de 0,8 mL/minuto. Sob estas condições, o tempo de retenção para a AFM1 foi de aproximadamente 3,7 minutos. A curva de calibração da AFM1 foi preparada usando soluções padrão de AFM1 (Sigma, St Louis, MO, EUA) previamente avaliadas de acordo com Scott (1990), nas concentrações de 0,5, 1,0, 2,5, 5,0 e 10,0 ng.mL–1.
3 Resultados e discussão
Os métodos analíticos empregados no experimento foram previamente avaliados com a utilização de rações e leites contaminados experimentalmente com AFB1 e AFM1 em diferentes níveis. Na amostras de ração contaminada com AFB1 em níveis de 5,0 e 50,0 µg.kg–1, os percentuais de recuperação variaram de 89 a 108%, sendo os desvios padrão relativos de 2,3 a 12,0%. As amostras de leite contaminadas com AFM1 em níveis de 0,05 e 0,50 µg.L–1 revelaram percentuais de recuperação de 75 a 124%, com desvios padrão relativos de 3,9 a 22,1%. Os limites de quantificação para AFB1 e AFM1 foram 1,0 e 0,010 µg.L–1, respectivamente, considerando-se a quantidade mínima de toxina que poderia gerar um pico cromatográfico três vezes acima da linha de base do desvio padrão.
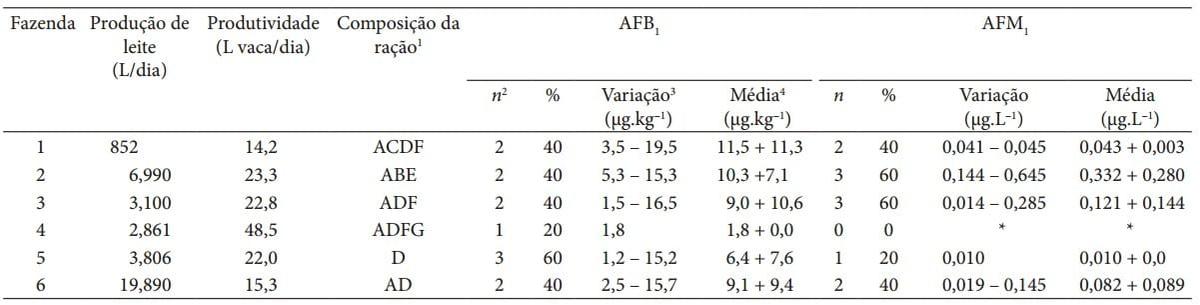
Tabela 1. Aflatoxinas nas rações e nos leites colhidos em propriedades leiteiras do Estado de São Paulo.
1 Todas as rações eram à base de milho e soja com: A: algodão, B: sorgo, C: forragem, D: silagem, E: cana-de-açúcar, F: polpa cítrica, G: trigo; 2 Número de amostras positivas. Foram analisadas (em duplicata) 5 amostras de ração e 5 amostras de leite para cada propriedade, totalizando 30 amostras; 3 Níveis mínimo e máximo detectados em amostras analisadas em duplicata; 4 Valores reportados como média ± desvio padrão, para amostras contendo níveis detectáveis de aflatoxinas; * Nível abaixo do limite de quantificação do método analítico (aflatoxina B1: 1,0 µg.kg–1; aflatoxina M1: 0,010 µg.L–1).
A Tabela 1 apresenta dados de produção de leite e composição da ração, o número de amostras positivas, a variação e as concentrações médias de aflatoxinas na ração e no leite das propriedades amostradas. Todas as propriedades apresentaram AFB1 na ração, sendo que o maior número de amostras positivas foi observado na propriedade que fornecia somente silagem aos animais. A frequência de amostras de ração positivas para AFB1 foi de 40% e as concentrações observadas variaram de 1,2 a 19,5µg.kg–1 (média de 8,4 µg.kg–1). Pozzi etal. (1995) detectaram apenas uma amostra contaminada com AFB1 (500µg.kg–1) em 130 amostras de milho que seria utilizado como ração no Estado de São Paulo. Os resultados deste estudo são semelhantes aos obtidos por Corrêa etal. (1997), que observaram 14 de 96 amostras de ração positivas para AFB1 em níveis de 11 a 287 µg.kg–1. Deve-se ressaltar, no entanto, que a comparação entre os resultados do presente estudo com os reportados por outros autores é difícil, uma vez que a contaminação de ingredientes varia de acordo com a área, diferenças climáticas e práticas agrícolas, entre outros (JOUANY; DIAZ, 2005). Os níveis de AFB1 observados nas amostras de ração mantiveram-se abaixo do limite de tolerância recomendado para ingredientes de rações no Brasil (50 µg.kg–1– somatória de B1 + B2 + G1 +G2) (BRASIL, 1988).
A frequência de detecção de AFM1 no leite foi de 36,7%, em concentrações variando de 0,010 a 0,645 µg.L–1 (média de 0,144 µg.L–1). Esta frequência foi coerente com a detecção de AFB1 nas rações das propriedades. As fazendas com produção de leite entre 3.100 e 6.990 L/dia apresentaram três amostras (60%) positivas para AFM1 no leite de mistura, enquanto que a fazenda com maior produção de leite (19.890 L/dia) apresentou duas amostras (40%) de leite com níveis detectáveis de AFM1. A detecção de AFM1 nestas duas amostras pode ter contribuído de maneira significativa para a ocorrência da toxina nos leites de consumo, devido ao grande volume de leite produzido pela propriedade. No único trabalho sobre a ocorrência de AFM1 no leite cru no Estado de São Paulo, Sabino, Purchio e Zorzetto (1989) encontraram 18% de amostras positivas em níveis de 0,10 a 1,68 µg.L–1. Recentemente, Sassahara, Netto e Yanaka (2005) encontraram AFM1 em níveis de 0,29 a 1,97 µg.L–1 em 24% das amostras de leite cru colhidas em fazendas do Estado do Paraná, das quais apenas três (7%) estavam acima do limite de 0,5 µg.L–1.
O processo de modernização do setor de produção de leite, com vistas à adequação às normas contidas na Instrução Normativa 51 (BRASIL, 2002b), tem promovido um aumento significativo na produção leiteira no Brasil, possibilitando a exportação de produtos lácteos. Este aumento se deve, em parte, ao fornecimento intensivo de rações aos animais, sobretudo nos meses de entressafra (outono e inverno), o que pode ter contribuído para a obtenção de níveis detectáveis de AFM1 no leite das regiões estudadas. Ressalte-se que no presente estudo a amostragem foi efetuada nos meses de primavera e verão, obtendo-se apenas uma amostra com AFM1 acima de 0,5 µg.L–1. No entanto, 20% das amostras de leite apresentaram níveis de AFM1 superiores a 0,050 µg AFM1L–1, limite de tolerância adotado pela União Europeia. Portanto, estes níveis poderiam motivar restrições às exportações de produtos lácteos brasileiros.
Dez amostras, sendo cinco de ração e cinco de leite, colhidas na mesma propriedade no mesmo dia de amostragem, apresentaram níveis detectáveis de AFB1 e AFM1, respectivamente. As concentrações médias de AFB1 e AFM1 nessas amostras foram 8,8 + 8,1 µg.kg–1 e 0,201 + 0,273 µg.L–1, respectivamente. Vários pesquisadores calcularam a quantidade de AFM1 excretada no leite como uma porcentagem da AFB1 ingerida na ração. Deste modo, utilizando-se os dados obtidos nas dez amostras, estima-se que cerca de 2,3% da AFB1 na ração foi excretada na forma de AFM1 no leite. Apesar da dispersão dos resultados obtidos em nosso estudo, o valor encontrado é coerente com a taxa de conversão obtida experimentalmente, sendo possível utilizá-la para predizer a conversão de AFB1 em AFM1 em condições de campo. Além disso, o resultado do estudo demonstra que o limite para AFM1 no leite (0,5µg.L–1) é ultrapassado quando a ração contém AFB1 a partir de 40 µg.kg–1, aproximadamente. Consequentemente, o limite recomendado pela legislação brasileira para aflatoxinas em rações (50 µg.kg–1– somatória de B1 + B2 + G1 + G2) (BRASIL, 1988) parece não ser adequado para prevenir a ocorrência de AFM1 no leite. Este fato reforça a importância da revisão desta norma, com a finalidade de estabelecer limites coerentes para aflatoxinas para ingredientes e rações destinadas ao gado leiteiro.
4 Conclusões
A detecção das aflatoxinas B1 e M1, embora em concentrações abaixo dos limites de tolerância brasileiros, indica a frequente presença da toxina nas rações e no leite, respectivamente. Há, portanto, a necessidade de adequação das práticas agrícolas nas propriedades leiteiras estudadas do Estado de São Paulo para evitar a contaminação dos ingredientes destinados à alimentação animal, e consequentemente a exposição humana à AFM1 através do consumo de leite.
Agradecimentos
Os autores agradecem à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), processo no 2005/50979-7, o auxílio financeiro.
Referências bibliográficas
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária – ANVISA. Resolução RDC n. 274, de 15 de outubro de 2002a. Aprova o regulamento técnico sobre limites máximos de aflatoxinas admissíveis no leite, no amendoim, no milho. Diário Oficial da União, Poder Executivo, Brasília, DF, 16 de outubro de 2002. Disponível em: <http://e-legis.bvs.br/leisref/public/showAct.php?id=1653&word=Aflatoxina %20M1>. Acesso em: 10 set. 2004.
BRASIL. Ministério da Agricultura. Portaria n. 07, de 09 de novembro de 1988. Estabelece os padrões mínimos das diversas matérias primas empregadas na alimentação animal. Diário Oficial da União, Poder Executivo, Brasília, DF, 09 de novembro de 1988.
BRASIL. Ministério da Agricultura. Instrução Normativa n. 51, de 18 de setembro de 2002b. Aprova os regulamentos técnicos de produção, identidade e qualidade do leite tipo A, do leite tipo B, do leite tipo C, do leite pasteurizado e do leite cru refrigerado e o regulamento técnico da coleta de leite cru refrigerado e seu transporte a granel. Diário Oficial da União, Poder Executivo, Brasília, DF, 20 de setembro de 2002. Disponível em: <http://www.agricultura.gov.br/sda/dipoa/in51.htm>. Acesso em: 16 set. 2003.
CORRÊA, B. et al. Distribution of molds and aflatoxins in dairy cattle feeds and raw milk. Revista de Microbiologia, v. 28, n. 4, p. 279-283, 1997.
COUNCIL FOR AGRICULTURE SCIENCE AND TECHNOLOGY– CAST. Mycotoxins: risks in plant, animal, and human systems. Ames, 2003.
FROBISH, R. A. et al. Aflatoxin residues in milk of dairy cows after ingestion of naturally contaminated grain. Journal of Food Protection, v. 49, n. 10, p. 781-785, 1986.
GARRIDO, N. S. et al. Occurrence of aflatoxins M (1) and M (2) in milk commercialized in Ribeirão Preto-SP, Brazil. Food Additives and Contaminants, v. 20, n. 1, p. 70-73, 2003.
INTERNATIONAL AGENCY FOR RESEARCH ON CANCER – IARC. Some naturally occurring substances: food items and constituents, heterocyclic aromatic amines and mycotoxins. Monographs on the Evaluation of Carcinogenic Risks to Humans, v. 56, p. 489-521, 1993.
JOUANY, J. P.; DIAZ, D. E. Effects of mycotoxins in ruminants. In: DIAZ, D. E. (Ed.). The mycotoxin blue book. Nottingham: Nottingham University Press, 2005. p. 295-321.
JUSSARA, A. T. Ocorrência de aflatoxina M1 em amostras de leite comercializado na cidade de São Paulo. 2000. Dissertação (Mestrado) – Universidade de São Paulo – USP, São Paulo.
MARTINS, J. L. S.; MARTINS, I. S. Aflatoxina M1 no leite tipo “B” comercializado no município de São Paulo, SP (Brasil). Revista de Saúde Pública, v. 20, n. 4, p. 303-308, 1986.
MOSS, M. O. Recent studies of mycotoxins. Journal of Applied Microbiology Symposium, v. 84, Supplement, p. 62S-76S, 1998. OLIVEIRA, C. A. F.; ROSMANINHO, J.; ROSIM, R. Aflatoxin M1 and cyclopiazonic acid in fluid milk traded in São Paulo, Brazil. Food Additives and Contaminants, v. 23, n. 2, p. 196-201, 2006.
PARK, D. L.; POHLAND, A. E. A rationale for the control of aflatoxin in animal feeds. In: STEYN, P. S.; VLEGGAAR, R. (Eds.). Mycotoxins and phycotoxins. Amsterdam: Elsevier Applied Science, 1986. p. 473-482.
PATTERSON, D. S. P.; GLANCY, E. M.; ROBERTS, B. A. The carryover of aflatoxin M1 into milk of cows fed rations containing a low concentration of aflatoxin B1. Food and Cosmetics Toxicology, v. 18, n. 1, p. 35-37, 1980.
POZZI, C. R. et al. Postharvest and stored corn in Brazil: mycoflora interaction, abiotic factors and mycotoxins occurrence. Food Additives and Contaminants, v. 12, n. , p. 313-319, 1995.
PRICE, R. L. et al. Aflatoxin conversion by dairy cattle consuming naturally contaminated whole cottonseed. Journal of Food Protection, v. 48, n. 1, p. 11-15, 1985.
RILEY, R. T.; PESTKA, J. Mycotoxins: metabolism, mechanisms and biochemical markers. In: DIAZ, D. E. (Ed.). The mycotoxin blue book. Nottingham: Nottingham University Press, 2005. p. 279-294.
RODRÍGUEZ-AMAYA, D. B.; SABINO, M. Pesquisa em micotoxinas no Brasil: a última década em foco. Brazilian Journal of Microbiology, v. 33, n. 1, p. 1-11, 2002.
SABINO, M.; PURCHIO, A.; ZORZETTO, A. P. Variations in the level of aflatoxin in cows milk consumed in the city of São Paulo, Brazil. Food Additives and Contaminants, v. 6, n. 3, p. 321-326, 1989.
SASSAHARA, M.; NETTO, D. P.; YANAKA, E. K. Aflatoxin occurrence in foodstuff supplied to dairy cattle and aflatoxin M1 in raw milk in the North of Paraná state. Food Chemistry and Toxicology, v. 43, n. 6, p. 981-984, 2005.
SCOTT, P. M. Natural poisons. In: HELRICH, K. (Ed.). Official methods of analysis of the Association of Official Analytical Chemists. 15 ed. Arlington, 1990. p. 1184-1213.
SYLOS, C. M.; RODRIGUEZ-AMAYA, D. B.; CARVALHO, P. R. Ocurrence of aflatoxin M1 in milk and dairy products commercialized in Campinas, Brazil. Food Additives and Contaminants, v. 13, n.2, p. 169-172, 1996.
TUINSTRA, L. G.; ROOS, A. H.; van TRIJP, J. M. Liquid chromatographic determination of aflatoxin M1 in milk powder using immunoaffinity columns for clean-up: interlaboratory study. Journal of the Association of Official Analytical Chemists, v. 76, n. 6, p. 1248-1254, 1993.