A última pesquisa publicada sobre as interações fitato-proteína destaca as diferenças entre as enzimas fitase na prática.
Publicado: 20 de abril de 2015
Por: Peter Plumstead1 e S. Yu2 – 1Universidade de Pretoria, Sud África; 2Enzyme R&D (Pesquisa e Desenvolvimento de Enzimas), Genencor, Danisco A/S, Aarhus, Dinamarca.
Uma revolução na nossa compreensão do modo de ação da enzima fitase e os valores associados de matriz na formulação de rações foi apresentada em um trabalho recente publicado por Tran et al. na edição de janeiro de 2011 da Analytical Biochemistry, entitulado "A simple and fast kinetic assay for phytases using phytic acid-protein complex as substrate" (Um teste cinético simples e rápido das fitases usando o complexo ácido fítico-proteína como substrato).
Embora, à primeira vista, a relevância do título para os nutricionistas possa não ser imediatamente óbvia, essa pesquisa em conjunto feita por cientistas da Universidade de Lund (Suécia) e a Genencor estudou as interações entre o fitato e as proteínas da dieta, medidas pela formação de complexos insolúveis e a possibilidade de se usar o complexo fitato-proteína como substrato em testes de fitase. Os autores demonstraram que, como os complexos fitato-proteína ocorrem na ração e no trato digestivo dos animais, eles podem ser um substrato mais relevante para a avaliação das fitases do que o fitato de sódio, um produto de laboratório utilizado rotineiramente em testes tradicionais de fitase. O estudo é de interesse comercial porque incluiu uma avaliação independente de quatro diferentes fitases comerciais quanto à sua eficácia em hidrolisar tanto o fitato de sódio sintético quanto os complexos proteína-fitato que ocorrem naturalmente nas rações, a um pH de 3.0. Os resultados da Tabela 1 confirmam, primeiramente, que quando o fitato de sódio (IP6-Na) é usado como substrato a um pH baixo, o grau de hidrólise de fitato de sódio é semelhante entre as duas fitases de E. coli, mas significativamente mais baixo quando as fitases fúngicas (P. lycii e A. niger) são aplicadas. Essas diferenças entre as fontes de fitase de E. coli e fúngicas não são novidade, e provaram ser uma função do pH ótimo mais baixo das fitases de E. coli em relação às suas contrapartes de fitase fúngica (Wyss et al., 1999). Contudo, as grandes diferenças mostradas entre as fitases comerciais, em sua capacidade de degradar complexos proteína-fitase, são da maior relevância para os nutricionistas, pois elas são significativamente distintas nas fitases de E-coli e fúngicas e também entre diferentes fontes de fitase de E. coli. Como o principal efeito antinutricional do fitato é causado pela formação de complexos insolúveis proteína-fitato na parte ácida do trato digestivo, esses dados fornecem a primeira evidência sólida de que o benefício nutricional das enzimas de fitase não pode mais ser visto como constante nas classes de fitase como a da E. coli.
Tabela 1: Atividade de diferentes fitases comerciais a um pH de 3.0 e a 37°C na proteína de soja ou nos complexos lisozima-proteína com fitato (IP6), comparadas ao fitato de sódio (IP6-Na) como substrato. Todos os fitatos foram adicionados a uma dose de 0.1 FTU/ml (de Tran et al., 2011).
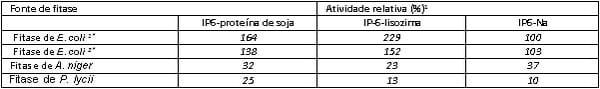 1 Foram relatadas atividade fitáticas (quantidade de fosfato liberado) nos outros substratos em relação à atividade da variante 1 de fitase de E.coli no fitato de sódio (IP6-Na).
1 Foram relatadas atividade fitáticas (quantidade de fosfato liberado) nos outros substratos em relação à atividade da variante 1 de fitase de E.coli no fitato de sódio (IP6-Na). *Fitase 1 de E. coli proveniente de Schizosaccharomyces pombe e fitase 2 de E. coli proveniente de Pichia pastoris.
Consequentemente, na prática, devem ser aplicados diferentes valores de matriz na formulação de rações para levar em conta essas diferenças.
Para entender plenamente os resultados da pesquisa mostrados na Tabela 1, é importante saber que, embora o fitato de sódio seja usado como substrato para determinar a atividade de fitase in vitro, na natureza e na parte ácida do trato digestivo de aves (proventrículo e moela) e suínos (estômago), o ácido fítico não ocorre em sua forma de ácidos livres, nem como sal de sódio , e sim associado às proteínas. O motivo da associação entre fitato e proteína no trato digestivo é que a maioria das proteínas de origem vegetal, como as derivadas do milho, da soja, do girassol e da colza (canola), possuem seus pontos isoelétricos (valores de pl) na faixa ácida (ph 4.5). Portanto, quando o pH no trato digestivo fica abaixo do ponto isoelétrico da proteína, ela fica carregada positivamente, o que permite que a molécula negativamente carregada do ácido fítico se ligue a ela, alterando assim o ponto isoelétrico da proteína e tornando-a insolúvel (Reddy et al., 1989; Konietzny and Greiner, 2003). Essa formação de complexos insolúveis proteína-fitato na parte ácida do trato digestivo pode ter consequências nutricionais importantes devido à acessibilidade diminuída às proteases pepsina, resultando no aumento de secreção de pepsina, em mais perdas endógenas e digestão ineficaz de proteína, conforme indicado pela redução da digestibilidade ileal de aminoácidos a partir do fitato (Vaintraub and Bulmaga, 1991, Konietzny and Greiner, 2003, Kies et al., 2006, Cowieson et al., 2008).
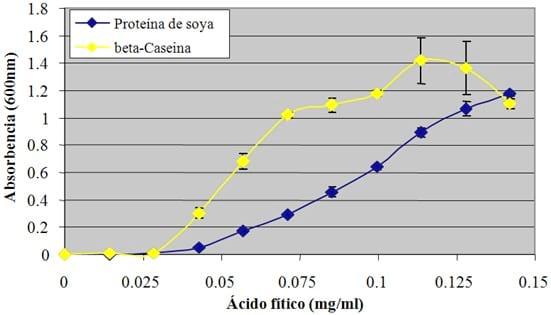
De maior importância são os novos dados mostrando que a formação de complexos insolúveis proteína-fitase são proporcionais à quantia de fitato presente. Isso é indicado na Figura 1, onde a presença de complexos insolúveis proteína-fitato da proteína de soja ou caseína, medidos pela absorbância a 600 nm aumentou quase que linearmente à medida que a concentração de fitato também aumentava. Em outras palavras, o efeito antinutricional do fitato na parte ácida do trato digestivo do animal será proporcional à concentração de fitato não digerido (IP6) presente na parte ácida do trato digestivo, e é confirmado pelo trabalho anterior de Cowieson et al. (2009), que demonstrou um aumento gradual nas perdas aminoácidas endógenas no íleo terminal à medida que os níveis de fitato alimentar aumentavam. Ao contrário dos efeitos negativos do fitato na digestibilidade de energia e aminoácidos, as vantagens nutricionais das enzimas de fitase dependerão principalmente da capacidade da fonte de fitase de hidrolisar rapidamente os complexos fitato-proteína a um pH baixo (região da moela e proventrículo), reduzindo assim seus efeitos antinutricionais e resultando em melhorias livres da utilização de energia e proteína.
Em conclusão, a última década de pesquisas provou que os efeitos antinutricionais do fitato vão além da mera redução da disponibilidade de fósforo e cálcio, e incluem efeitos negativos do fitato na ligação proteica, na perda endógena de nutrientes e na utilização de energia e aminoácidos. A compreensão, por parte dos nutricionistas, que a formação de complexos insolúveis proteína-fitato na parte ácida do trato digestivo é o modo principal de ação em que o fitato exerce seus efeitos antinutricionais e, de modo inverso, pelo qual as enzimas de fitase contribuem para aumentar a utilização de energia e aminoácidos é essencial à tomada de decisões conscientes quanto à seleção das fontes adequadas de fitase para a aplicação nas rações.
As diferenças óbvias entre as fontes de fitase avaliadas na pesquisa de Tran e colegas sugerem que o benefício nutricional das diferentes fitases não pode ser o mesmo, o que torna essencial uma avaliação dos valores de matriz associados oferecidos pelos fornecedores de fitase. Além disso, como os efeitos do fitato na ligação protéica no ambiente ácido são também proporcionais à concentração de fitato e à dose de fitase na ração, em síntese, o valor de matriz aplicado às fitases na formulação de rações é uma função desses três fatores e deve ser ajustado com base no seguinte:
1- A fonte de enzima de fitase e sua capacidade de hidrolisar complexos fitato-proteína a um pH baixo.
2- O nível de fitato da dieta, sendo que a redução de benefícios na utilização de energia e aminoácidos deriva da fitase a níveis mais baixos de fitato .
3- Doses mais altas de fitase fornecem uma relação maior de enzima:substrato na digesta, permitindo uma degradação mais rápida do complexo proteína-fitato, reduzindo ainda mais seus efeitos antinutricionais e aumentando a utilização alimentar livre de energia e aminoácidos.
2- O nível de fitato da dieta, sendo que a redução de benefícios na utilização de energia e aminoácidos deriva da fitase a níveis mais baixos de fitato .
3- Doses mais altas de fitase fornecem uma relação maior de enzima:substrato na digesta, permitindo uma degradação mais rápida do complexo proteína-fitato, reduzindo ainda mais seus efeitos antinutricionais e aumentando a utilização alimentar livre de energia e aminoácidos.
Figura 1: A formação de complexos insolúveis fitato-soja ou fitato-caseína aumenta com o aumento da concentração de ácido fítico (de Yu et al., dados não publicados).
Principais referências
T. T. Tran, R. Hatti-Kaul, S. Dalsgaard, S. Yu. 2011. A simple and fast kinetic assay for phytases using phytic acid-protein complex as substrate (Um teste cinético simples e rápido das fitases usando o complexo fítico ácido proteína como substrato). Anal. Biochem. 410: 177-184.
S. Yu, A. Cowieson, P. Plumstead, C. Gilbert, and S. Dalsgaard. Interactions of phytate and myo-inositol phosphate esters (IP1-5) including IP5 isomers with dietary proteins and iron and inhibition of pepsin (Interações do fitato e dos ésteres de mio-inositol e fosfato (IPI-5), inclusive isômeros IP5, com proteínas alimentares e ferro, e inibição de pepsina). Enviado para publicação.
Tópicos relacionados
Junte-se para comentar.
Uma vez que se junte ao Engormix, você poderá participar de todos os conteúdos e fóruns.
* Dados obrigatórios
Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.
Criar uma publicação




.jpg&w=3840&q=75)