Triptofano na dieta de galinhas poedeiras
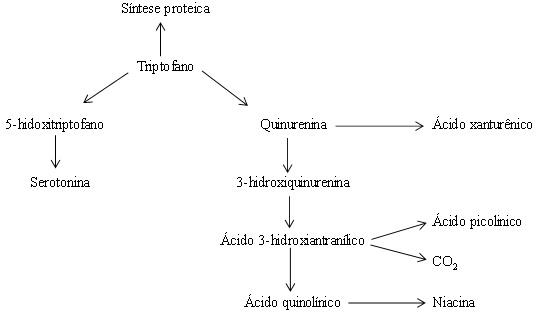
Bai M, Liu H, Xu K et al. A review of the immunomodulatory role of dietary tryptophan in livestock and poultry. 2017; 49: 67-74.
Bello AU, Idrus Z, Meng GY et al. Gut microbiota and transportation stress response affected by tryptophan supplementation in broiler chickens. Ita. J. of Ani. Sci. 2018; 17: 107-113.
Bertechini AB. Nutrição de Monogástricos. Lavras: Editora UFLA, 2012. 373p.
Birkl P, Chow J, McBride P et al. Effects of acute tryptophan depletion on repetitive behavior in laying hens. Fron. Vet. Sci. 2019; 6: 230-7.
Boa Ventura PV. Determinação de aminoácidos limitantes em dietas complexas para poedeiras comerciais. Dissertação (Mestrado em Zootecnia). 2013. 65f. Universidade Estadual Vale do Aracajú, Sobral-CE.
Bortoluzzi C, Fernandes JIM, Doranallik K et al. Effects of dietary amino acids in ameliorating intestinal function during enteric challenges in broiler chickens. 2020; 262: 114383.
Bryen WL, Li X, Ruhnke I et al. Nutrition, feeding and laying hen welfare. Ani. Pro. Sci. 2021; 61: 893-914.
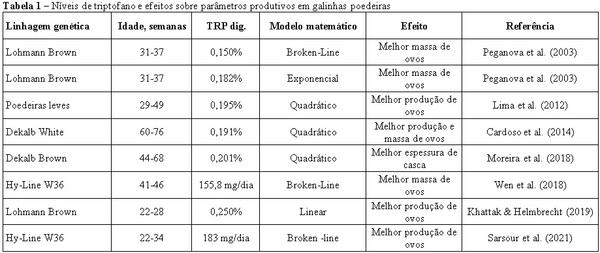
Calderano AA, Gomes PC, Lelis GR et al. Digestible tryptophan-to-digestible lysine ratio in diets for laying hens of 42 to 58 weeks of age. Revi. Bras. Saud Prod. Ani. 2016; 17: 139-148.
Coon G, Zhang B. Ideal amino acid profile for layers examined. Feed. 1999; 71: 13-15.
Corzo A, Kidd MT, Thaxton JP et al. Dietary tryptophan effects on growth and stress responses of male broiler chicks. Brit. Poult. Sci. 2005; 46: 478-84.
De Hass EM, Van Der Eijk JAJ. Where in serotonergic system does it go wrong? Unravelling the route by wich the serotonergic system affects feather pecking in chickens. Neur. Bio. Rev. 2018; 95: 170-88.
Dong X, Azzam M, Rao W et al. Evaluating the impacto f excesso dietary tryptophan on laying performance and imune function of laying hens rereasd under hot and humid summer condition. Brit. Poult. Sci. 2012; 53: 491-6.
Dong X, Zou X. Effects of excesso dietary tryptophan on laying performance, antioxidant capacity and imune functions of laying hens. In: Amino Acic – New Insights and Roles in Plant and Animal, Toshiki Asao, ed. InTech, ISBN: 978-953-51-3242-4. 2017. DOI: 10.5772/intechopen.68546
Dong Y, Bin Z, Wei R et al. Effects of dietary tryptophan levels on performance and egg quality of laying hens. J. Ani. Nut. 2010; 22: 1265-70.
Ducy P, Karsenty G. 2010. The two faces of serotonina in bone biology. J. Cell Biol. 2010; 19:7-13.
Gao J, Xu K, Liu H et al. Impact of the gut microbiota on intestinal immunity mediated by tryptophan metabolismo. Front. Cell. Infec. Mic. 2018; 8:13. DOI: 10.3389/fcimb.2018.00013
Gershon MD, Tack J. The serotonina signaling system: from basic understanting to drug development for functional GI disorders. Gast. 2007; 132: 397-414.
Harms RH, Russel GB. Evaluation of tryptophan requirement of the comercial lauer by using a corn-soybean meal basal diet. Poul. Sci. 2000; 79: 740-2.
Jiang SQ, Gou ZY, Lin XJ et al. Effects of dietary tryptophan levels on performance and biochemical variables of plasma and intestinal mucosa in yellow-feathered broiler breeders. J. Ani. Phy. Ani. Nut. 2018; 102: e387-e394.
Khanipour S, Mehri M, Bagherzadeh-Kasmani F et al. Excess dietary triptophan mitigates aflatoxicosis in growing quais. J. Ani. Phy. Ani. Nut. 2019; 103: 1462-73.
Khattak F, Helmbrecht A. Effect of different of tryptophan on productive performance, egg quality, blood biochemistry, and caecal microbiota of hens housed in enriched colony cages under comercial stocking density. Pou. Sci. 2019; 98: 2094-2104.
Layunta E, Buey B, Mesonero JE et al. Crosstalk between intestinal serotonergic system and pattern recognition receptors on the microbiota-gut-brain axis. Fron. End. 2021; 12: 748254. DOI: 10.3389/fendo.2021.748254
Le Floch’h N, Melchior D, Seve B. Dietary tryptophan helps to preserve tryptophan homeostasis in pigs suffering from lung inflammation. J. Ani. Sci. 2008; 86: 3473-79.
Le Floc’h N, Seve B. Biological roles of tryptophan and its metabolismo:potential implications for pig feeding. Liv. Sci. 2007; 112: 23-32.
Lima MR, Costa FGP, Guerra RR et al. Digestible tryptophan: lysine ratio for laying hens. Revi. Bra. Zoo. 2012; 41: 2203-10.
Liu H, Shi B, Liu D et al. Supplemental dietary tryptophan modifies behavior, concentrations of salivary cortisol, plasma epinephrine, norepinephrine and hypothalamic 5 hydroxytryptamine in weaning piglets. Liv. Sci. 2013; 151: 213-8.
Liu Y, Yuan J, Zhang LS et al. Effects of tryptophan supplementation on growth performance, antioxidative activity, and meat qualitly of ducks under high stocking density. Pou. Sci. 2015; 94: 1894-1901.
Lucki I. The spectrum of behaviors influenced by serotonina. Biol. Psy. 1998; 44: 151-162.
Martin CL, Duclos M, Aguerre S et al. Corticotropic and serotoniergic responses to acute stress with/without prior exercise training in diferente rat strains. Acta Physio. Scand. 2000; 168:421-30. DOI: 10.1046/j.365-201x.2000.00683.x
Mench JA. Research note: Feed restriction in broiler breeders causes a persistente elevation in corticosterone secretion that is modulated by dietary tryptophan. Pou. Sci. 2000; 70: 2547-50.
Moreira TRS, Oliveira LFA, Cruz GFL et al. Relação de triptofano com aminoácidos ramificados para poedeiras semipesadas. In: 55ª Reunião Anual da Sociedade Brasileira de Zootecnia e 28º Congresso Brasileiro de Zootecnia. Goiânia-GO, Brasil. 2018.
Mousavi SN, Afsar A, Khalaji S et al. Estimation of digestible tryptorphan: lysine ratio for maximum performance, egg quality and welfare of white-egg-laying hens by fitting the diferente non-linear models. J. Appl. Anim. Res. 2018; 46:411-6.
NRC. 1994. National Research Council. Nutrient Requirments of Poultry: Ninth Revised Edition, Natl. Acad. Press, Washington, DC. https://doi.org/10.17226/2114.
Pan X, Wei Z, Wang H et al. Effects of dietary tryptophan on protein metabolismo and related gene expression in Yangzhou goslings under diferentes feeding regimens. Pou. Sci. 2013; 92: 3196-3204.
Peganova S, Eder K. Studies on requirement and excesso of isoleucine in laying hens diets. Pou. Sci. 2002; 81: 1714-21.
Peganova S, Hirche F, Eder K. Requeriments of tryptophan in relation to the supply of large neutral amino acids in laying hens. Poult. Sci. 2003; 82: 815-22.
Raju T, Kanth VR, Reddy PUM et al. Influence of kynurenines in pathogenesis of cataract formation in tryptophan-deficient regimen in Winstar rats. Indian J. Expe. Biol. 2007; 45: 543-8.
Rostagno HS; Albino LFT, Hannas MI, et al. Tabelas Brasileiras para Aves e Suínos. 4rd. UFV. 2017.
Sallée M, Dou L, Cerini C et al. The ary hydrocarbon receptor-activating effect of uremic toxins from tryptophan metabolismo: a new concept to understand cardiovascular complications of chronic kidney disease. Tox. 2014; 6:934-49.
Santin E, Ahrens NL, Zanella I. Diferentes níveis de ácido fólico e nicotínico em dietas para frangos de corte. Ciê. Rur. 2000; 30: 681-5.
Sarsour AH, Lee JT, Haydon K et al. Tryptophan requirement of first-cylce comercial laying hens peak egg production. Poult. Sci. 2021; 100: 100896. DOI:10.1016/j.psj.2020.11.065
Sève B. Physiological roles of tryptophan in pig nutrition. In: Huether G et al. Tryptophan, serotonin, and melatonin: basic aspects and applications. New York: Kluwer Academy. 1999: 729-41.
Silva AL, Saraiva EP, Gomes DLS et al. Efeito de diferentes relações triptofano digestível: lisina digestível sobre o peso de órgão e morfometria intestinal de poedeiras leves. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE ZOOTECNIA, 47, 2010. Salvador. Anais... Salvador: Sociedade Brasileira de Zootecnia, 2010. (CD-ROM).
Stone T, Stoy N, Darlington LG. An expanding range of targets for kynurenine metabolites of tryptophan. Cel. Pre. 2013; 34: 136-143.
Van Hierden YM, Koolhaas JM, Korte SM. Chronic increase of dietary L-Tryptophan decreases gentle feather pecking behavior. App. Ani. Beh. Sci. 2004; 89: 71-84.
Van Krimpen MM, Kwakkel RP, Reuvekamp BFJ et al. Impact of feeding management on feather pecking in laying hens. Wor. Pou. Sci. J. 2005; 61: 663-86.
Wen H, Feng L, Jiang W et al. Dietary tryptophan modulates intestinal imune response, barrier function, antioxidante status and gene expression. Of TOR and Nrf2 in young grass carp (Ctenopharyngodonidella). Fish & Shel. Imm. 2014; 40: 275-87.
Wen J, Helmbrecht A, Elliot MA. Evaluation of the tryptophan requirement of small-framed first cycle laying hens. Pou. Sci. 2018; 0: 1-9.
Wu G, Bazer FW, Dai Z et al. Amino acid nutrition in animals: Protein synthesis and beyounc. Ann. Ver. Ani. Bio. 2014; 2: 387-417.
Wu, G. Functional amino acids in growth, reproduction, and health. Adv. Nut. 2010; 1: 31-7.










.jpg&w=3840&q=75)