Protocolos e normas para uso de animais de laboratório para produção de anticorpos e soros
Publicado: 21 de maio de 2007
Por: Keila Maria Roncato Duarte, Centro de Pesquisa e Desenvolvimento em Genética e Reprodução Animal, Instituto de Zootecnia, Agência Paulista de Tecnologia dos Agronegócios -APTA-, SP.
Sumário
Neste trabalho estão recomendados, de forma detalhada, todos os procedimentos a serem avaliados na escolha do animal para produção de anticorpos policlonais, avaliando procedimentos padrão, procurando o bem-estar animal aliado à otimização de tecnologias. Esse trabalho reúne as normas discutidas e publicadas pela Comunidade Européia, organizada pelo Centro Europeu de Validação de Métodos Alternativos (ECVAM ? ?European Centre for Validation of Alternative Methods?) e a Legislação Brasileira do uso de animais de Laboratório, representada pelo COBEA.
Palavras-chave: bem-estar animal, normas internacionais, anticorpos policlonais.
INTRODUÇÃO
A imunização de animais de laboratório visando induzir resposta humoral e/ou celular é uma rotina em laboratórios do mundo todo, o que demanda um grande número de animais de experimenta ção. A produção de anticorpos hoje é realizada pelos mais diversos especialistas, que nem sempre têm o devido conhecimento de imunologia ou experiência em imunizações.
Embora diversas espécies possam ser utilizadas para a produção de anticorpos, coelhos e camundongos são as mais utilizadas para anticorpos policlonais (PAb) e monoclonais (MAb), respectivamente. Mesmo para estas duas espécies, há uma carência de protocolos padronizados para esquemas de imunização e sangria, por exemplo.
Alguns procedimentos vêm sendo largamente discutidos, entre eles, o uso de adjuvantes, os quais aumentam significativamente a resposta imunológica. Entretanto, causam estresse, inflama- ção e dor localizadas.
No Brasil, embora haja uma lei desde 1934 (Decreto n.º 24.645, de 10 de julho de 1934, www.cobea.org.br) para tratar da proteção de animais, focando os de grande porte, ainda não há uma legislação que efetivamente regule a criação e o uso de animais para a pesquisa e o ensino em âmbito nacional. Este fato interfere de forma muito direta na conduta ética dos profissionais envolvidos em experimentação e ainda agride o próprio bem-estar dos animais (Cardoso, 2006).
Com a criação do COBEA (Colégio Brasileiro de Experimentação Animal), em 1991, ficaram estabelecidos os Princípios Éticos na Experimentação Animal, postulados em 12 Artigos que passaram a nortear a conduta de professores e de pesquisadores na prá- tica do uso de animais. Neste documento foi determinada a criação das Comissões de Ética no Uso de Animais, obrigatórias em todas as instituições que pratiquem a experimentação animal (www.cobea.org.br). Contudo, normas específicas para procedimentos de experimentação animal com finalidades diversificadas ainda não são encontradas na legislação brasileira.
Desta forma, diversos autores discutem a uniformiza ção de um protocolo de forma a abranger todas as variáveis, como escolha do adjuvante, rota de injeção, material apropriado para a sangria, etc, de forma a causar o mínimo de sofrimento ao animal. Neste compilado, serão discutidos aspectos da produção de anticorpos policlonais (PAbs) e seus efeitos no bem-estar animal (LEENAARS et al.,1999).
O sistema imune da maioria dos mamíferos possui aproximadamente 1000 populações clonais de linfócitos, caracterizadas pela especificidade de seus receptores de antígeno. Tal diversidade permite ao sistema imunológico ser eficiente contra um número muito grande de imunógenos (proteínas estranhas, carboidratos, peptídeos, bactérias, vírus, etc). Os órgãos linfóides (baço, linfonodos, tonsilas) constituem- se em sítios de produção de anticorpos por linfócitos B estimulados. Assim, cada molécula de anticorpo reconhece um epítopo antigênico especí- fico, que pode ser tão pequeno quanto 5-6 aminoácidos. A resposta policlonal humoral usa toda gama de anticorpos produzidos pelo organismo num determinado período, resultando em anticorpos com alta avidez (afinidade para ligação), dando ao organismo habilidade de defesa contra os mais diversos patógenos.
Em 1975, KÖHLER e MILSTEIN produziram células híbridas, chamadas hibridomas, utilizando fusão de células de baço com células de mieloma, o que permitiu a imortalização de um único linfócito. Os anticorpos monoclonais ou MAbs produzidos pelo clone selecionado, originaram-se de um único linfócito B, e são idênticos e específicos para um único epitopo (KÖHLER e MILSTEIN, 1975). A extrema especificidade, contudo, pode se tornar uma desvantagem quando, por qualquer razão, o sítio antigênico (ou aquela sequência de 5-6 amino-ácidos) for alterado, o que acontece frequentemente com os vírus e com os microrganismos em ambientes diferentes. Cada caso deve ser analisado com cautela na escolha de produzir PAbs ou MAbs. Além do custo e tempo de produção de cada um (no caso dos MAbs, muito mais oneroso e demorado), a aplica ção deve ser levada em conta, já que para os MAbs há a garantia de estabilidade e pureza do reagente, enquanto que para os PAbs, depende do lote de anticorpos adquirido, o que é variável de animal para animal. O fato do PAb poder ser obtido em um curto intervalo de tempo (4 a 8 semanas) tem determinado a preferência pela produção deste tipo de anticorpo em relação ao MAb (4 a 6 meses). Os PAbs podem ser utilizados em ELISA, Western- Blots, fixação de complemento, imunolocalização in situ e in vivo, etc.
Na produção de PAb, diferentes aspectos devem ser considerados, como antígeno contra o qual se pretende produzir os anticorpos, a idade e a espé- cie do animal usado, a rota de imunização dos animais, o tipo e a qualidade do adjuvante a ser empregado no processo de imunização, o método de coleta de sangue, a infraestrutura para criação dos animais, sanidade e a dieta dos animais, além da habilidade e conhecimento do técnico responsável (REHBINDER et al., 1996). Os animais escolhidos devem ser livres de patógenos, geneticamente selecionados (pertencentes a raças definidas) e livres de situações estressantes (acomodações apropriadas, dieta balanceada, manuseio ideal) (LINDBLAD, 1995). A qualidade dos procedimentos de imunização pode ser otimizada através das instalações adequadas e de pessoal especializado (Veterinários e outros). O profissional que irá atuar deve ter familiaridade e treinamento na área de imunização, anestesia e eutan ásia de animais de laboratório.
Outro aspecto a ser discutido é o ambiente em que o animal será mantido. Esse ambiente deve assemelhar ao máximo ao habitat natural do animal envolvido, ou pelo menos favorecer seu comportamento normal. Os trabalhos de GRUBHOFER (1995) podem servir de parâmetros para esse assunto.
Embora os animais sejam geralmente contidos individualmente, gaiolas com grupos de animais também podem ser utilizadas, porém, nesses casos, tempos prolongados de cativeiro podem, contudo, promover a transmissão de patógenos ao grupo. Quando mantidos em gaiolas coletivas recomendase que os machos sejam castrados (LEENARS et al., 1999).
Em toda etapa de imunização, os Bons Procedimentos em Experimentação Animal (GAEP) devem ser respeitados, segundo documentos publicados na Legislação Européia (Council Directive, 86/609/ EEC ? VERHEUL e SNIPPE, 1992).
Os procedimentos cruciais para a produção dos anticorpos são: - preparo do antígeno; - purificação e eventual mistura com adjuvantes; - injeção; - coleta de sangue; e, processamento do antissoro.
Atenção especial deve ser dada à qualidade do antígeno ? eliminar endotoxinas, formaldeído, azida sódica, entre outros compostos que podem ficar no processo de purificação, além do correto armazenamento e esterilização dos instrumentos utilizados na injeção do antígeno e na coleta de sangue (HILGES e SNIPPE, 1992).
Escolha do animal de laboratório
A seleção da espécie a ser utilizada na produção de PAbs, depende da quantidade de antissoro requerida e da facilidade de obtenção das amostras de sangue. Num ensaio de ELISA, o anticorpo prim ário que vai se ligar ao antígeno deve ser diferente do secundário (conjugado), ou seja, o anticorpo primário é, por exemplo, produzido em coelho, e o conjugado, anti-coelho, produzido em cabra. Quando não há exigências especiais quanto à espécie utilizada, coelhos e camundongos devem ser priorizados devido à facilidade de obtenção das amostras de sangue no processo de imunização, principalmente comparados a porquinhos da Índia e hamsters. A seleção também depende do propósito do experimento, em alguns casos, a espécie, a raça e/ou a linhagem dos animais utilizados podem interferir na resposta imunológica. Por exemplo, linhagens BALB/c de camundongos e linhagens C5BL/6 apresentam resposta imunológica diferenciada. A escolha da linhagem deve ser influenciada também pela disponibilidade dos animais e da uniformidade da raça, assim quanto maior a variabilidade dos indivíduos, maior a variabilidade da resposta imune e por conseqüente, menor uniformidade do antissoro obtido.
Embora fatores ambientais e genéticos possam interferir na resposta imune, o complexo de histocompatibilidade de genótipos tem a maior influ ência na resposta. Galinhas tem sido utilizadas como alternativa à produção de anticorpos policlonais. A produção de anticorpos em aves (IgY) é considerada um refinamento da técnica, uma vez que a extração ou coleta de sangue pode ser substitu ída pela extração de anticorpos da gema do ovo, além do fato de galinhas serem filogeneticamente bem distantes dos mamíferos, o que aumenta a sensibilidade dos anticorpos.
Infelizmente o uso de galinhas para o fim de produ ção de anticorpos ainda não está bem disseminado, provavelmente por falta de tradição de uso, falta de experiência no manejo destas aves como animais de laboratório e a falta de conjugados no mercado específicos para galinha. Aliado a esses fatores, está a purificação das IgY da gema, que consiste em um procedimento consideravelmente trabalhoso (DALSGAARD et al.,1995).
No que se diz respeito ao sexo dos animais empregados para a produção de anticorpos, as fêmeas são preferidas por apresentarem maior docilidade, facilidade de manejo, e por serem menos agressivas quando contidas em grupo. Embora as fêmeas apresentem resposta imunológica superior a dos machos, não há impedimento no uso destes para a produção de anticorpos.
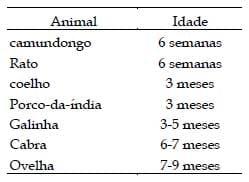
A idade do animal também interfere na resposta imunológica, onde os jovens respondem melhor que os adultos ou senis, o que deve ser avaliado quando animais são re-utilizados para produção de anticorpos policlonais. No caso de galinhas, elas devem estar em fase de postura para a coleta dos ovos contendo IgY. A idade ideal dos animais para a primeira imunização pode ser vista na Tabela 1 (HANLY, 1995), porém, o peso dos animais também é um fator que deve ser levado em conta (MOREIN et al., 1984).
Tabela 1. Idade mínima recomendada a cada animal para uso para produção de anticorpos policlonais.
Protocolo de Imunização
A escolha do protocolo de imunização deve considerar a natureza do antígeno e o destino do anticorpo produzido. Antes de se iniciar um protocolo de imunização, deve-se estudar a toxicidade do antígeno, por exemplo, endotoxinas, resíduos químicos utilizados para inativação de microrganismos (azida sódica, formaldeído, beta-propiolactona, etc), pH extremos, e fazer os ajustes necessários na dosagem. Fatores essenciais ao sucesso da metodologia devem ser observados: uso de adjuvantes, rota e volume de imunização, intervalo entre imunizações, entre outros.
Seleção de adjuvantes
Adjuvantes são substâncias utilizadas para aumentar a resposta imunológica. O adjuvante ideal é aquele que estimula a resposta imune e a mantém estável, mesmo com pequenas quantidades de antígeno. O adjuvante pode ser utilizado em várias espécies animais, pode ser aplicado com diferentes tipos de antígenos, devendo ser facilmente incorporados na solução do antígeno, ser efetivo em poucas injeções (uma ou duas), não causar dor e nem ser tóxico ao animal. Infelizmente, não há nenhum produto para este fim que satisfaça simultaneamente a todos os requisitos acima citados.
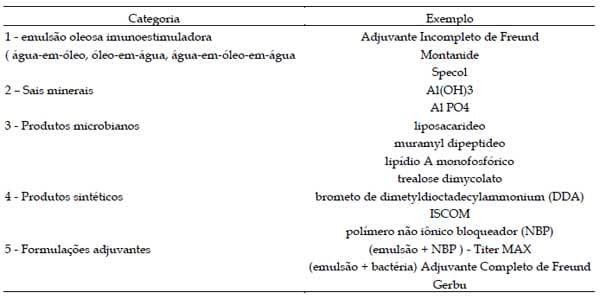
Há cerca de 100 adjuvantes comercializados no mundo, onde alguns são mais utilizados que outros por facilidade de obtenção e preço. Na Tabela 2 pode se ter uma noção dos adjuvantes mais utilizados para produção de anticorpos. As categorias de adjuvantes incluem emulsões minerais, sais minerais, produtos microbianos, produtos sintéticos e misturas de dois ou mais tipos (CLASSEN e BOERSMA, 1992, COX e COULTER, 1997).
Tabela 2. Categorias de adjuvantes e exemplos comerciais de produtos.
A escolha do adjuvante é decisão do pesquisador, contudo o Comitê de Ética da instituição ou empresa deve estar envolvido na decisão, avaliando o bem-estar animal.
O preparo da mistura antígeno-adjuvante deve ser realizado sob condições assépticas para minimizar os riscos de contaminação na inoculação. Os adjuvantes geralmente podem ser dispensados quando o antígeno em questão se trata de bactérias (ou células inteiras) ou ainda parede celular e outras organelas de bactérias. Contudo, adjuvantes são necessários quando se tratam de antígenos solúveis, como proteínas, peptídeos e polissacarídeos. Adjuvantes são também necessários quando pequenas quantidades de antígenos estão disponibilizadas ou quando um tipo específico de resposta é requerido. Quando emulsões oleosas são utilizadas como adjuvante, a estabilidade da mistura deve ser sempre observada. É bastante simples para o técnico responsável observar se a emulsão água-óleo está bem formada, gotejando a emulsão em um pires com água. A emulsão deverá permanecer estável, sem desmanchar.
Escolha da rota de injeção
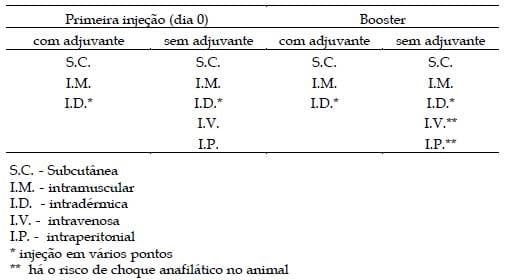
Uma relação de sugestões de rotas para injeção, com ou sem uso de adjuvantes, estão descritas na Tabela 3. A injeção intramuscular é a rota mais discutida entre os grupos de pesquisa (LEENAARS, et al., 1999). Alguns grupos afirmam que a injeção intramuscular pode ser utilizada sem problemas, enquanto outros grupos não recomendam para tal rota de injeção. Outros ainda não a recomendam em pequenos roedores (ratos e camundongos). Em animais com grande massa muscular densa, há a necessidade de grandes quantidades de antígeno para a imunização. Os antígenos podem ser absorvidos em ninfonodos presentes nestas regiões, ou ainda, o adjuvante pode se espalhar nas interfaces musculares ou nos nervos e desencadear processos inflamatórios e patológicos (HANLY et al., 1995 e Droal et al., 1990). Desta forma, injeções intramusculares em roedores e em outros pequenos animais somente devem ser ministradas por profissionais treinados. Não são recomendadas injeções intraperitoneais adicionadas com adjuvantes pelo fato das mesmas causarem lesões tais como: peritonites ou outras inflamações internas, formação de ascites, mudan- ças no comportamento, diminuição da atividade e perda de peso (NICKLAS et al., 1997).
Tabela 3. Rotas de injeção sugeridas com ou sem adjuvantes.
HERBERT (1978) considera a via de administração intravenosa a melhor escolha para antígenos com pequenas moléculas, por exemplo, vírus, bactérias e outras células onde o risco de choque anafilático é baixo, uma vez que a distribuição dos antígenos é externa (na corrente sanguínea) e estes são capturados preferencialmente por estruturas dos linfonodos. Neste caso, o uso de adjuvantes, bem como o uso de agregados de células de bactérias e fungos, pode ocasionar embolia nos animais.
LEENAARS e colaboradores (1999) concordam que sítios de injeção como as almofadas das patas em coelhos não é recomendado. Quando o antígeno for muito precioso, ou seja, em quando se tem pequena quantidade disponível ou quando a obtenção do antígeno é muito trabalhosa e onerosa, como material extraído de bandas de eletroforese e de outras purificações exaustivas, pode-se utilizar injeções nos linfonódos (GOUDIE et al., 1966) ou ainda diretamente no baço (NILSSON e LARSSON, 1992). Nestes casos específicos, uma avaliação criteriosa do Comitê de Ética deve ser realizada.
Volume de injeção
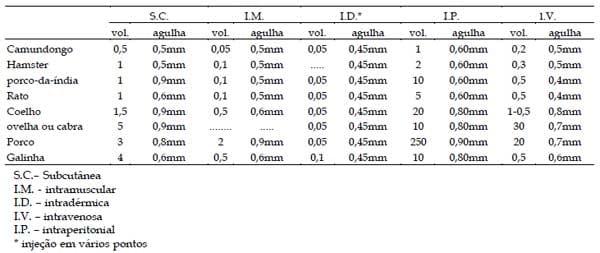
Deve-se utilizar o menor volume possível de antígeno para evitar desconforto e dor nos animais. Volumes máximos permitidos podem ser consultados na Tabela 4. Tais volumes foram calculados com base no sítio de imunização e no uso ou não de adjuvantes. Caso o inóculo contenha um potencializador, como mycobacteria ou derivado de muramyl-dipeptídeo, o antígeno não deve exceder 25µg para um camundongo ou 200µg para um porco- da-índia, rato ou coelho. O inóculo deve ser disposto em vários sítios, proporcionais ao tamanho do animal. Em injeções intraperitoneais, com adjuvantes, o volume máximo é de 200µL. Por via intra-dérmica, somente em coelhos e animais maiores, a dose deverá ser no máximo 25µL por sítio de imunização distribuídos em não mais que 4 sítios. IWARSSON et al., (1994) e VAN ZUPTEN et al., (1993) recomendam volumes máximos de injeção e tamanho recomendado de agulhas, conforme descrito na Tabela 5.
Desenho do protocolo de imunização
O protocolo de imunização terá influência decisiva no resultado das imunizações. O tempo entre as imunizações determina a indução da atividade de células B de memória ou de outras subclasses de imunoglobulinas. Recomendações específicas entre a primeira imunização e o ?booster? geralmente não são citadas. Define-se por ?booster? a última imuniza ção, dada geralmente 48 horas antes da sangria total, em dose maior em relação às imunizações anteriores, como um reforço abrupto à resposta imunológica. O ?booster? é dado quando a titulação de anticorpos já atingiu a estabilidade ou começou a declinar. Quando adjuvantes são utilizados, o ?booster? pode ser ministrado até quatro semanas após as imunizações. Não é necessário o uso de adjuvantes no ?booster?. Para antígenos menores, como esteróides e peptídeos, são necessárias várias imunizações para se atingir a estabilidade na curva de titulação. Apesar de esquemas prolongados de imunização apresentarem maior porcentagem de Imunoglobulinas tipo G, pode ocorrer de haver produ ção de anticorpos contra outras partículas do meio de antígeno, como contaminantes, o que dificulta bastante sua separação no processo de purifica ção dos anticorpos. Os animais podem ser reutilizados com apenas um ?booster? após longo tempo de descanso depois de imunizações sucessivas. Nesta imunização, as células de memória respondem rapidamente, elevando o número de anticorpos presentes na corrente sanguínea (HANLY et al., 1995).
Não é recomendado, durante as primeiras imuniza ções, o uso de quantidades muito pequenas de antígenos (picogramas), o que poderia não induzir uma resposta imunológica ou a produção de células de memória suficientes, podendo levar a uma tolerância ao antígeno. Pequenas quantidades de antígenos necessitam de sucessivas imunizações, o que prejudica o bem-estar do animal. Contudo, pequenas quantidades de antígenos, distribuídas em dois ?boosters?, aumentam significativamente a afinidade dos anticorpos produzidos (LEENAARS et al.,1999).
O local de injeção do ?booster? deve ser diferente dos outros sítios onde foram ministradas as inje- ções anteriores, de modo a não injetar o ?booster? em granulomas ou regiões inflamadas ou edemaciadas decorrentes das imunizações anteriores (JACKSON e FOX, 1995). Adjuvantes completos (com debris de Mycobacterium ou parede celular) devem ser utilizados somente uma vez por animal por causarem severas reações de hipersensibilidade (CCAC, 1991). Deve-se tomar cuidado com antígenos em soluções aquosas utilizados em ?booster? intraperitoneais ou intravenoso, pois os mesmos podem causar anafilaxia devido à liberação rápida de histamina e outros mediadores de basófilos e mastócitos.
Tabela 4. Valor máximo do volume de injeção do antígeno ou da mistura antígeno/adjuvante por sítio, para diferentes espécies animais.
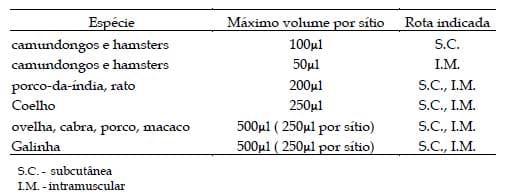
Tabela 5. Volume máximo de injeção e tamanho de agulha utilizada para cada procedimento e para cada animal.
Coleta de sangue
A coleta de sangue deve ser o mínimo estressante possível ao animal. Todo procedimento de sangria deve ter o aval do Comitê de Ética Animal local, o qual visa garantir que ocorra o mínimo de dor ao animal e evitar que o mesmo exiba sintomas de vasoconstrição, o que dificulta a coleta do sangue. Toda coleta deve ocorrer em local com temperatura suficientemente quente para manter o animal aquecido e garantir a circulação de sangue nas regiões periféricas. O local deve ser tranqüilo, higiênico, confortável e sem fontes de estresse como: luz excessiva e presença de muitas pessoas estranhas. Deve-se ainda transportar os animais o mais rápido possível.
O uso de vasodilatadores oriundos de solventes orgânicos não é recomendado devido à toxidez e ao potencial carcinogênico tanto para o animal como para o técnico responsável.
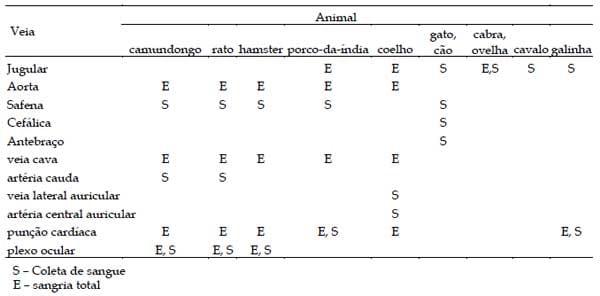
A coleta de sangue deve obedecer aos locais especificados pelas leis internacionais (BVA/FRAME/ RSPCA/UFAW) ? veja Tabela 6 (LEENAARS et al., 1999).
Sempre que possível, a coleta deve ser precedida de anestesia. Deve ainda ser feita com o animal consciente para facilitar a saída do sangue. Pequenos ruminantes e coelhos são mais fáceis que pequenos roedores.
Tabela 6. Veias e artérias apropriadas para coleta de sangue.
Desde que não seja constatado uma operação estressante para o animal, o uso de sedativos ou anestésicos deve ser evitado. Contudo, quanto maior o animal, maior a necessidade de anestesiá-lo.
As agulhas devem ser compatíveis com o calibre do vaso. Tubos a vácuo podem ser utilizados, os mesmos facilitam a coleta rápida e evita colapso das veias. Em coelhos, agulhas na veia marginal da orelha são indicadas, podendo-se utilizar agulhas do tipo borboleta, que permitem que o animal movase durante o procedimento. O volume a ser removido não deve exceder 15 % do total de sangue circulante em coletas parciais. Na prática, cerca de 1 % do peso vivo do animal pode ser removido de forma segura (MC GUIIL e ROWAN, 1989).
Protocolos internacionais apontam o intervalo de coleta de sangue de 1 a 4 semanas. A sangria total deve ser feita com anestesia e preferencialmente por punção cardíaca. Após a sangria total, pequenos roedores devem ter a cervical deslocada (eutaná- sia) e animais maiores devem ser sacrificados com overdose de agente anestésico apropriado.
Monitoramento de efeitos colaterais
De forma a minimizar os efeitos colaterais e estresses causados pela produção de anticorpos, os animais devem ser observados diariamente (MORTON e GRIFFTHS, 1985). O comportamento dos animais deve ser monitorado em determinados períodos, de acordo com o procedimento utilizado (JANSEN VAN ´T LAND e HENDRIKSEN, 1995, BULTHUIS et al., 1997). Aspectos como desconforto, alimentação e consumo de água devem ser observados atentamente, assim como a aparência geral do animal. Os sítios de injeção devem ser cuidadosamente inspecionados e, no caso de edema local, inflamações, etc, uma medicação apropriada deve ser ministrada.
No caso de animais anestesiados, os mesmos devem estar sob observação até a completa coagula ção do sangue no local de coleta. Para coelhos, a artéria da orelha deve ser pressionada por cerca de 5 minutos para o completo estancamento do sangue. Nunca deixar o local sujo com resíduos de sangue.
Inovações tecnológicas
O uso de adjuvantes com proteínas às vezes não resolvem o problema da imunogenicidade (capacidade de uma substância em induzir resposta imunológica). As tecnologias de bioconjugação (HERMANSON, 1996) permitem hoje que peptídeos, carboidratos, e esteróides, entre outras moléculas, induzam adequada resposta imunológica quando acopladas a carreadores como hemocianinas, soroalbumina bovina, caseína, etc,. A resposta imune se dá também contra o carreador, havendo a necessidade de purificação e separação dos anticorpos produzidos (HARLOW e LANE, 1988). Para a conjugação de peptídeos, uma matriz não imunogênica pode ser utilizada como carreador, constituída de lisina, por exemplo. A lisina, junto com um grupo amina, forma uma ?árvore? de lisina, na qual um grande número de peptídeos pode ser conjugado. Todo este processo pode ser artificialmente sintetizado (TAM, 1988).
GLENN e colaboradores (1998) demonstraram que é possível induzir resposta humoral através da imuniza ção transcutânea, usando toxina de cólera, toxóide de tétano e de difteria como adjuvantes. Desta forma, adesivos semelhantes aos usados na indústria farmacêutica (?Pach?) podem ser utilizados para induzir resposta imune, sem causar efeitos indesejados nos animais. Estudos estão sendo feitos no sentido de aprimorar essa técnica para as diferentes espécies produtoras de anticorpos.
As imunizações via oral também são uma alternativa para reduzir o estresse e a dor no animal, utilizando bioesferas associadas a carreadores para induzir resposta imune. Técnicas moleculares, onde genes responsáveis pela produção de anticorpos são clonados em plasmídeos e engenheirados abrem uma ampla gama de novas possibilidades (DE KRUIF et al.,1996 , WINTER et al., 1994).
CONSIDERAÇÕES FINAIS
A intenção desta revisão foi a de colocar juntas as normas utilizadas pela Comunidade Européia para experimentação animal, voltada à produção de anticorpos policlonais, seja para diagnóstico como para uso do soro propriamente dito no tratamento de enfermidades. Os principais pontos destacados forma: quantidade de sangue amostrado, pontos de coleta, rotas de imunização ou vias de aplicação, e formas e locais de inoculação de antígenos, para amenizar o sofrimento dos animais e promover o bem-estar dos mesmos. Espera-se que estes valores padrão aplicados na Comunidade Européia, listados nas tabelas apresentadas neste trabalho, possam servir de guia e são de extrema importância para aplica ção no campo do bioterismo, até que seja providenciada uma legislação de âmbito nacional.
AGRADECIMENTOS
Eu gostaria de agradecer imensamente o Dr. Philippe Delahaut, do Laboratorie de Hormonologie, Marloie, Bélgica pelos trabalhos e protocolos enviados, utilizados pela CER e toda Comunidade Comum Européia.
REFERÊNCIAS BIBILOGRÁFICAS
BULTHUIS, R.J.A. et al. Automated behaviour classification: the LABORAS project. In: O?DONOGHUE, P.N. (Ed.). Harmonization of laboratory animal husbandry. London: Royal Society of Medicine Press, 1997. p. 17-18.
CARDOSO, C.V.P. Leis Referentes à Experimentação Animal no Brasil - Situação Atual. www.cobea.org.br. Acesso em 20 de outubro de 2006.
CCAC. CCAC Guidelines on acceptable immunological procedures. Ottawa: CCAC, 1991. 2 p.
CLAASSEN, E.; BOERSMA, W.J.A. Characteristics and practical uses of new generation adjuvants as an acceptable alternative for Freund´s Complete adjuvant. Research in Immunology, v.143, p.475-582, 1992.
COUNCIL OF EUROPE. European Convention for the protection of vertebrate animals used for the experimental and other scientific purposes. Strasbourg: 1986. 51p.
COX, J.C. Altered immune responsiveness associated with Encephalitozoon cuniculi infection in rabbits. Infection and Immunity, v.15, p. 392-395, 1977.
COX, J.C.; COULTER, A.R. Adjuvants: a classification and review of their modes of action. Vaccine, v.15, p. 248- 256, 1997.
DALSGAARD, K. et al. Immune stimulating complex with Quil A. In: STEWART-TULL, D.E.S. (Eds.). The theory and practical application of adjuvants. Chichester: John Wiley & Sons, 1995. p.129-144.
DROUAL, R. et al. Investigation of problems associated with intramuscular breast injection of oil-adjuvant killed vaccines in chickens. Avian Diseases, v.34, p.473-478, 1990.
ECVAM. ECVAM News e Views. ATLA, v. 22, 7-11, 1994. EEC.
Council Directive 86/609/EEC of 24 november 1986 on the approximation of laws, regulations and administrative provisions of the member states regarding the protection of animals used for the experimental and other scientific purposes. Official Journal of the European Communities, L358, p.1-29, 1986.
GLENN, G.M. et al. Skin immunization made possible by cholera toxin. Nature, v.391, p. 851, 1998.
GOUDIE, R.B. et al. A simple method for producing antibody specific to a single selected diffusible antigen. Lancet, v.7475, p. 1224-1226, 1966.
GRUBHOFER, N. An adjuvant formulation based on Nacetylglucosaminyl- N-acetylmuramyl-L-alanyl-Disoglutamine with dimethyl-dioctadecylammoniun chloride and zinc-L-proline complex as synergists. Immunology Letters, v.44, p.19-24, 1995.
HANLY, W.C. et al. Review on polyclonal antibody production procedures in mammals and poultry. ILAR Journal, v.37, p.93-118, 1995.
HARLOW, E.; LANE, D. Adjuvants. In: Antibodies: a laboratory manual. New York: Cold Spring Harbor, 1988. p.99-124.
HAU, J. The Danish guidelines. In: Danish State Inspectorate Annual Report. Copenhagen: Animal experiments Inspectorate, 1989. p.66-70.
HERBERT, W.J. Mineral oil adjuvants and the immunization of laboratory animals. In: WEIR,D.M. Handbook of Experimental Immunology. 3.ed. Oxford: Blackwell, 1978. p. A3.1-3.15.
HERMANSON, G.T. Bioconjugate Techniques. San Diego: Academic Press, 1996. 785 p.
HILGERS, L.A.T.; SNIPPE, H. DDA as an Immunological adjuvant. Research in Immunology, v. 143, p. 494-503, 1992.
IWARSSON, K. et al. Common non-cirurgical techniques and procedures. In: SVENSEN, P.; HAU, J. Handbook of Laboratory Animal Science. Boca Raton: CRC Press, 1994. p.229-272. v.1.
JACKSON, L.R.; FOX, J.G. Institutional polices and guidelines on adjuvants and antibody production. ILAR Journal, v.37, p.141-152, 1995.
JANSEN VAN´T LAND, C.;HENDRIKSEN, C.F.M. Change in locomotor activity pattern in mice: a model for recognition of distress? Laboratory Animals, v.29, p.286-293, 1995.
KOHLER , G.; MILSTEIN, C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature, v. 256, p.495-497, 1975.
KRUIF, J. et al. New perspectives on recombinant human antibodies. Immunology Today, v.17, p. 453-455, 1996.
LEENAARS, P.P.A.M. et al. The production of polyclonal antibodies in laboratory animals. ATLA, v.27, p.79-102, 1999.
LINDBLAD, E.B. Aluminium adjuvants: In: STEWARTTULL, D.E.S. (Ed.).The theory and practical application of adjuvants. Chichester: John Wiley & Sons, 1995. p.21- 25.
Mc GUILL, M.W.; ROWAN, A.N. Biological effects of blood loss: implication for sampling volumes and techniques. ILAR News, v.31, p.5-20, 1989.
MOREIN, B. et al. ISCOM, a novel structure for antigenic presentation of membrane proteins from enveloped viruses. Nature, v.308, p. 457-459, 1984.
MORTON, D.B.; GRIFFITHS, P.H.M. Guidelines on the recognition of pain, distress and discomfort in experimental animals and an hypothesisfor assessment. Veterinary Record, v.116, p. 431-436, 1985.
NATIONAL RESEARCH COUNCIL. Committee on Infectious Disease of Mice and Rats. Washington: National Academic Press, 1991. 397p.
NICKLAS, W. et al. Animal welfare aspects in the immunization of laboratory animals. Bonn, Germany: Tierärztliche Vereinigung für den Tierschutz, 1997. 6 p.
NILSSON, B.O.; LARSSON, A. Inert carriers for immunization. Research in Immunology, v.143, p.553- 557, 1992.
REHBINDER, C. et al. FELASA recomendations for the health monitoring of mouse, rat, hamster, gerbil, guineapig and rabbit experimental units. Report of the Federation of European Laboratory Animal Science Associations (FELASA) Working Group on Animal Health. Laboratory Animals, v.30, p.193-208, 1996.
TAM, J. P. Synthetic peptide vaccine design: synthesis and properties of a high density multiple antigenic peptide system. Proceedings of the National Academy of Sciences USA, v.85, p.5409-5413, 1988.
Van ZUTPHEN, L.F.M. et al. Principles of laboratory animal science. Amsterdam: Elsevier, 1993. 389 p.
VERHEUL, A.F.M.; SNIPPE, H. Non-ionic block polymer surfactants as immunological adjuvant. Research in Immunology, v.143, p.512-519, 1992.
WINTER, G. et al. Making antibodies by phage display technology. Annual Review of Immunology, v.12, p.433- 455, 1994.
***O trabalho foi originalmente publicado no Boletim da Indústria Animal (BIA), do Instituto Zootecnia (IZ/APTA), da Secretaria de Agricultura e Abastecimento do estado de São Paulo, Brasil.
Tópicos relacionados
Autores:
IZ - Instituto de Zootecnia / Secretaria de Agricultura e Abastecimento
Junte-se para comentar.
Uma vez que se junte ao Engormix, você poderá participar de todos os conteúdos e fóruns.
* Dados obrigatórios
Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.
Criar uma publicação





.jpg&w=3840&q=75)