PH do papo frangos
Influência da flora de exclusão competitiva sobre o PH do papo de frangos de corte
Publicado: 9 de março de 2011
Por: Paulo Lourenço Silva (Dr. em Ciências Veterinárias -UFLU); Patrícia Soares, Eurípedes Vilela da Silva, Bernardo Rezende Carvalho, Daise Aparecida Rossi
RESUMO
O objetivo deste trabalho foi avaliar o efeito da suplementação de frangos de corte comprobiótico contendo Lactobacillus plantarium, Lactobacillus bulgaricus, Lactobacillusacidofillus, Lactobacillus ruminosus, Enterococcus faecium, Bifidobacterium bifidum eEstreptococcus thermofilusna sobre o pH do papo. Foram utilizados 120 frangos de corte, sendo60 animais suplementados com o probiótico e 60 animais sem suplementação, sendo este o grupocontrole. Todas as aves tratadas e controles receberam ração à vontade até 28 dias de idade,sendo os tratamentos avaliados em diferentes idades (1 dia, 7, 12, 18, 23 e 28 dias) para acontagem de enterobactérias, lactobacilos e Clostridium sp. e aferição do pH do papo. Osresultados permitem concluir que a adição de probiótico na ração levou a uma diferençasignificativa no pH do papo dos animais e pode ser utilizado no tratamento preventivo à infecçõesbacterianas. O controle de enterobactérias observado pode ser um indício da exclusão competitivarealizada pelas bactérias lácticas, inibindo o crescimento das enterobactérias presentes no tratogastrintestinal. Não foi evidenciado o controle efetivo da população de Clostridium sp. nascondições em que foi realizado este estudo.
PALAVRAS-CHAVE: Clostridium sp., enterobactérias, frangos de corte, pH do papo,probióticos.
1 INTRODUÇÃO
Na atividade avícola, a produção deovos férteis e a eclosão das aves, em escalaindustrial, são realizadas de forma a reduzir,ao máximo, as contaminações pormicrorganismos. Essa ausência de contato dopintainho com uma microbiota naturalinterfere no desenvolvimento intestinal e nocrescimento da ave (Silva, 2000).A pouca diversidade da microfloraintestinal de aves recém-nascidas, além deser considerada como um fator limitante paraa digestão, também possibilita a colonizaçãointestinal por patógenos entéricos. O efeitonegativo desse processo tem sido contornado, em parte, com o uso depromotores de crescimento, os quais temsido responsáveis pela melhoria naprodutividade animal, especialmente nosperíodos iniciais de criação (Lorençon et. al.,2007).Entre os aditivos mais empregadospara promover o crescimento estão osantibióticos. No entanto, o usoindiscriminado dos antibióticos pode resultarno desenvolvimento de populaçõesbacterianas com possível resistência,dificultando assim o seu uso (Fuller, 1989).Além disso, podem quebrar a simbiose entrea microbiota desejável e o animal (Mulder,1991 apud Furlan et. al., 2004).
Os problemas supracitados instigamos pesquisadores na busca por alternativasque propiciem o controle dosmicroorganismos patogênicos sem, noentanto, provocar uma queda no desempenhodo animal ( Furlan et. al., 2004).Langhout (2005) relata que a simplesretirada dos antibióticos promotores decrescimento da dieta de frangos leva a umadiminuição média no desempenho das avesde 3% a 7%. Havendo ainda, um impactonegativo sobre a saúde animal e umacréscimo na mortalidade. Ainda que sediscuta a relevância prática destes estudos,há um consenso geral de que a proibiçãototal dos antibióticos promotores de crescimento resulte em menor lucratividadepara o setor. Para que se possam ter dietassem o uso de promotores de crescimento,faz-se necessário a introdução de novasestratégias visando contornar os efeitosnegativos sobre o desempenho e a saúde dasaves.Assim, algumas alternativas têmsurgido para promover o equilíbrio namicrobiota intestinal dos frangos, a fim deobter um bom desempenho produtivo semriscos para a saúde humana (Furlan et. al.,2004).Os probióticos apresentam-se nãocomo substitutos, mas como alternativa aosantibióticos promotores de crescimento(Macari e Furlan, 2005).
Probióticos são microorganismosvivos, que geram benefícios quandointroduzidos no trato gastrintestinal,competindo com a flora patogênica pornutrientes, locais de adesão no epitéliointestinal e sintetizando metabólitos (ácidosorgânicos, substâncias antibióticas) ou pelaredução do pH que criam resistência aocrescimento de organismos patogênicos(Junqueira e Duarte, 2005). Esta competiçãoem que os microorganismos benéficos sãofavorecidos é importante, pois odesequilíbrio em favor de bactériasindesejáveis pode resultar em infecçãointestinal, o que comprometeria a digestibilidade da ração, o desenvolvimentoanimal e ainda favorecer o aumento namortalidade (Sato et. al., 2002).Os principais reservatórios demicroorganismos patogênicos no tratogastrintestinal de frangos são o papo, ointestino e o ceco (Furlan et. al., 2004).Assim sendo, este trabalho teve porobjetivo avaliar os efeitos da utilização deuma flora de exclusão competitiva sobre ocrescimento de enterobactérias e deClostridium sp. em frangos de corteverificando a influência desta adição sobre opH do papo.
2 REVISÃO DE LITERATURA
Um dos fatores que contribuírampara a obtenção da alta produtividadeapresentada pela indústria avícola foi semdúvida a utilização de aditivos nas dietas. Otermo aditivo inclui todas as substâncias asquais, quando adicionadas às rações, sãocapazes de melhorar o desempenho animalou as características físicas dos alimentos(Araújo et. al., 2007).A concepção de que odesenvolvimento de microflora poderia levara prejuízos em lotes de frangos, seja pelaconcorrência pelo alimento ou devido alesões provocadas nos vilos da mucosaintestinal pelas bactérias patogênicas, levou a utilização de aditivos - os antibióticos, osquais foram erroneamente denominados depromotores de crescimento (Furlan et. al.,2004).
Entretanto, o uso de antibióticospromotores de crescimento tem sido bastantediscutido atualmente (Rutz e Lima, 2001).Há uma forte campanha para banir ouso dos antimicrobianos na produção animal.Esta seria uma medida cautelar embasada naalegação de que as moléculas de algunsdesses aditivos apresentam semelhanças coma de antibióticos utilizados na terapêuticahumana. Acredita-se que por meio do usoindiscriminado e contínuo dos antibióticos,possa induzir-se, por pressão seletiva, aemergência de bactérias patogênicas multiresistentesa essas drogas (Edqvist &Pedersen, 2002 apud Machado et. al., 2007).
A busca por alternativas naalimentação de aves é realidade constante eestudos são necessários para que se possaafirmar até que ponto eles podem ou não serutilizados, e em que condições e dimensõessão realmente viáveis ( Araújo et. al., 2007).Em 1877, Pasteur e Joubertobservaram uma atividade antagonista entrediferentes amostras bacterianas, este estudomostrou que o controle de bactériaspatogênicas poderia ser realizado combactérias não patogênicas. No início doséculo XX, Metchnikoff (1907) sugeriu que bactérias lácticas poderiam ser usadas com ointuito de promover a saúde humana(Pedroso et. al., 2005). Nurmi e Rantala (1973)administraram o conteúdo intestinal de avesadultas normais a pintinhos de 1 a 2 dias deidade e preveniram a colonização intestinalpor Salmonella Infantis, ou seja, aadministração deste produto permitia umarápida colonização da mucosa intestinal eaumentava a resistência dos pintinhos aSalmonella spp., este procedimento foidenominado "conceito de Nurmi" ouExclusão Competitiva (EC). A princípio, aidéia era só a proteção intestinal contraenteropatógenos sem se verificar o aspectosaúde geral e produtividade animal.Posteriormente, verificou-se que acolonização intestinal por outros patógenoscomo Escherichia coli e Campylobacterspp., também pode ser prevenida através douso de probióticos.
Na mesma época, outros autoresdemonstraram, também, que a aplicação deprobiótico constituído por Lactobacillusacidophilus melhorava a conversãoalimentar e o ganho de peso em aves tratadas(Tortuero, 1973).O princípio da exclusão competitivabaseia-se no fato de que um organismo nãopode ocupar o mesmo espaço de outro,portanto impede a entrada de um agente em um ambiente já colonizado (Ferreira eFerreira, 2006).Os produtos de exclusão competitivapoderiam tornar-se uma alternativa ao usodos promotores de crescimento, pois éproduto natural composto de bactérias quenão são nocivas às aves, ao homem e aomeio ambiente, além de não induzirresistência a nenhum medicamento (Ferreirae Ferreira, 2006). Neste sentido, uma das alternativasque tem sido mais exaustivamente avaliada éa utilização de probióticos (Rutz e Lima,2001).Os probióticos atuam inibindo aproliferação de bactérias patógenas pelaprodução de ácidos orgânicos e substânciasantibióticas ou pela redução de pH. Asbactérias benéficas atuam produzindoenzimas digestivas e metabólitos capazes deneutralizar as toxinas bacterianas; aindaaumentam a imunidade da mucosa intestinalproliferando no trato digestivo e competindocom as bactérias patogênicas (Ferket, 1990).
Ewing & Cole (1994) descreveramque os lactobacilos são capazes deinfluenciar a atividade das enzimas dosmicrovilos, as quais estão envolvidas noprocesso de absorção dos nutrientes e, dessaforma, beneficiam o hospedeiro.O termo probiótico foi introduzidopor Lilly e Stillwell (1965) para descrever substâncias produzidas por um organismoque estimula o crescimento de outros. Adefinição mais comum utilizada é a de Fuller(1989) que chama probióticos aquelesmicrorganismos que acrescentados aoalimento afetam beneficamente o balançomicrobiano intestinal; sendo então, o efeitoprimário, sua influência benéfica noecossistema intestinal produzindo proteçãocontra as infecções gastrointestinais edoenças inflamatórias do intestino. Independente do conceito utilizado,os probióticos atuam favorecendo a saúde dohospedeiro, não deixa resíduos nos produtosde origem animal e não favorecem aresistência aos antimicrobianos, o que ostorna uma excelente alternativa aosantibióticos como aditivos alimentares(Carli, 2002)Os probióticos promovem oequilíbrio da microbiota intestinal emelhoram o ganho de peso e a eficiênciaalimentar das aves, justamente porcompetirem com os patógenos no intestino eevitarem lesões nos vilos permitindo aregeneração da mucosa intestinal (Sato et al.,2002). Esta competição em que osmicroorganismos benéficos são favorecidosé importante, pois o desequilíbrio em favorde bactérias indesejáveis pode resultar eminfecção intestinal, o que comprometeria a digestibilidade da ração, o desempenhoanimal e sua imunidade (Furlan, 2004).Entre os principais modos de açãodos Probióticos, estão: (a) Competição porsítios de ligação; (b) Produção desubstâncias antibacterianas e enzimas; (c)Competição por nutrientes; (d) Estímulo dosistema imune, o que está representado noQuadro 1, adaptado de Reynolds (2004).
Quadro 1: Possíveis mecanismos deExclusão Competitiva.
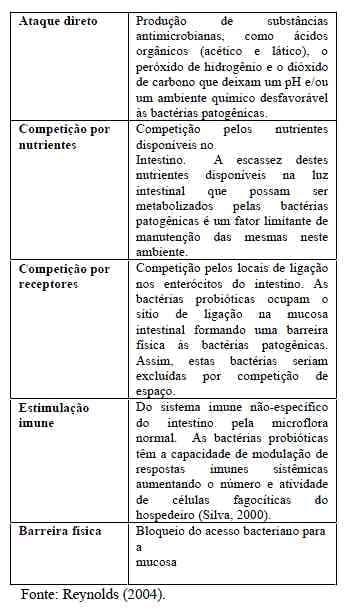
Embora as formas de ação não sejaminteiramente claras, os probióticos sãointroduzidos na flora intestinal comocompetidor contra as bactérias patogênicasinibindo suas atividades antagonistas (Mutuset al., 2006).Estes aditivos podem conter bactériastotalmente conhecidas e quantificadas ouculturas bacterianas não conhecidas. Osprincipais microorganismos bacterianosconsiderados como probióticos são aquelesdos gêneros Lactobacillus eBifidobacterium, além de Escherichia,Enterococcus e Bacillus (Morais & Jacob,2006).
As espécies animais para as quaisexistem produtos comerciais disponíveis sãoaves, suínos, bovinos, ovinos, eqüinos, cãese gatos. As espécies de bactérias maiscomuns utilizadas no preparo dosprobióticos são: Lactobacillus bulgaricus, L.acidophilus, L. casei, L. lactis, L. salivarius,L.plantarium, L. reuteri, L. johonsii,Streptococcus thermophilus, Enteroccusfaecium, E.faecalis, Bifidobacterium spp,Bacillus subtilis e B. Toyoi (Loddi, 2002).Para uma boa eficiência, devem-seutilizar os probióticos já nos primeiros diasde vida, para que ocorra a exclusãocompetitiva, principalmente beneficiandoum bom equilíbrio entre os microrganismos benéficos e para se obterem, assim, melhoresresultados (Lorençon et al., 2007).A microbiota intestinal das aves écomposta de inúmeras espécies de bactérias,formando um sistema complexo e dinâmico.Aquelas que colonizam o trato intestinal noinício tendem a persistir ao longo da vida daave, passando a compor a microbiotaintestinal (Furlan et. al., 2004).A formação desta microbiota se dáimediatamente após o nascimento das aves eaumenta durante as primeiras semanas devida (Flemming, 2005).
O número e composição dosmicroorganismos da microflora intestinal dasaves variam consideravelmente ao longo dotrato gastrintestinal (TGI). No inglúvio(papo) existe a predominância delactobacilos que, produzindo ácido lático eacético, reduzem o pH impedindo ocrescimento de bactérias. O pH noproventrículo e moela é extremamente baixo,e poucas bactérias são capazes de tolerar esteambiente. No duodeno, o pH é neutro e osmicroorganismos colonizam este segmentodo intestino delgado, bem como o jejuno eíleo. O ceco é reconhecido como o segmentode maior colonização de microorganismos,sendo que grande número de bactériasGram-positivas e negativas estão presentesneste local (Macari e Furlan, 2005).
De acordo com Menten e Pedroso(2005), as diferenças entre microbiotas dotrato intestinal são devidas a alterações depH, de secreção enzimática da região, davelocidade de trânsito do bolo alimentar a daconcentração de ácidos graxos voláteis.Em aves, as bactérias patogênicasatingem o trato digestivo após vencerem abarreira do papo (inglúvio). A existência deum ambiente ácido com pH baixo no papo émuito importante para impedir ou diminuir acolonização de patógenos no trato digestivo.A quantidade alta de Lactobacillus e pHbaixo no papo têm mostrado reduzir aocorrência de Salmonella (Hinton et al.,2000).
Esta variada composição damicroflora intestinal pode ser tanto benéficaquanto prejudicial para o hospedeiro,dependendo da natureza e da quantidade demicroorganismos. Os efeitos prejudiciaisseriam: diarréia, infecções, distúrbioshepáticos, carcinogênese, putrefaçãointestinal, redução da digestão e da absorçãode nutrientes. Já os benefícios estariamvinculados à inibição do crescimento debactérias patogênicas, estímulos ao sistemaimune, síntese de vitaminas, redução daprodução de gases e melhor digestão eabsorção dos nutrientes (Furlan et.al., 2004),benefícios que podem ser introduzidos com autilização de probióticos na dieta. Por tudo acima citado, embora haja anecessidade de mais pesquisas, osprobióticos assumem importânciasignificativa para a avicultura industrial porserem uma excelente alternativa namanutenção da alta produtividade, namelhoria do desempenho animal, no controlede patógenos e na qualidade dos alimentos.
3 MATERIAL E MÉTODOS
3.1 Local e AmostragemA coleta das amostras foi realizadaem frangos de corte machos, da linhagemCobb e de uma mesma origem. As avespermaneceram de 1 a 28 dias de idadealojadas na Granja Experimental da Fazendado Glória da Universidade Federal deUberlândia, localizada na região doTriângulo Mineiro, no período de junho ajulho de 2007. As aves eram provenientes delotes de matrizes de produção comercial deuma empresa avícola localizada na região doTriângulo Mineiro certificada peloMinistério da Agricultura, Pecuária e doAbastecimento.
No experimento foram utilizadas 120aves de corte, sendo 60 tratadas e 60controles, alojadas em gaiolas separadas eidentificadas. Cada gaiola albergou 10 aves.Os animais foram alojados 2 horas após serem eclodidos em ambiente controladopara temperatura e umidade.
3.2 Estudo
3.2.1 Inoculação de Probiótico nas aves
As aves teste receberam raçãosuplementada com probiótico (contendoLactobacillus plantarium, L. bulgaricus, L.acidofillus, L. ruminosus, Enterococcusfaecium, Bifidobacterium bifidum,Estreptococcus thermofilus ) na dosagem de1 grama do produto para 6,8 kg de raçãofarelada. A ração, contendo em sua fórmulabásica sorgo e farelo de trigo, foi misturadana própria granja. O probiótico foi pesadoem balança analítica de seis (6) dígitoslocalizada no Laboratório de BiotecnologiaAnimal da Universidade Federal deUberlândia (LABIO-UFU). A ração foipesada na própria granja em balança de altaprecisão e calibrada pelo INMETRO. Nagranja houve a mistura minuciosa doprobiótico à ração.
Os animais controle receberam amesma ração das aves teste, porém sem apresença de probióticos. As rações forampesadas para verificar o consumo das aves.Todas as aves tratadas e controles receberamração à vontade até 28 dias de idade, sendo os tratamentos avaliados em diferentesidades (1 dia, 7, 12, 18, 23 e 28 dias).
3.2.2 Determinação do pH do papo
Nos dias 1, 7, 12, 18, 23 e 28 deidade foram retiradas aves de cada grupo(tratadas e controle) para estudo. Nas idadesde 1 e 7 dias foram retiradas 12 aves emcada dia e nas demais idades 9 aves,aleatoriamente. As aves foramimediatamente enviadas ao LABIO-UFU epesadas individualmente (balançaGEHAKA). Após a pesagem, as aves forameutanasiadas por meio do deslocamento dacoluna cervical com prévia insensibilizaçãopelo éter. Para aferir o pH foi feita umaincisão no papo e introduzido o eletrodo domedidor de pH (aparelho TEC- 3MP). Apóscada aferição o eletrodo foi lavado com águadestilada e secado com papel toalha e, emseguida, recalibrado.
3.2.3 Contagem de microorganismos
Após homogeneização do conteúdodo ceco e intestino dos animais foi retiradauma amostra de 25g. Esta amostra foiadicionada a 225 mL de água peptonadatamponada estéril (APT) e homogeneizada(diluição 10-1). A partir da diluição 10-1foram realizadas as demais diluições decimais seriadas, sempre com atransferência de 1 mL para 9 mL de APT.A contagem de enterobactérias foirealizada pela inoculação de 1 mL de cadaseleção selecionada em Agar cristal VioletaVermelho Bile Glicose (VRBG), seguida daincubação a 36oC por 18 a 24 horas (Brasil,2004).Foram contadas e anotadas ascolônias de coloração vermelha, rodeadas ounão por halo de precipitação da bile com 0,5a 2 mm de diâmetro. Selecionou-se 3 a 5colônias típicas para confirmação pelascaracterísticas de oxidase negativa e debactérias Gram-negativas. Este resultadomultiplicado pela recíproca da diluiçãoutilizada será o número de UFC.g-1.
A contagem de Clostridium sulfitoredutor foi realizada em ágar Triptose SulfitoCicloserina - TSC (Brasil, 2004) incubadoem anaerobiose (Probac anaerobicgenerator®) a 37ºC por 24 horas. Foramcontadas e anotadas as colônias negras de 1 a3 mm de diâmetro. Este resultadomultiplicado pela recíproca da diluiçãoutilizada será o número de UFC.g-1.
3 RESULTADOS E DISCUSSÃO
A comparação do pH do inglúvio(Tabela 1) por meio do teste t de Student,detectou diferença nas idades de 7, 18, 23, 28 dias (p<0,05), assim como na idade de 12dias (p< 0,01). O pH do inglúvio (papo) dosindivíduos tratados tiveram seu valorreduzido. Não houve diferença (p>0,05)entre o pH do papo dos pintos de um diatratados e controle.
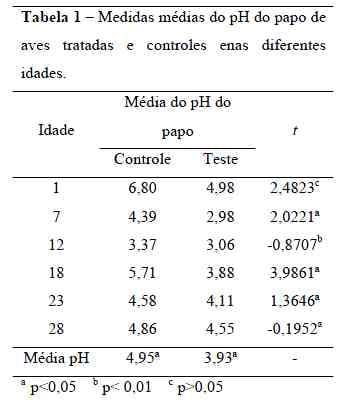
O pH do papo nas aves tratadas econtroles apresentou diferença significativa(p<0,05) nas idades de 7, 18, 23, 28 dias, e(p<0,01) na idade de 12 dias. O pH maisbaixo nas aves tratadas pode ser indicio deuma maior colonização de bactérias láticasdevido à produção de acido lático (Mathew,1996). Essa redução no pH é consideradaimportante pois pode representar umambiente desfavorável à sobrevivência emultiplicação de bactérias patogênicas como a Salmonella e outras enterobacterias, que semultiplicam em uma faixa de pH de 6 a 8(Carli, 2002). Esses resultados diferem deSilva et. al. (2000) que não encontraramdiferença no valor de pH entre aves tratadase controle. A comparação do peso corporal(Tabela 2) realizado por meio do teste tstudent mostrou que não houve diferençaestatística entre os tratamentos controle eteste.
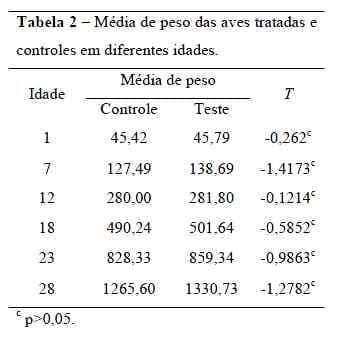
As aves do grupo tratadoconsumiram 37,28 kg de ração, enquanto ogrupo controle consumiu 37,33 kg, nãoapresentando diferença estatística. Osíndices de mortalidade e morbidade doexperimento foram iguais a zero.Não houve diferença significativa(p<0,05) entre o grupo tratado e controlequanto ao peso dos animais. Estes resultadosestão de acordo com os obtidos por Henrique et. al. (1998) quando avaliaram o uso deprobióticos na dieta de frangos de corte nafase de crescimento. Os autores observaramque a utilização de probióticos não promoveumelhorias significativas no desempenho e norendimento de carcaça de frangos de corte,mas reduziram a mortalidade.Do mesmo modo, Campos et al.(2002), trabalhando com vários níveis deinclusão de probióticos na ração (0, 50, 100,150 e 1000 g/ton), não encontraram efeitossignificativos para o consumo de ração,ganho de peso e conversão alimentar. Porémos autores observaram uma diminuição doíndice de mortalidade e o atribuíram a umapossível melhoria no sistema imune das avesque ingeriram probiótico. Este fato não foicomprovado no presente estudo, pois nãoforam observados mortalidade e morbidade Os resultados das contagens deenterobactérias obtidas nos intestinos e cecosde frangos de corte são mostrados na Tabela3.A contagem de microorganismos nasaves tratadas e controles apresentaramdiferença significativa (p<0,05) nas idadesde 7, 18, 28 dias, e na idade de 12 dias nãohouve diferença estatística entre os grupos.Oliveira et. al. (2004) observaramuma ligeira queda no número de isolamentosde enterobactérias no decorrer da idade, o que também foi observado nesteexperimento.
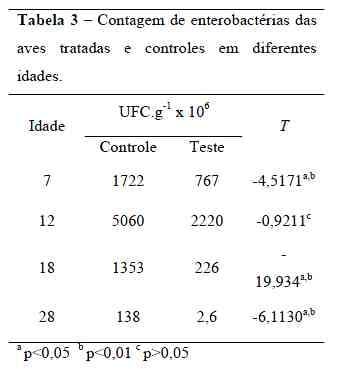
O período de 7 a 12 dias de idade foiaquele em que a contagem de asenterobactérias são encontradas na natureza,onde a maioria habita o intestino do homeme dos animais, seja como membros damicrobiota normal ou como agentes deinfecção (Trabulsi e Campos, 2002).A queda no número de isolamentosobservada após o 12º dia, tanto nas avestratadas como nas aves controle, pode serdevida ao amadurecimento do sistema imunee à instalação gradual da microbiotaintestinal impedindo a colonização do tratodigestivo por microrganismos patogênicos.Entretanto, a queda mais acentuada nacontagem de enterobactérias no grupo testepode ser um indício da exclusão competitiva pelas bactérias lácticas, inibindo ocrescimento das enterobactérias presentes notrato gastrintestinal.A Figura 1 revela como ocorreu avariação das médias das contagens deenterobactérias nos grupos controle etratamento, de acordo com as idades dasaves.
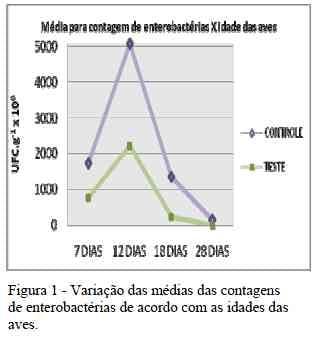
Segundo Daile (1992) apud Pedroso(2003), a base para utilização dosprobióticos em animais é que osmicroorganismos presentes na microbiotaintestinal natural não são suficientes para sealcançar uma boa produtividade.Partindo-se deste princípio, a adição debactérias benéficas pode fazer com que oanimal se torne mais saudável, aproveitemelhor os nutrientes dos alimentos e resistaà colonização de bactérias prejudiciais por exclusão competitiva, o que pôde sercomprovado neste experimento.Apesar da evidência de que o probióticoutilizado inibiu o crescimento deenterobactérias, o mecanismo pelo qual esteatua e contribui positivamente com oorganismo hospedeiro ainda não é bemdefinido (Boekhorst et. al., 2004).Segundo Ermann et. al. (2002) e Jin et.al. (2000), existem dois possíveismecanismos para os benefícios das bactériasácido-lácticas como probióticos: acapacidade de produzir substâncias como oácido láctico e bacteriocinas, que ajudam aimpedir o crescimento de outrosmicroorganismos, também citada por DeVuyst & Vandamme (1994); e a capacidadede aderir à mucosa do TGI e formar umabarreira contra a colonização por patógenos.
Os resultados do presente estudo podemindicar exclusão competitiva, mas apopulação de bactérias lácticas não diferiusignificativamente entre os grupos e,portanto, não aumentou a ponto de conseguirsuperar a microbiota natural do habitat emque se encontravam.Vale ressaltar que não foi realizado umestudo qualitativo, e não se sabe se umadeterminada cepa das bactérias ácidolácticasutilizadas obteve crescimentomelhor que outras, sendo responsável pelaação benéfica ao hospedeiro, seja pela produção de substâncias antimicrobianas oupor competição por sítios de ligação namucosa do TGI.Silva (2006) utilizando diferentesprobióticos como bactérias ácido-lácticas,Bokashi e antibióticos promotores decrescimento, também observou que nãohouve aumento da população de bactériaslácticas entre os grupos controle e teste.Porém, na ocasião, o único tratamento queobteve contagem menor de enterobactériasfoi o que utilizou bactérias lácticas naalimentação, todos os outros obtiveramcontagens maiores que o controle.
Com relação às contagens deClostridium sp. obtidas nos intestinos ececos de frangos de corte, os resultados sãomostrados na Tabela 4.
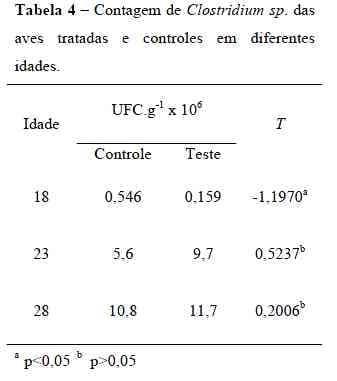
De acordo com estes resultados, sóhouve diferença significativa na contagemde Clostridium sp. entre os grupos controle eteste em aves aos 18 dias de idade.Segundo Gomes (2007), a maiorprevalência de acometimento das aves porespécies de Clostridium está entre a 2ª e 4ªsemana de vida das mesmas, tornando oresultado deste estudo benéfico no períodode maior predisposição ao agente emquestão. Entretanto, com o avanço da idade, acontagem de Clostridium sp. do grupo testetornou-se maior que a do grupo controle, oque não afirma que não houve controle declostrídios, pois o aumento da colonizaçãopor bactérias ácido-lácticas pode terinfluenciado no aumento da colonização porClostridium sp. para equilíbrio da flora, oque só poderia ser afirmado com análisesqualitativas, não realizadas nesteexperimento.Além disso, em aves doentes, elevadascontagens microbianas (108 UFC/g) sãoencontradas. Em contrapartida, para avessaudáveis, contagens baixas (0 a105 UFC/g)são consideradas normais (Broussard et al.,1986), situação em que se enquadram asaves deste estudo.
Outro fator a ser considerado é a dietautilizada, sendo neste experimento compostade sorgo e trigo. Riddell e Kong (1992), ao estudarem a influência da dieta na enteritenecrótica em aves, demonstraram o tipo dealimento utilizado na composição da raçãoser um fator extrínseco correlacionado àincidência da doença que tem como agenteao microorganismo Clostridium perfringens.As lesões da enterite são mais freqüentescom dietas compostas de ingredientes debaixa digestibilidade e ricas empolissacarídeos insolúveis, como centeio,trigo e cevada. O estímulo à secreção demuco, desencadeado por estes tipos dealimentos, favorece a colonização doClostridium perfringens pela sua atividademucolítica intensa (Collier et al., 2003).
Diversos fatores podem prejudicar oubeneficiar o desenvolvimento da floraintestinal. Entre esses fatores estão o uso deantibióticos, promotores de crescimento,estresse fisiológico, radiação, alteração doperistaltismo do trato gastrointestinal emudança da dieta (Hawrelak e Myers, 2004).Segundo Silva et. al. (1999), ospromotores de crescimento não atuam deforma uniforme contra as bactérias.
4 CONCLUSÃO
Os resultados permitem concluir quenesse experimento a adição de probiótico naração de aves levou a uma diferençasignificativa no pH do papo dos animais e pode ser utilizado no tratamento preventivo ainfecções bacterianas. Apesar de não haverdiferença estatística, em todas as idades, asaves tratadas apresentaram um peso maiorque o controle, o que para a indústria poderepresentar um lucro adicional. O controlede enterobactérias observado no grupo testepode ser um indício da exclusão competitivarealizada pelas bactérias lácticas, inibindo ocrescimento das enterobactérias presentes notrato gastrintestinal. Porém, o mecanismo deação precisa ser melhor investigado emfuturas pesquisas. Não foi evidenciado ocontrole efetivo da população de Clostridiumsp. nas condições em que foi realizado esteestudo, o que pode ser verificado utilizandoseoutra metodologia.
5 AGRADECIMENTOS
Ao Conselho Nacional deDesenvolvimento Científico e Tecnológico(CNPq) pela Bolsa de Iniciação Científicaconcedida (Projeto E- 018/2007).
6 REFERÊNCIAS BIBLIOGRÁFICAS
ARAÚJO, J. A; SILVA, J. H. V;AMÂNCIO, A. L. L. et. al. Uso de aditivosna alimentação de aves. Acta VeterinariaBrasílica, v.1, n.3, p.69-77, 2007.
BOEKHORST, J.; SIEZEN, R. J.;ZWAHLEN, M.; VILANOVA, D. et. al. Thecomplete genomes of Lactobacillusplantarum and Lactobacillus johnsoniireveal extensive differences in chromosomeorganization and gene content.Microbiology, v. 150, p. 3601-3611, 2004.
BRASIL. Ministério da Agricultura,Pecuária e Abastecimento. Portaria nº 11, de09/01/2004. Disponível em:http://www.agricultura.gov.br. Acesso em:11 de agosto de 2007.
BROUSSARD, C. T.; HOFACRE, C. L.;PAGE, R. K.; FLETCHER, O. J. Necroticenteritis in cage-reared commercial layerpullets. Avian Disease, v. 30, n. 3, p. 617-619, 1986.
CAMPOS, D.M.B. et al. Níveis de inclusãode probiótico sobre o desempenho defrangos de corte. Revista Brasileira deCiência Avícola, Campinas, v. 4, supl. 4, p.36, 2002.
CARLI, E. M. Utilização de Lactobacillusparacasei como Probiótico para Controle de Salmonella spp em Frangos de Corte,Dissertação (Tese de mestrado em Ciência eTecnologia em alimentos), UniversidadeFederal de Santa Maria, Rio Grande do Sul,2002.
DE VUYST, L. & VANDAME, E. J.Bacteriocins of latic acid bacteria.Microbiology, genetics and application.New York : Chapman & Hall, 1994, p. 91-142.
EHRMANN, M. A., KURZAK, P., BAUER,J.; VOGEL, R. H. Characterization oflactobacilli towards their use as probioticadjuncts in poultry. Journal of AppliedMicrobiology, Oxford, v.92, p. 966-975,2002.
EWING, W. N., D. J. A. COLE. 1994. TheLiving Gut: An Introduction to Micro-Organisms in Nutrition. Context Graphics,Dungannon, UK.
FERKET, P.R. Effect of diet gut microfloraof poultry. In: GEORGIA NUTRITIONCONFERENCE, 1., 1990, Atlanta.Proccedings.... Atlanta: Georgia University,1990. P.. 123-129.
FERREIRA, A. P., FERREIRA, C. S. A.Medidas inespecíficas para o controlebacteriano. In: SIMPÓSIO BRASIL SULDE AVICULTURA, 7., 2006, Chapecó.Anais... Chapecó, 2006. P.. 56 -69.
FLEMMING, J. S., FREITAS, R. J. S.,Avaliação do efeito de prebióticos (MOS),probióticos (Bacillus lecheniformes eBacillus subtilis) e promotor de crescimentona alimentação de frangos de corte.Archives of Veterinary Science, v.10, n.2,p.41-47, 2005.
FULLER, R. Probiotics in man and animals.Journal of Applied Microbiology, Oxford,v. 66, p. 365-378, 1989.
FURLAN, R. L.; MACARI, M.;LUQUETTI, B. C. Como avaliar os efeitosdo uso de prebióticos, probióticos e flora deexclusão competitiva. In: SIMPÓSIOTÉCNICO DE INCUBAÇÃO, MATRIZESDE CORTE E NUTRIÇÃO, 5., 2004.
Balneário Camboriú. Anais... BalneárioCamboriú, 2004. P.. 6-28.FURLAN, R. L. Avaliação e uso de pré eprobiótico. In: SIMPÓSIO BRASIL SULDE AVICULTURA, 6., 2005, Chapecó.Anais... Chapecó, 2005. v. 01, p. 58-76.
GOMES, A. M. Isolamento e tipificaçãogenotípica de Clostridium perfringens emfrangos de corte. Dissertação (Tese demestrado em Medicina VeterináriaPreventiva). Universidade Federal de MinasGerais, Belo Horizonte, 2007.
HENRIQUE, A. P. F., FARIA, D. E., et al.Efeito de ácido orgânico, probiótico eantibiótico sobre o desempenho erendimento de carcaça de frangos de corte.In: REUNIÃO ANUAL DA SOCIEDADEBRASILEIRA DE ZOOTECNIA, 35., 1998,Botucatu/SP. Anais... Geratec, 1998. 1 CDROOM.
HAWRELAK, J.A. e MYERS, S.P. Thecauses of intestinal dysbiosis: a review.Anternative Medicine Review, v. 9, p. 179-197, 2004.
HINTON, A. Jr.; BUHR, R.J.; andINGRAN, K.D. Physical, chemical, andmicrobiological changes in the crop ofbroiler chickens subjected to incrementalfeed withdrawal. Poultry Science, v. 79, p.212-218, 2000.
JIN, L. Z.; HO, Y.W.; ABDULLAH, N.;and JALALUDIN, S. Digestive andBacterial Enzyme Activities in Broilers FedDiets . Supplemented with LactobacillusCultures, Poultry Science, v. 79, p.886-891,2000.
JUNQUEIRA, O.M. & DUARTE, K.F.Resultados de pesquisa com aditivosalimentares no Brasil. In: Reunião Anual daSociedade Brasileira de Zootecnia, 42.,2005, Goiânia. Anais... Goiânia: SBZ, 2005.p.169-182.
LANGHOUT, P. Alternativas ao uso dequimioterápicos na dieta de aves: a visão daindústria e recentes avanços. In:CONFERÊNCIA APINCO DE CIÊNCIA ETECNOLOGIA AVÍCOLAS, 2005, Santos,SP. Anais... Santos: Apinco, 2005. p. 21-33.
LILLY, D. M.; STILLWELL, R. H.Probiotics: growth promoting factors produced by microorganisms. Science, v.147, p. 747-748, 1965.
LODDI, P.B. GONZALES, E.; TAKITA,T.S. Morfometria do intestino delgado defrangos de corte suplementados comprobiótico. In: CONFERÊNCIA DECIÊNCIA E TECNOLOGIA AVÍCOLA,1999, Campinas. Suplemento... São Paulo;APINCO, 1999. p.35.
LORENÇON, L.; NUNES, R. V. N.;POZZA, P. C.; POZZA, M. S. S.; APPELT,M. D. & SILVA, W. M. S. Utilização depromotores de crescimento para frangos decorte em rações fareladas e peletizadas. ActaAgriculturae Scandinavica, Section A -Animal Science, v.29, p.151-158, 2007.
MACARI, M. ; FURLAN, R. L. Probióticos.In: CONFERÊNCIA APINCO DECIÊNCIA E TECNOLOGIA AVÍCOLAS,1., 2005, Campinas. Anais... Campinas:FACTA, p. 53-71, 2005.
MACHADO, A. M. B.; DIAS, E. S.;SANTOS, E. C. S. & FREITAS, R. T. F.Composto exaurido do cogumelo Agaricusblazei na dieta de frangos de corte. Revista Brasileira de Zootecnia, v. 36, p.1113-1118, 2007.MATHEW, A. G. et. al. Influence ofweaning age on ileal microflora andfermentation acids in young pigs.Nutritional Research, v. 6, p. 817-827,1996.
MENTEN, J. F. M.; PEDROSO, A. A.Fatores que interferem na eficácia deprobióticos. In: CONFERÊNCIA APINCO2005 DE CIÊNCIA E TECNOLOGIAAVÍCOLAS, 2000, Campinas. Anais...Campinas: FACTA, v. 1, p. 41-52, 2005.
MORAIS, B. M. & JACOB, C. M. A. Opapel dos probióticos e prebióticos na práticapediátrica. Jornal de Pediatria, v. 82,p.189-197, 2006.
MUTUS, R.; KOCABAG, N.; ALP, M.;ACAR, N.; EREN, M. & GEZEN, S. S. Theeffect of dietary probiotic supplementationon tibial bone characteristics and strength inbroilers. Poultry Science, v. 85, p. 1621-1625, 2006.
NURNI E., RANTALA, M. New aspects ofSalmonella infection in broiler production.Nature, v. 241, p.210-211, 1973.
OLIVEIRA, W. F.; CARDOSO, W. M.;MARQUES, L. C. L.; SALLES, R. P. R. et.al. Utilização de diferentes meios de culturapara o isolamento de enterobactérias emamostras fecais de frangos de corteprocedentes de explorações industriais doEstado do Ceará, Brasil. RevistaPortuguesa de Ciências Veterinárias, v.99, p. 211-214, 2004.
PEDROSO, A. A. Estrutura dacomunidade de Bacteria do trato intestinalde aves suplementadas com promotoresde crescimento. Dissertação (Tese deDoutorado em Ciência Animal e Pastagens),Universidade Federal de São Paulo, SãoPaulo, 2003. 103 p.
PEDROSO, A. A.; MENTEN, J. F. M.;LAMBAIS, M. R. The structure of bacteriacommunity in the intestines of newlyhatched chicks. The Journal of AppliedPoultry Research, v. 14, n. 2, p. 232-237,2005.
REYNOLDS, D. Tenants of the last 1.5metres. Microbiologist. Setembro, 2004.Disponível em:http://www.blackwellpublishing.com/Microbiology/pdfs/tenants.pdf. Acesso em:19/09/2007.
RIDDELL, C.; KONG, X. M. The influenceof diet on necrotic enteritis in broilerchickens. Avian Disease, v. 36, n. 3, p. 499-503, 1992.
RUTZ, F; LIMA, G. J. M. M. O uso deantimicrobianos como promotores decrescimento no Brasil. In: CONGRESSOBRASILEIRO DE VETERINÁRIOSESPECIALISTAS EM SUÍNOS -ABRAVES, 10., 2001, Porto Alegre.Anais... Concórdia: Embrapa Suínos e Aves,2001.
SATO R.N., LODDI M.M. & NAKAGHIL.S.O. Uso de antibiótico e/ou probióticocomo promotores de crescimento em raçõesiniciais de frangos. Revista Brasileira deCiência Avícola, v. 4, p. 37, 2002.
SILVA, E. N. Probióticos e prebióticos naalimentação de aves. In: CONFERÊNCIAAPINCO 2000 DE CIÊNCIA ETECNOLOGIA AVÍCOLAS, 2000,Campinas. Anais... Campinas: FACTA, p.241-251, 2000.SILVA, A. B. A. Influência do jejumalimentar, probióticos e antibiótico napopulação de enterobactérias, bactériasácido lácticas, Bacillus e Salmonella sp. emcecos e papos de frangos de corte.Dissertação (Tese de Mestrado em Ciência eTecnologia de alimentos), UniversidadeFederal de São Paulo, São Paulo, 2006.TORTUERO, F. Influence of implantationof Lactobacillus acidophilus in chicks on thegrowth, feed conversion, malabsorption offats syndrome and intestinal flora. PoultryScience, v.52, p.197-203, 1973.
TRABULSI, L.R. E CAMPOS, L.C.Generalidades sobre Enterobactérias. In:Microbiologia, 3ª edição. Editores: L.R.Trabulsi, F. Alterthum, O.F. Gompertz, eJ.A.N. Candeias. Atheneu, São Paulo, 207 -213, 2002.
Tópicos relacionados
Autores:
Junte-se para comentar.
Uma vez que se junte ao Engormix, você poderá participar de todos os conteúdos e fóruns.
* Dados obrigatórios
Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.
Criar uma publicaçãoImuvet
15 de marzo de 2011
Realmente Dr.Paulo seu trabalho é importantissimo nesse momento de restrição ao antibióticos, mas aproveitando seu trabalho gostaria de dizer que existe um produto de exclusão competitiva chamado Broilact, fabricado na Finlandia pelo laboratório Orion que deve ser administrado via spray em incubatório ao pintinhos, uma aplicação é suficiente para a colonização intestinal das aves. Esse produto é uma mistura refinada de bactérias anaeróbicas e outros organismos capazes de crescerem na presença ou ausencia de ar, ele é liofilizado e antes de ser misturado a agua deve-se adicionar o agente de regeneração para proteger as bactérias contra resíduos de cloro ou impurezas da água. Espero que minhas informações sejam de ajuda ao seu trabalho.
grande abraço.
João Luiz de Almeida
9 de marzo de 2011
Caro Dr Paulo
Mais uma vez, o Sr vem mostrando números comprobatórios de uma novidade no nosso setor, o uso de probióticos. Uma coisa é acreditar pela lógica e bom senso de que funciona, outra é fazer a pesquisa, medir, que nos dá condições de trabalhar com pé no chão, favorecendo o mundo no quesito saúde, com diminuição do uso de antibióticos.
Gostaria de tirar uma dúvida. Nos humanos, o Probiótico está totalmente consolidado, mas eles usam na forma liquida e refrigerada, que são na maioria deles, os iogurtes com Bifidobacterium e Lactobacillus. Pois bem, na área de animais de produção são oferecidos pelo mercado produtos liofilizados, e pelo que sei, o processo de liofilização, passa por congelamento e sublimação, causando injúrias nas bactérias probióticas, diminuindo sua energia, e naturalmente sua eficiência.
1 - O Sr acha que liqudo pode funcionar melhor do que liofilizado ?
2 - O Sr acredita que colocar na ração é melhor do que na água, devido uso de cloro, diferenças de pH da água matando parte ou a totalidade das bactérias Probióticas ?
3 - Comparando com humanos, é recomendado o uso diário para obter eficiência, e nos animais são recomendados tratamentos apenas em dias de maior stress, o que o Sr acha ?
4 - Será que esses fatores acima são os motivos para alguns ainda não verem os probióticos funcionarem ?
Grande abraço
Att
Dario Filho









