INTRODUÇÃO
A criopreservação de oócitos bovinos oferece uma série de vantagens, como a preservação de material para o estabelecimento de bancos genéticos, para uso futuro, além de proporcionar a otimização do aproveitamento de gametas femininos, eliminados pelos fenômenos fisiológicos da reprodução. Associado a isto, a criopreservação de embriões produzidos in vitro (PIV) representa uma ferramenta indispensável para dinamizar e difundir o processo de PIV. Embora a criopreservação de embriões produzidos in vitro já seja utilizada, a criopreservação de oócitos ainda não apresenta resultados satisfatórios para seu emprego associado à PIV. A baixa viabilidade de oócitos criopreservados é explicada pelo fato dos mesmos serem uma célula única, com grande tamanho, alta relação volume/superfície, presença de uma membrana simples, sensibilidade dos fusos metafásicos ao resfriamento, presença da zona pelúcida, além das muitas camadas de células da granulosa que formam o complexo cumulus-oócito (14, 23). Como conseqüência, até o momento, apenas um pequeno número de bezerros nascidos é originado da fecundação de oócitos criopreservados.
O resfriamento de oócitos até 24°C não altera a formação dos fusos meióticos, porém o resfriamento a 4°C ou menos, por apenas 10 minutos, reduz drasticamente a formação de fusos normais e a taxa de fecundação (28) sendo que, nos bovinos, os fusos meióticos não se restauram completamente com o reaquecimento. Já no précongelamento, alterações como a dispersão cromossômica, despolimerização dos microtúbulos e modificações na estrutura dos fusos, demonstram que o congelamento lento causa alterações irreversíveis em múltiplos componentes citológicos, evidenciando a necessidade de novas estratégias para prevenir estas lesões. Dentro deste contexto, avanços foram obtidos, resultando na produção de 11 a 25% de blastocistos, quando a velocidade de resfriamento foi aumentada, através da utilização de grades metálicas utilizadas na microscopia eletrônica e submergindo-as diretamente em nitrogênio líquido ou com palhetas estiradas (OPS), as quais permitem uma velocidade de congelamento e descongelamento de aproximadamente 20.000°C/minuto.
Embora os resultados obtidos após a criopreservação de embriões bovinos produzidos in vitro (PIV) sejam superiores aos obtidos com oócitos, existe uma clara evidência que os mesmos apresentam comportamento distinto em relação aos obtidos in vivo. Uma série de fatores determina o aumento da sensibilidade ao congelamento dos embriões PIV, como a menor compactação de mórulas, a maior quantidade de lipídios, principalmente nos estágios iniciais e uma menor densidade "buoyant", em comparação aos embriões produzidos in vivo. A mudança na produção de CO2, antes e após a criopreservação de embriões produzidos in vitro e in vivo, revelou que embriões produzidos ou somente cultivados in vitro são mais sensíveis às lesões causadas pela criopreservação.
Após tratamento de mórulas e blastocistos iniciais com citocalasina foram obtidos melhores resultados na vitrificação. Em concentrações de 5 e 7,5mg/mL, além de impedir a polimerização da tubulina, a micotoxina se liga a outras proteínas determinando um efeito estabilizador do citoesqueleto, aparentemente por aumento da elasticidade das estruturas. A elevação da dose pode determinar uma melhor adaptação citoesquelética durante a vitrificação, aumentando a resistência aos danos da criopreservação. Doses mais elevadas poderiam proporcionar maior flexibilidade das membranas durante o congelamento, proporcionando maior sobrevivência das células ao processo, sendo que a exposição a concentrações de até 45μg/mL de citocalasina B não reduziram as taxas de fecundação e desenvolvimento embrionário, de oócitos maturados. Com este embasamento, torna-se oportuno avaliar o emprego de concentrações mais elevadas de citocalasina B no processo de vitrificação de oócitos e embriões bovinos, com a utilização da metodologia OPS. No presente estudo, foi avaliado o efeito da citocalasina B na vitrificação de oócitos maturados in vitro e blastocistos bovinos produzidos in vitro.
MATERIAL E MÉTODO
Meios e soluções
O meio utilizado para a manutenção dos oócitos e embriões durante os procedimentos foi o TCM-199, sais de Earle (Gibco BRL 31100-027) adicionado de 0,168mg/mL de bicarbonato de sódio, 6,5mg/mL HEPES sais de sódio, 0,22mg/ mL piruvato de sódio além de penicilina e estreptomicina, sendo corrigido o pH para 7,3 e a osmolaridade para 280-285 mOsm, sendo denominado TCM-HEPES. O meio de maturação foi preparado com TCM-199, acrescido de 2,2mg/mL de bicarbonato de sódio, 5,96mg/ mL de Hepes, 2,2μg/mL de piruvato de sódio 0,01UI de rFSH/mL (Serono; L1930300), 0,5mg/mL LHb (USDA; AFP-11743-B), 10% de soro de vaca em estro (SVE).
Para a vitrificação foram utilizadas uma solução de equilíbrio e uma de vitrificação. A solução de equilíbrio (SV1) foi preparada com 400μl de meio de TCM-HEPES, 10% de soro fetal (SF), 50μl de etilenoglicol e 50μl de DMSO. A de vitrificação (SV2) foi preparada com 300μl de solução de trealose adicionada de 20% SF, 100μl de etilenoglicol e 100μl de DMSO. A reidratação foi conduzida em duas etapas. A primeira solução (TREA 0,3) foi preparada com Trealose 0,3M em TCM-HEPES com 10% SF e a segunda (TREA 0,15) com Trealose 0,15M em TCMHEPES com 10% SF.
Salvo onde indicado, todos os produtos químicos utilizados para a preparação das soluções foram adquiridos da Sigma Chemical Co., St Louis, MO, USA.
Maturação, fecundação e produção in vitro dos embriões
Ovários bovinos foram obtidos de animais de abatedouro e transportados em solução fisiológica 0,9% (w/ v) de NaCl à temperatura de 35oC. Os complexos cumulusoócitos (CCOs) foram aspirados com auxílio de uma bomba de vácuo, de folículos com diâmetro entre 2 e 8 mm, utilizando-se uma agulha 18G, acoplada a um tubo de ensaio com capacidade de 15mL. Após a punção, o líquido folicular aspirado permaneceu por 10 minutos no tubo para decantação, sendo em seguida removido o sedimento e depositado em placas de Petri 100 x 15 mm (Falcon; 1012). Os CCOs foram identificados sob estereomicroscópio e a seleção foi efetuada de acordo com critérios descritos anteriormente.
Após a seleção, os oócitos foram depositados em meio de maturação TCM-199. Os mesmos foram distribuídos aleatoriamente em grupos de 25 a 40 oócitos, sendo depositados em placas Nunc (Nunc A/S; Cat.176740) de quatro poços contendo 400ml de meio e mantidos em estufa de cultivo (Heraeus; Alemanha) com 5% de CO2 em ar e umidade saturada, a 39oC por 24h.
A fecundação foi efetuada de 400μl em meio TALPFERT, adicionado de 30μg/mL de heparina, 30μg/mL de penicilinamina, 15μM de hipotaurina e 1μM de epinefrina, em placas de 4 poços Nunc. A inseminação foi realizada com sêmen previamente selecionado, com uma concentração final de 1 x 106 células/mL. A incubação dos oócitos com espermatozóides foi mantida por 18 horas.
Os oócitos/zigotos foram desnudados em 800ml de TCM-HEPES, com auxílio de pipetadores calibrados em 400ml, lavados três vezes e, a seguir, submetidos ao cultivo em 400mL de SOFaaci8, sob óleo mineral, em placas Nunc de quatro poços, em estufa de cultivo a 39ºC, com 5% de CO2 em ar e atmosfera saturada. A clivagem foi avaliada com 24 h, adotando-se a partir daí o cultivo em Bag System, com atmosfera de 5% CO2, 5% O2 e 90% N2, sendo conduzida a segunda avaliação seis dias após.
Experimento I: Criopreservação de oócitos
Após 22 h de maturação, os oócitos foram parcialmente desnudados e, de forma aleatória, submetidos aos diferentes tratamentos. No tratamento 1, os oócitos foram submetidos diretamente a vitrificação (Tratamento Vitri). Os demais oócitos foram depositados em placas contendo 300μl de TCM-HEPES acrescido de 7,5μg/mL (Tratamento CB7,5Vitri) ou 45μg/mL (Tratamento CB45Vitri) de citocalasina B, e permaneceram nesta solução por 15 a 20 minutos. Nos três tratamentos, o procedimento de vitrificação constou da exposição dos oócitos à solução SV1 por 30 segundos, seguida da exposição por 20 segundos à solução SV2, período em que foram envasados em grupos de 4 a 5 em palhetas estiradas (OPS), com um volume aproximado de 1 a 2μL de solução crioprotetora, e submersos em nitrogênio líquido, sem o fechamento das extremidades. O reaquecimento foi realizado pela imersão da parte anterior da palheta em 800μl da solução TREA 0,3, aquecida a 37-38ºC, onde os oócitos foram mantidos por 5 minutos, sendo a seguir, transferidos para a solução TREA 0,15 por mais 5 minutos. Após este período, retornaram ao meio de maturação, até completar 24h. Como controle, foram utilizados oócitos procedentes da mesma manipulação, mantidos apenas no meio de maturação. Foram realizadas 13 repetições, sendo os dados percentuais submetidos à análise de variância, utilizando-se o PROC GLM do SAS. As médias dos tratamentos foram comparadas pelo teste de Tukey, com significância de 5%.
Experimento II : Criopreservação de blastocistos
Blastocistos expandidos, de qualidade excelente ou boa, produzidos in vitro com 7 dias de cultivo, foram distribuídos de acordo com sua qualidade em três tratamentos homogêneos, mantidos em TCM-HEPES. No tratamento Vitri, os embriões foram submetidos a um minuto de exposição à solução SV1, seguido da exposição por 20 segundos à solução SV2, modificada pela substituição da solução de trealose por TCM-HEPES. No tratamento CB45Vitri, os embriões foram expostos por 10 minutos à solução contendo 45μg/mL de citocalasina B e a seguir vitrificados de forma semelhante ao tratamento Vitri. No grupo controle os embriões foram inicialmente mantidos em TCM-HEPES e, em seguida, colocados em cultivo na estufa. Após o descongelamento, realizado com a mesma metodologia empregada para os oócitos, os embriões dos três tratamentos foram recolocados em placas Nunc com meio SOFaaci e cultivados por 72h. Com 4h de cultivo foi avaliada a re-expansão dos embriões vitrificados e com 72h foi avaliada a taxa de eclosão dos três grupos. Dois blastocistos provenientes do grupo de oócitos do tratamento Vitri, foram vitrificados em D7, sendo posteriormente transferidos para receptoras síncrones. Foram realizadas 10 repetições, sendo os dados percentuais submetidos à análise de variância, utilizando-se o PROC GLM do SAS. As médias dos tratamentos foram comparadas pelo teste de Tukey, com nível de significância de 5%.
RESULTADOS E DISCUSSÃO
A sobrevivência ao processo de vitrificação, evidenciada pelos percentuais de clivagem (Tab. 1) obtidos nos tratamentos Vitri (55,0%), CB7,5Vitri (55,5%) e CB45Vitri (55,1%) foram semelhantes aos 47 e 50% de clivagem obtidos por Vajta et al. e aos 50% de sobrevivência, obtidos por Hurtt et al. 9, com idêntica metodologia. Não foram observadas diferenças significativas (P>0,05) entre os tratamentos que, todavia, foram inferiores ao tratamento controle (78,1%). Le Gal & Massip, utilizando a mesma metodologia, porém com glicerol e etileno glicol como crioprotetores, alcançaram 45% de clivagem no controle e apenas 7,9% no grupo vitrificado.
Algumas horas após a remoção do crioprotetor, a maioria dos oócitos tinha um aspecto morfológico íntegro, sendo facilmente identificados aqueles com lesões severas, cujas manifestações mais comuns foram a presença de coloração palha amarelada ou contração do citoplasma, semelhante ao descrito por Martino et al., além de alguns casos de fratura da zona pelúcida.
Os percentuais de embriões em D7 (Tab. 1), observados nos tratamentos Vitri (12,0%), Cito7,5Vitri (7,9%) e Cito45Vitri (8,8%), são baixos, embora o tratamento Vitri esteja muito próximo dos 13% obtidos por Vajta et al. Esses baixos índices podem ser reflexo de lesões proporcionadas durante o processo de vitrificação que, embora não tenham impedido a clivagem, diminuíram a competência destes embriões completarem seu desenvolvimento in vitro, fato já evidenciado anteriormente. Os dois blastocistos obtidos no grupo Vitri e que foram novamente vitrificados e transferidos, resultaram em uma gestação, por palpação retal aos 56 dias.
O desnudamento parcial, necessário à permeação dos crioprotetores em oócitos maturados, é um fator que pode ter influenciado na taxa de blastocistos obtida. Em experimento recente em nosso laboratório (dados não publicados), o desnudamento parcial de oócitos bovinos não resfriados, efetuado com 22h de maturação, determinou uma redução na taxa de blastocistos de 30 para 21%, em contraste ao aumento de 13% para 25% na taxa de blastocistos, após a vitrificação de oócitos bovinos, observado quando o desnudamento passou de 22 para 6h.
Os dados referentes ao efeito de estabilizadores do citoesqueleto na criopreservação de oócitos são escassos, principalmente para a espécie bovina. Maior sobrevivência foi observada para oócitos bovinos tratados com EGTA, embora a clivagem tenha sido baixa (0 a 18%) em todos os grupos. Com oócitos de macacos, a utilização de EGTA ou citocalasina proporcionou um aumento na sobrevivência de 50 para 78%, após criopreservação sugerindo que o emprego desses estabilizadores pode melhorar a sobrevivência à criopreservação. Entretanto, o efeito benéfico da citocalasina B, na vitrificação de oócitos bovinos, não foi confirmado no presente estudo, independente das concentrações utilizadas, visto as taxas de clivagem e desenvolvimento embrionário semelhantes para os grupos vitrificados com ou sem a presença dessa substância.
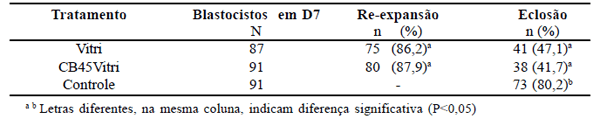
No experimento II, o elevado percentual de reexpansão com quatro horas de cultivo, denota a alta sobrevivência dos embriões ao processo, não sendo observadas diferenças significativas entre os embriões dos tratamentos Vitri e CB45Vitri (Tab. 2). Estes resultados são semelhantes aos 84 e 70% e 75 e 62% de re-expansão, para blastocistos em D7 e D8, respectivamente, observados por outros autores. Quando se avaliou a taxa de eclosão (Tab. 2), não foram observadas diferenças significativas (P>0,05) entre os tratamentos Vitri e CB45Vitri.
Diferentes protocolos de vitrificação têm proporcionado bons resultados na criopreservação de embriões bovinos PIV, observando-se uma grande variabilidade de resultados, em função de pequenas alterações da técnica, dos componentes das soluções ou do estágio de desenvolvimento embrionário. Martinez et al. obtiveram taxas de desenvolvimento e eclosão, respectivamente de 56 e 35% com solução etileno glicol/ ficoll/sacarose e 33% e 13%, com propileno glicol/glicerol. Tachikawa et al. obtiveram 74 a 77% de re-expansão após vitrificação de blastocistos bovinos em etileno glicol, com 70% de prenhez após transferência. Saha et al., após vitrificação de blastocistos em etileno glicol, obtiveram taxa de eclosão de 3%, que aumentou para 31% com a adição de 0,3M trealose e para 43% com a incorporação de 20% de PVP, à solução crioprotetora. Num segundo experimento, os autores observaram maior taxa de eclosão com embriões vitrificados em D7 (75%), em comparação com os obtidos em D8 (38%) ou D9 (9%), demonstrando que, dentro de um mesmo estágio de desenvolvimento, os mais precoces proporcionam melhores resultados na vitrificação (12, 25).
Os resultados de clivagem e desenvolvimento embrionário, obtidos após vitrificação de oócitos bovinos, com ou sem tratamento com citocalasina, no experimento I (Tab. 1), confirmam observações anteriores de que a citocalasina não possui efeitos deletérios sobre a viabilidade de oócitos bovinos submetidos a FIV, ou oócitos de suínos. Pela ausência de diferenças significativas nas taxas de reexpansão e eclosão dos blastocistos, no experimento II (Tab. 2) do presente estudo, também pode-se dizer que a citocalasina não afeta a progressão do desenvolvimento dos blastocistos vitrificados. Entretanto, o efeito benéfico da citocalasina B na vitrificação de embriões bovinos, não foi confirmado no presente estudo. Estes autores realizaram seus experimentos com embriões em estágios mais precoces (mórulas e blastocistos iniciais) e produzidos in vivo, os quais apresentam diferenças morfológicas e fisiológicas importantes em relação aos produzidos in vitro. Taxa de eclosão superior foi obtida com blastocistos e blastocistos expandidos (63%) em relação aos blastocistos iniciais (34%) bovinos. Na espécie suína a citocalasina B não melhorou a viabilidade de mórulas e blastocistos iniciais de suínos, após vitrificação, embora tenha melhorado significativamente a viabilidade de blastocistos expandidos e/ou eclodidos. Estas informações mostram que, além da espécie, o estágio de desenvolvimento também pode determinar variações nos resultados de vitrificação. Desta forma, embora seja possível que a citocalasina B tenha uma ação benéfica durante a vitrificação de embriões produzidos in vivo, mesmo em estágios mais precoces de desenvolvimento, de estágios mais tardios de embriões suínos ou, mesmo, oócitos imaturos de suínos, os resultados obtidos nos experimentos, do presente estudo, indicam que a citocalasina B não melhora a sobrevivência ao processo de vitrificação, de oócitos ou blastocistos bovinos produzidos in vitro, independentemente da concentração utilizada.
Tabela 1. Desenvolvimento embrionário de oócitos bovinos submetidos a diferentes concentrações de citocalasina B, vitrificados e fecundados in vitro
Tabela 2. Taxas de re-expansão e eclosão de blastocistos bovinos PIV e vitrificados com e sem Citocalasina B
REFERÊNCIAS
1. AMAN, R.R.; PARKS, J.E. Effects of cooling and rewarming on the meiotic spindle and cromosomes of in-vitro matured bovine oocytes. Biology of Reproduction, v.50, p.103-110. 1994.
2. De LOOS F., VAN IET, C., VAN MAURIK, P., et al. Morphology of immature bovine oocyte. Gamete Research, v.24, p.197-204, 1989.
3. DOBRINSKY, J.R.; OVERSTROM, E.W.; DUBY, R.T. et al. Effect of cytoskeletal stabilization on the development of bovine embryos cryopreserved by vitrification. Theriogenology, v.43, p.199,1995. Abstract.
4. DOBRINSKY, J.R. Cellular approach to cryopreservation of embryos. Theriogenology, v.45, p.17-26, 1996.
5. DOBRINSKY, J.R.; PURSEL, V.G.; LONG, C.R. et al. Birth of piglets after transfer of embryos cryopreserved by cytoskeletal stabilization and vitrification. Biology of Reproduction, v.62, n.3, p.564-70, 2000.
6. GREVE, T.; AVERY, B.; CALLESEN, H. Viability of in-vivo and in-vitro produced bovine embryos. Reproduction of Domestic Animals, v.28, p.164-69, 1993.
7. HOCHI, S.; ITO, K.; HIRABAYASHI, M. et al. Effect of nuclear stages during IVM on the survival of vitrified-warmed bovine oocytes. Theriogenology, v.49, n.4, p.787-96, 1998.
8. HOLM, P.; BOOTH, P.J.; SCHMIDT, M.H. et al. High bovine blastocysts development in a static in vitro production system using SOFaa medium supplemented with sodium citrate and myo-inositol with or without serum-proteins. Theriogenology, v.52, p.683-700, 1999.
9. HURTT, A.E.; LANDIM-ALVARENGA, F.; SEIDEL Jr., G.E. et al. Vitrification of immature and mature equine and bovine oocytes in an ethylene glycol, ficoll and sucrose solution using open pulled straws. Theriogenology, v.54, n.1, p.119-28, 2000.
10. ISACHENKO, V.; SOLER, C.; ISACHENKO, E. et al. Vitrification of immature porcine oocytes: effects of lipid droplets, temperature, cytoskeleton, and addition and removal of cryoprotectant. Cryobiology, v.36, n.3, p.250-3, 1998.
11. KHURANA, N.K.; NIEMANN, H. Effects of cryopreservation on glucose metabolism and survival of bovine morulae and blastocysts derived in vitro or in vivo. Theriogenology, v.54, p.313-26, 2000.
12. LAZAR, L.; SPAK, J.; DÁVID, V. The vitrification of in vitro fertilized cow blastocysts by the open pulled straw method. Theriogenology, v.54, p.571-78, 2000.
13. Le GAL, F.; MASSIP, A. Development of thawed oocytes fertilized in vitro after vitrification by the Open Pulled Straw method before or after in vitro maturation. In: Gametes: Development and Function, Lauria, A; Gandolfi, F. Editors, Milano,1998, p.554.
14. Le GAL, F.; MASSIP, A. Cryopreservation of cattle oocytes: Effects of meiotic stage, cicloheximide treatment, and vitrification procedure. Cryobiology, v.38, p.290-300, 1999.
15. LEIBO, S.P.; POLLARD, J.W.; MARTINO, A. Chilling and freezing sensitivity of "reassembled" in vitro-derived bovine embryos. Theriogenology, v.43, n.1, p.265, 1995. Abstract.
16. MARTINEZ, A.G.; MATOS, D.G.; FURNUS, C.C. et al. In vitro evaluation and pregnancy rates after vitrification of in vitro produced bovine embryos. Theriogenology, v.50, n.5, p.757-67. 1998.
17. MARTINO, A.; SONGSASEN,N.; LEIBO, S.P. Development into blastocysts of bovine oocytes cryopreserved by ultra-rapid cooling. Biology of Reproduction, v.54, p.1059-1069. 1996.
18. MEZZALIRA, A.; FAVA,R.C.; BARBIERI, D.P. et al. Desenvolvimento de oócitos bovinos submetidos a FIV após exposição a doses crescentes de Citocalasina B. Arquivos da Faculdade de Veterinária da UFRGS, v.28, Supl.1, p.294, 2000. Abstract.
19. PALMA, G.A.; OLIVIER, N.; ALBERIO, R.H. et al. Effect of a bag system on the development capacity and viability of in vitro produced bovine embryos. In: SCIENTIFIC MEETING A.E.T.E. 14, Venice, 11-12 Sept 1998. Anais... p.228, 1998.
20. POLLARD, J.W.; LEIBO, S.P. Comparative cryobiology of in vitro and in vivo derived bovine embryos. Theriogenology, v.39, n.1, p.287, 1993. Abstract.
21. SAHA, S.; RAJAMAHENDRAN, R.; BOENDIONO, A. et al. Viability of bovine blastocysts obtained after 7, 8 or 9 days of culture in vitro following vitrification and one-step rehydration. Theriogenology, v.46, n.2, p.331-43, 1996.
22. SAUNDERS, K.M.; PARKS, J.E. Effects of cryopreservation procedures on the cytology and fertilization rate of in-vitro matured bovine oocytes. Biology Reproduction, v.61, p.178-187, 1999.
23. SHAW, J.M.; ORANRATNACHAI, A.; TROUSON, A.O. Fundamental cryobiology of mammalian oocytes and ovarian tissue. Theriogenology, v.53, n.1, p.59-72, 2000.
24. TACHIKAWA, S.; OTOI, T.; KONDO, S. et al. Successful vitrification of bovine blastocysts, derived by in vitro maturation and fertilization. Molecular Reproduction and Development, v.34, p.266-271, 1993.
25. VAJTA, G.; HOLM, P.; GREVE, T., et al. Overall efficiency of in vitro embryo production and vitrification in cattle. Theriogenology, v.45, p.683-89, 1996a.
26. VAJTA, G.; HOLM, P.; GREVE, T. et al. Factors affecting survival rates of in vitro produced bovine embryos after vitrification and direct in-straw rehydration Animal Reproduction Science, v.45, p.191-200, 1996b.
27. VAJTA, G.; HOLM, P.; KUWAYAMA, M. et al. Open pulled straw (OPS) vitrification: A new way to reduce cryoinjuries of bovine ova and embryos. Molecular Reproduction and Development, v.51, p.53-58, 1998.
28. WU, B.; TONG, J.; LEIBO, S.P. Effect of chilling bovine germinal vesicle-stage oocytes on formation of microtubules and the meiotic spindle Theriogenology, v.49, n.1, p.177, 1998.
29. YOUNIS, A.I.; KESKINTEPE, L.; SIMPLICIO, A.A. et al. Effects of EGTA and citochalasin-B during freezing and vitrification of immature and mature bovine and Rhesus monkey (M. mulatta) oocytes. Theriogenology, v.47, n.1, p.361,1997.