INTRODUÇÃO
Os grãos de milho podem ter sua qualidade comprometida direta ou indiretamente pela infecção fúngica e pela produção de micotoxinas, que ocasionam danos à saúde tanto humana quanto animal1,2.
Geralmente, a infecção e a deterioração dos grãos podem ocorrer ainda no campo, agravando-se durante as operações de colheita, transporte, secagem, beneficiamento e armazenamento, resultando na redução da qualidade sanitária, física e nutricional dos grãos e seus derivados3,4. Entre os prejuízos causados pelos fungos está o emboloramento visível, a descoloração, o odor desagradável, a perda de matéria seca, o aquecimento, as mudanças químicas e nutricionais, além da produção de compostos tóxicos, as micotoxinas3,5. Essa contaminação pode fazer com que grãos tornem-se impróprios para o consumo humano e animal, resultando em grandes perdas econômicas.
Dentre os vários fungos responsáveis pela deterioração de grãos na pré-colheita e, depois, durante o armazenamento, destacam-se os do gênero Fusarium spp., Aspergillus spp. e Penicillium spp. Esses fungos, além de causarem severos danos aos grãos, são conhecidos também pelo seu elevado potencial em produzir micotoxinas6.
As micotoxinas são metabólitos secundários tóxicos produzidos por fungos filamentosos, que, quando ingeridos, são prejudiciais à saúde humana e animal, além de apresentarem elevada atividade mutagênica, carcinogênica e teratogênica9,10.
Para a agricultura, já foram identificadas mais de quinhentas micotoxinas11. Entretanto, as de maior importância são responsáveis pelos maiores índices de contaminação de grãos, sementes e outros alimentos, como: as aflatoxinas, produzidas por fungos do gênero Aspergillus, como A. flavus e A. parasiticus; as ocratoxinas, produzidas por algumas espécies do gênero Aspergillus e Penicillium, e as fusariotoxinas, que possuem como principais representantes os tricotecenos, a zearalenona e as fumonisinas, produzidas por diversas espécies do gênero Fusarium4,11.
Os fungos toxigênicos em alimentos, em particular de maior prevalência no milho, apontam a predominância dos fungos dos gêneros Fusarium, Aspergillus e Penicillium2,6,12. Os principais fatores que favorecem o crescimento desses micro-organismos em cereais armazenados são: alta umidade relativa do ar, teor de água do substrato e temperatura de armazenamento3,4,11.
Com a abertura do mercado chinês e de outros mercados para importação de carne suína e de aves, com um controle de qualidade mais rígido pelas indústrias com a matéria-prima utilizada, pesquisas avaliando a contaminação fúngica e a produção de micotoxinas em grãos e alimentos são importantes para que sejam tomadas medidas para prevenção desta infecção, evitando riscos alimentares.
O presente trabalho teve por objetivo identificar e quantificar a incidência de fungos e verificar a ocorrência de aflatoxinas em grãos de milho armazenados, provenientes de diferentes municípios, localizados nas regiões Norte, Sul, Leste e Oeste do estado de Mato Grosso.
MATERIAL E MÉTODOS
Coleta das Amostras
Foram avaliadas 84 amostras de grãos de milho, provenientes de unidades armazenadoras de diferentes municípios das regiões Norte, Sul, Leste e Oeste do estado de Mato Grosso, referente às safras 2009 e 2010. Essas unidades foram selecionadas por representarem a capacidade média estática de cada município.
O processo de amostragem foi baseado em normas estabelecidas pelo Ministério da Agricultura Pecuária e Abastecimento (MAPA) para grãos de milho armazenados a granel. Amostragens foram realizadas após as etapas de limpeza e secagem, quando os grãos já apresentavam o período de trinta dias de armazenamento, com o auxílio de um calador e em vários pontos da massa de grãos. As amostras coletadas, de 5,0 kg cada, foram homogeneizadas e divididas em frações de 1,0 kg, as quais foram acondicionadas em sacos de papel craft, identificadas e enviadas ao laboratório para análises posteriores. Essas amostras foram armazenadas em câmara fria, a ±17 °C e 50% UR, durante todo o período de condução dos experimentos.
Todas as amostras, antes de serem armazenadas em câmara fria, já apresentavam teores de água considerados seguros para o armazenamento de grãos de milho, abaixo de 13%.
Identificação fúngica dos grãos de milho
A microbiota fúngica dos grãos foi determinada pelo teste de sanidade, pelo método de incubação em papel filtro (Blotter Test), segundo a metodologia proposta por Neergaard, modificada, com restrição hídrica por Machado et al.13. Para cada amostra de milho, foram utilizadas 8 subamostras de 25 grãos. Esses grãos foram desinfestados superficialmente com hipoclorito de sódio a 2% por dois minutos e lavados em água destilada esterilizada. Em seguida, os grãos foram colocados de forma equidistantes em placas de Petri, contendo duas folhas de papel de filtro umedecidas com solução de cloreto de sódio (NaCl) a -1,0 MPa. As placas foram incubadas em temperatura de 22 ± 2 °C, por sete dias, em câmara de germinação. A identificação dos fungos foi realizada com auxílio de microscópios ótico e estereoscópico, e a quantificação de sua incidência foi expressa em porcentagem.
Os dados de quantificação dos fungos foram submetidos aos testes de Lilliefors (p < 0,05), para verificar se os valores seguiram a distribuição normal, e de Cochran e Bartlett (p < 0,05), para verificar a homogeneidade de variâncias. As médias foram submetidas a análise de variância e comparadas estatisticamente pelo teste de Scott & Knott (p < 0,05) utilizando o software SAEG 5.0.
Detecção e quantificação de aflatoxinas totais em grãos de milho
A extração e a quantificação das aflatoxinas (B1, B2, G1 e G2) foram feitas segundo Mallmann et al.14. As aflatoxinas foram quantificadas e identificadas pela metodologia automatizada de extração e purificação em fase sólida e de derivação com auxílio de um sistema automatizado de amostras (ASPEC XL) acoplado a cromatografia líquida de alta eficiência (CLAE).
A extração foi realizada juntando-se 50 gramas de amostra moída com 100 mL de acetonitrila/água por 5 minutos em liquidificador a 13.600 rpm. Posteriormente, filtrou-se a solução em papel filtro nº 4 e fez-se a secagem de 5 mL com vácuo a 65 °C em tubo de ensaio. Rediluiuse o substrato com 500 μL de acetonitrila/água (84:16 v/v), levando-o ao ASPEC XL programado para realizar a clarificação das amostras. A fase móvel foi composta de água/metanol/acetonitrila (77:21:2 v/v/v) com fluxo de 1 mL por minuto; a coluna cromatográfica RP C18 5 μm (150 × 4,6 mm) em temperatura constante de 45 °C e detecção sob fluorescência com comprimento de onda de 365 e 455 nm para excitação e emissão, respectivamente. O registro cromatográfico era computadorizado e integrado pelo programa Borwin. A identificação das toxinas foi realizada pelo tempo de retenção, e a quantificação, realizada pela área das toxinas. A eluição das aflatoxinas G1, B1, G2 e B2 ocorreu aos 5, 7, 12 e 17 minutos, com limites de quantificação de 0,7, 0,4, 1,3 e 0,4 μg/kg, e coeficiente de recuperação de 101,2%, 93,2%, 58,9% e 63,2%, respectivamente.
RESULTADOS E DISCUSSÃO
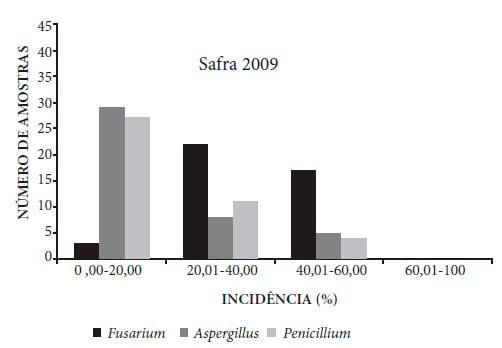
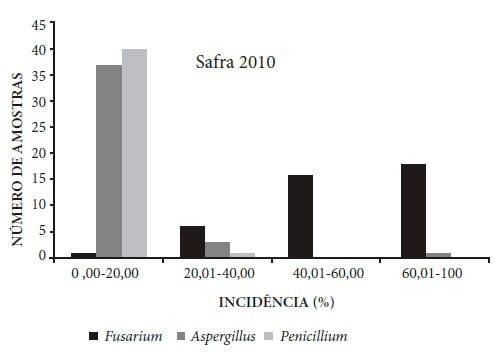
A identificação dos patógenos revelou uma porcentagem de grãos com incidência fúngica variando de 0% a 100%, em ambas as safras 2009 e 2010 (Figuras 1 e 2), prevalecendo Fusarium, Aspergillus e Penicillium como gêneros mais importantes envolvidos na produção de micotoxinas.
Figura 1. Incidência fúngica em 42 amostras de grãos de milho provenientes de diferentes municípios do estado de Mato Grosso, safra 2009.
Figura 2. Incidência fúngica em 42 amostras de grãos de milho provenientes de diferentes municípios do estado de Mato Grosso, safra 2010.
Outros trabalhos avaliando a microbiota fúngica e espécies produtoras de micotoxinas em grãos de milho em diferentes regiões do Brasil apontaram a predominância dos mesmos gêneros5,15-19. Os fatores abióticos, tais como o teor de umidade nos grãos de milho, a atividade de água, a precipitação e a temperatura do ar foram determinantes para o nível da incidência fúngica.
Além da incidência de Fusarium spp., Aspergillus spp. e Penicillium spp., em menor proporção viu-se a incidência de fungos dos gêneros Cladosporium, Nigrospora, Epicoccum, Rhizopus, Cercospora e Curvularia nas amostras das safras 2009 e 2010.
De acordo com as Figuras 1 e 2, também pode-se notar uma variação na incidência entre os três gêneros de fungos. As análises dos grãos de milho das safras 2009 e 2010 evidenciaram que a incidência de Aspergillus e Penicillium ficou concentrada nas faixas de 0-20% e 20- 40% de contaminação, respectivamente. Para Fusarium, a incidência ficou concentrada na faixa de 20-40% e 40-60% (safra 2009) e 40-60% e 60-100% (safra 2010), indicando um potencial de contaminação relativamente maior das amostras por este gênero.
O Fusarium é considerado um fungo de campo, que invade os grãos e sementes durante o amadurecimento, em que as condições de temperatura e umidade são mais elevadas, favoráveis para seu desenvolvimento. Entretanto, não se desenvolvem durante o armazenamento, exceto ocasionalmente em grãos de milho armazenados com alto teor de umidade e/ou que foram reumidificados20. Como as amostras já apresentavam um teor de água considerado seguro para o armazenamento, a contaminação por Fusarium ocorreu ainda no campo, o que justifica a incidência desse gênero.
A maior incidência do gênero Fusarium, seguido de Aspergillus e Penicillium, em grãos de milho foi evidenciada também em outras pesquisas5,15,19, diferindo de outras investigações em que a ordem de incidência desses três gêneros e a proporção de contaminação verificadas foram outras, como demonstram os trabalhos de Adebajo et al.21, Asêvedo et al.22, Pozzi et al.23 e Orsi et al.16.
Os fungos dos gêneros Aspergillus e Penicillium são considerados fungos de armazenamento, que necessitam de teores de umidade entre 13% e 18%, sendo sua incidência pouco frequente durante o crescimento da planta no campo e nos grãos recém-colhidos3,4,24. As amostras da safra 2009 e 2010 apresentaram contaminação por esses gêneros, sugerindo que os mesmos possam ter contaminado os grãos ainda no campo, já que as amostras armazenadas apresentavam teores de água desfavoráveis para seu desenvolvimento. A presença desses fungos são indicadores de deterioração de sementes e grãos, além da possibilidade de produção de micotoxinas25,26.
A identificação de espécies fúngicas contaminantes é um importante sinalizador da presença de micotoxinas nos substratos e indica o caminho para prevenir sua produção23, assim como para evitar riscos alimentares.
Aflatoxinas
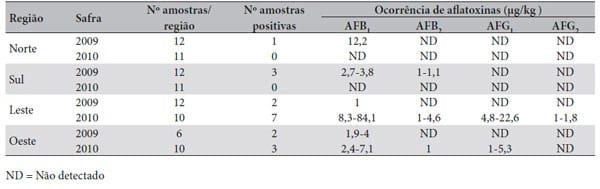
Os resultados das análises de aflatoxinas (B1+B2 +G1 + G2) nas 84 amostras de grãos de milho das diferentes regiões do estado de Mato Grosso mostraram 21,4% de contaminação positiva para aflatoxinas (Tabela 1).
Na safra 2009, foi detectada a presença de aflatoxinas totais em 8,3% das amostras da região Norte, 25% da região Sul, 16,7% da região Leste e 33,33% da região Oeste. Os níveis de contaminação variaram de 1 a 12,2 μg/kg de aflatoxina B1, de 1 a 1,1 μg/kg de aflatoxina B2 e as aflatoxinas G1 e G2 não foram detectadas. Em todas as regiões, a soma dos níveis de aflatoxinas observadas (B1+B2 +G1 + G2) ficou abaixo do limite oficial (20 μg/ kg) permitido pelo Ministério da Saúde/Anvisa27 e pelo Ministério da Agricultura, Pecuária e Abastecimento (MAPA)28 para alimentos destinados ao consumo humano. Esse limite é comparável aos estabelecidos por outros países e recomendado pela Organização para Alimentação e Agricultura29.
Tabela 1. Ocorrência de aflatoxinas em grãos de milho em municípios de diferentes regiões de Mato Grosso, safras 2009 e 2010
Na safra 2010, não foi detectada presença de aflatoxinas totais nas amostras das regiões Norte e Sul. Na região Oeste, 30% das amostras apresentou aflatoxinas totais com baixos níveis de contaminação. No entanto, na região Leste, 58,33% das amostras apresentou ocorrência de aflatoxinas, em níveis que ultrapassaram de forma significativa o limite máximo permitido pela legislação (Tabela 1).
No Brasil, outros trabalhos também relataram a ocorrência de aflatoxinas em milho e seus derivados, com porcentagens de contaminação variáveis de 1,5% a 100% e níveis de 0,1 a 1.500 μg/kg30-33, embora resultados de outras pesquisas não tenham evidenciado a presença destas toxinas, mesmo quando era observado o crescimento de fungos toxigênicos15,24,34.
Dos diferentes fatores que podem influenciar o crescimento de fungos toxigênicos e a produção de aflatoxinas, a umidade relativa, a temperatura e o teor de água são reportados como os principais3,4,15. Considerando-se que os grãos de milho analisados encontravam-se com teores de água definidos como seguros para o armazenamento após etapas de beneficiamento, a incidência do fungo aflatoxigênico e a produção de aflatoxinas nos grãos de milho ocorreram devido a infecção no campo.
Esse fato foi constatado por Cortês et al.35, quando 28,57% das amostras de milho retiradas de lavouras do estado de Mato Grosso apresentou nível médio de aflatoxinas de 12,35 μg/kg, indicando que o milho no ponto de colheita já apresentava contaminação por aflatoxinas. Ramos et al.36 avaliaram a ocorrência natural das aflatoxinas (B1, B2, G1 e G2) em grãos de milho do estado de Goiás (Jataí, Montividiu e Goiânia) e verificaram que os grãos já apresentavam aflatoxinas em níveis de 0 a 277,8 μg/kg de B1, de 0 a 14 μg/kg de B2, de 0 a 34,1 μg/kg de G1, e não foi detectada a aflatoxina G2. Marques et al.19 analisaram a incidência de fungos dos gêneros Aspergillus, Fusarium e Penicillium e as contaminações com micotoxinas em grãos de cinco híbridos comerciais de milho em função da umidade de colheita, e observaram que a produção de aflatoxinas ocorreu em grãos ainda nas espigas, no campo, devido a condições ambientais favoráveis aos patógenos.
Com a abertura de novos mercados para exportação e produção de alimentos, a preocupação com riscos alimentares e com o desenvolvimento de patologias, a qualidade sanitária da matéria-prima produzida – como exemplo, o milho – torna-se prioritária e necessária.
CONCLUSÃO
Grãos de milho com boa condição física também podem apresentar contaminação por fungos de potencial toxigênico.
A contaminação dos grãos foi devida principalmente aos fungos dos gêneros Fusarium, Aspergillus e Penicillium.
A presença do fungo aflatoxigênico e a produção de aflatoxinas ocorreram a partir da infecção dos grãos de milho em condições de campo.
Os níveis de contaminação das amostras pela aflatoxina B1 foram maiores em relação às aflatoxinas B2, G1 e G2.
As amostras da região Leste safra 2010 apresentaram níveis de contaminação acima do limite oficial (20 μg/kg) permitido pelo Ministério da Saúde/ Anvisa e o MAPA.
AGRADECIMENTOS
À Associação dos Produtores de Soja e Milho do Estado de Mato Grosso (Aprosoja), pela concessão de auxílio financeiro à pesquisa.
À CAPES, pela concessão de bolsa de fomento.
REFERÊNCIAS
1. Farias AX, Robb CF, Bittencourt AM, Andersen PM, Corrêa TB. Contaminação endógena por Aspergillus spp. em milho póscolheita no estado do Paraná. Pesq Agropec Bras. 2000;35(3):617- 21.
2. Kumar V, Basua MS, Rajendranb TP. Mycotoxin research and mycoflora in some commercially important agricultural commodities. Crop Protec. 2008;27:891-905.
3. Lazzari FA. Umidade, fungos e micotoxinas na qualidade de sementes, grãos e rações. 2. ed. Curitiba: edição do autor; 1997.
4. Scussel VM. Micotoxinas em alimentos. Florianópolis: Insular; 1998.
5. Almeida AP, Correa B, Mallozzi MAB, Sawazaki E, Soares LMV. Mycoflora and aflatoxin/fumonisin production by fungal isolates from freshly harvested corn hybrids. Braz J Microbiol. 2000;31(4):321-6.
6. Sweeney M.J, Dobson ADW. Mycotoxin production by Aspergillus, Fusarium and Penicillium species. Int J Food Microbiol. 1998;43:141-58.
7. Shotwell OL, Hesseltine CW, Stublefiled RD, Crenson WG. Production of aflatoxin on rice. App Microbiol. 1966;14(3):425- 8.
8. Diener UL, Cole RJ, Sanders TH, Payne GA, Lee LS, Klich MA. Epidemiology of aflatoxin formation by Aspergillus flavus. Ann Rev Phytopathol. 1987;25:249-70.
9. International Agency on Research on Cancer (IARC). Some naturally occurring substances: food items and constituents, heterocyclic aromatic amines and mycotoxins. Monographs on the evaluation of carcinogenic risks to humans. Lyon: IARC; 1993. v. 56.
10. Wangikar PB, Dwivedi P, Sinha N, Sharma AK, Telang AG. Effects of aflatoxin B1 on embryo fetal development in rabbits. Food Chem Toxicol. 2005;43:607-15.
11. Mallmann CA, Dilkin P. Micotoxinas e micotoxicoses em suínos. Santa Maria: edição do autor; 2007.
12. Kawashima LM, Soares LMV. Incidência de fumonisina B1, aflatoxinas B1, B2, G1 e G2, ocratoxina A e zearalenona em produtos de milho. Ciênc Tecnol Aliment. 2006;26(3):516-21.
13. Machado JC, Oliveira JA, Vieira MGGC, Alves MC. Controle da germinação de sementes de soja em testes de sanidade pelo uso da restrição hídrica. Rev Bras Sementes. 2003;25(2):77-81.
14. Mallmann CA, Almeida CAA, Mostardeiro C. Automation of the analytical procedure for simultaneous determination of aflatoxinas AFB1, AFB2, AFG1 and AFB2. In: Congresso Internacional de Micotoxinas e Phicotoxinas, 2000. São Paulo.
15. Dilkin P, Mallmann CA, Santurio JM, Hickmannet JL. Classificação macroscópica, identificação da microbiota fúngica e produção de aflatoxinas em híbridos de milho. Ciênc Rural. 2000;30(1):137-41.
16. Orsi RB, Correa B, Possi CR, Schammass EA, Nogueira JR, Dias SMC et al. Mycoflora and occurrence of fumonisins in freshly harvested and stored hybrid maize. J Stor Prod Res. 2000;36:75- 87.
17. Tanaka MAS, Maeda JA, Plaza IHAZ. Microflora fúngica de sementes de milho em ambientes de armazenamento. Sci Agric. 2001;58(3):501-8.
18. Santin JA, Reis EM, Matsumura ATS, Moraes MG. Efeito do retardamento da colheita de milho na incidência de grãos ardidos e de fungos patogênicos. Rev Bras Milho e Sorgo. 2004;3(2):182-92.
19. Marques OJ, Vidigal-Filho PS, Dalpasquale VA, Scapim CA, Pricinotto LF, Machinski M. Incidência fúngica e contaminações por micotoxinas em grãos de híbridos comerciais de milho em função da umidade de colheita. Act Scient Agro. 2009;31(4):667- 75.
20. Márcia BA, Lazzari FA. Monitoramento de fungos em milho em grão, grits e fubá. Ciênc Tecnol Aliment. 1998;18(4):363-7.
21. Adebajo LO, Idowu AA, Adesanya OO. Mycoflora and mycotoxins production in Nigerian corn and corn-based snacks. Mycopathol. 1994;126:183-92.
22. Asevêdo IG, Gambale W, Corrêa B. Mycoflora and aflatoxigenic species of Aspergillus spp. isolated from stored maize. Rev Microbiol. 1994;25(1):46-50.
23. Pozzi CR, Corrêa B, Gambale W, Paula CR, Chacon-Reche NO, Meirelles MCA. Post-harvest and stored corn in Brazil: mycoflora interaction, abiotic factors and mycotoxins occurrence. Food Addit Contam. 1995;12:313-9.
24. Pezzini V, Valduga E, Cansinai RL. Incidência de fungos e micotoxinas em grãos de milho armazenados sob diferentes condições. Rev Inst Adolfo Lutz. 2005;64(1):91-6.
25. Miller JD. Fungi and Mycotoxins in Grain: Implications for Stored Product Research. J Stor Prod. Res. 1995;31:1-16.
26. Cruz JC, Karam D, Monteiro MAR, Magalhaes PC. A cultura do milho. 1ª ed. Sete Lagoas: Embrapa Milho e Sorgo; 2008.
27. Brasil. Ministério da Saúde. Resolução RDC nº 7, de 18 de fevereiro de 2011. Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos. Diário Oficial [da] União. Brasília, 9 mar 2011. Seção I, p. 66.
28. Brasil. Ministério da Agricultura do Abastecimento e da Reforma Agrária. Portaria n. 183, de 21 de março de 1996. Adota Regulamento Técnico do Mercosul sobre limites máximos de aflatoxinas admissíveis no leite, amendoim e milho, aprovado pela Resolução do Grupo Mercado Comum do Sul n. 56/94. Diário Oficial da União. Brasília, DF, 25 mar 1996, Seção I, p. 4929.
29. Food and Agriculture Organization of the United Nations (FAO). Regulamentos a nivel mundial para las micotoxinas en los alimentos y en las raciones en el año 2003. Disponível em: [http://www.fao.org/docrep/007/y5499s/y5499s00.HTM].
30. Caldas ED, Silva SC, Oliveira JN. Aflatoxinas e ocratoxina A em alimentos e riscos para a saúde humana. Rev Saúde Pública. 2002;36(3)319-23.
31. Piedade FS, Fonseca H, Gloria EM, Domingues MAC, Piedade SMS, Barbin D. Distribution of aflatoxins in corn fractions visually segregated for defects. Braz J Microbiol. 2002;33:250-4.
32. Gloria EM, Ciacco CF, Lopes JF, Ericsson C, Zochi SS. Distribution of aflatoxin contamination in maize samples. Ciênc Tecnol Aliment. 2004;24(1):79-83.
33. Sekiyama BL, Ribeiro AB, Machinski PA, Machinski M. Aflatoxins, ochratoxin A and zearalenone in maize-based food products. Braz J Microbiol. 2005;36(3):289-94.
34. Nicácio MAS, Prado G, Linardi VR. Determinação de aflatoxina e identificação da microbiota fúngica em milho (Zea mayz) póscolheita. Rev Arq Inst Biol. 1995;38(3):851-7.
35. Cortes NA, Cassetari Neto D, Correa B. Ocorrência de aflatoxinas em milho produzido pelo sistema tradicional de cultivo, em comunidades de agricultura familiar, no estado de Mato Grosso. Hig Alimentar. 2000;14(77):16-25.
36. Ramos CRBA, Brasil EM, Geraldine RM. Contaminação por aflatoxinas em híbridos de milho cultivados em três regiões do estado de Goiás. Pesq Agropec Tropic. 2008;38(2):95-102.