Bronquite infecciosa pneumovírus aviário
Qual é o papel da bronquite infecciosa e do pneumovírus aviário em problemas de fertilidade em machos?
Publicado: 7 de julho de 2009
Por: Laura Y. Villarreal B. MSc – PhD. Gerente Técnica Avicultura. Intervet Schering Plough Animal Health – Brasil
Durante os últimos anos, os problemas reprodutivos em aves de ciclo longo (machos e fêmeas), tem tido um aumento considerável se os compararmos com a casuística respiratória apresentada neste tipo de aves. O objetivo principal do produtor é o de ter os índices de produção das suas aves altos, com ótima qualidade e gerando uma progênie saudável e que terá um excelente comportamento zootécnico no campo; no entanto, problemas de queda de fertilidade e alteração da qualidade do ovo e do pintinho estão sendo cada vez mais e mais freqüentes, quebrando o elo principal da criação das aves.
Neste sentido, apresentaremos algumas teorias e dados que sugerem a relação do vírus da bronquite infecciosa das galinhas (VBIG) e do pneumovírus aviário (aMPV) com os problemas descritos anteriormente. É importante considerar que, embora estejamos apresentando a relação direta destes vírus com esta sintomatologia, os mesmos são apenas uma das causas deste tipo de patologias, não se podendo, portanto, descartar outras etiologias (sejam infecciosa ou não).
O vírus da Bronquite infecciosa (VBIG) é um vírus epiteliotrópico que causa doença aguda e, em alguns casos, severa nos tratos respiratório, renal, reprodutivo e entérico de galinhas (6, 8, 12). A replicação no oviduto resulta em declínio da produção e da qualidade dos ovos (13, 14, 21). Este VBIG (um coronavírus) causa, portanto, consideráveis perdas econômicas à indústria avícola.
Por sua vez, o pneumovírus aviário (Metapneumovírus aviário, aMPV) pertence à família Paramyxoviridae. Com base em padrões de neutralização utilizando anticorpos monoclonais e análise molecular, os pneumovírus são subdivididos em quatro subtipos diferentes (A, B, C e D) (3, 15, 17). Em poedeiras comerciais, a infecção por aMPV pode afetar a qualidade dos ovos (11) e causar uma ampla gama de anormalidades reprodutivas incluindo peritonite por ovos, queda de produção, ovos com alteração no formato da casca e regressão do ovário e do oviduto (15). As infecções por aMPV também são associadas com a síndrome da cabeça inchada em galinhas.
Em estudos anteriores em machos, demonstrou-se que vários fatores podem alterar a produção de esperma fértil, o que pode levar à presença de cálculos na região epididimária, mais especificamente nos ductos deferentes (21). Alguns autores demonstraram que galos com cálculos podem ter testículos com tamanho e peso menor e diminuição da produção diária de esperma (4). Embora o VBIG e o aMPV já tenham sido sugeridos como possíveis causas de formação de pedras de cálcio no epidídimo, uma associação definitiva ainda não foi estabelecida (Villarreal, et al 2007).
Um fato interessante é que a vacinação com vacina viva atenuada de bronquite infecciosa já foi associada com o desenvolvimento de pedras testiculares e, portanto, com problemas de redução da fertilidade (4). No entanto, Mahecha et al. (2002) demonstrou que não existe uma relação definitiva entre a vacinação com vacina viva de VBIG e a ocorrência de cálculos, uma vez que lotes que não receberam nenhum tipo de vacinação de BIG também apresentaram tal lesão.
É importante que lembremos que o papel do VBIG e o aMPV na patogenia reprodutiva da fêmea se deriva da replicação destes vírus no epitélio ciliado do trato reprodutivo, resultando em perda de cílios, degeneração e necrose das células epiteliais e glandulares (Pradhan et al, 1982; Wilding et al, 1986). Da mesma forma, o epitélio dos ductos eferentes dos testículos dos machos também consiste de células ciliadas e não ciliadas, sendo estas, portanto, bastante susceptíveis à replicação destes dois vírus.
A região epididimária dos galos consiste de uma rede testicular, ductos eferentes, ductos conectores e o ducto epididimário. Uma das principais estruturas dos testículos são exatamente os ductos eferentes e a sua função primária inclui reabsorção de fluidos, transporte e concentração de esperma, fagocitose do esperma e secreção de proteínas (21).
Já é bem estabelecido que uma das anormalidades que podem levar à baixa de fertilidade em galos é a formação de pedras de cálcio nos ductos deferentes. Uma vez que os cálculos são formados nos ductos deferentes na região epididimária, a produção e a viabilidade do esperma são seriamente comprometidas, uma vez que os ductos deferentes são responsáveis pela reabsorção de fluido dos testículos e qualquer dano desta função leva a acúmulo e refluxo de fluidos, atrofia testicular e infertilidade.
A associação entre infecção por IBV e aMPV em testículos de galos com lesões epididimárias microscópicas associadas com baixa fertilidade e problemas respiratórios em lotes de reprodutores com baixa performance reprodutiva é um fato conhecido. A relação entre a replicação do VBIG e a queda de fertilidade é explicada pela capacidade deste vírus em destruir os ductos eferentes, o epidídimo, os túbulos seminíferos e por ser uma das causas que levam ao aparecimento de cálculos epididimários (Figura 1) Boltz et al. (2004) e Villarreal et al (2007).
Como exposto anteriormente, o aMPV tem tropismo por células epiteliais ciliadas do trato reprodutivo das fêmeas, e é, portanto, bastante provável que este vírus tenha um papel principal na patogenia reprodutiva em machos.
Outras infecções (bactérias como Chlamydophila) e agentes tóxicos (aflatoxinas) não devem ser descartados, uma vez que estes também podem suprimir a espermatogênese, levando a anormalidades dos espermatozoides e atrofia dos testiculos e, além disso, tais eventos já foram também associados com calcificação, urolitíase e cálculos.
Falhas de manejo, incluindo estimulo de luz e alimentação, são também fatores diretamente responsáveis por alteração na multiplicação das células de Sertoli, as quais determinam o potencial de fertilidade dos machos, fatores este que devem também ser levados em conta.
Concluindo-se, o VBIG e o aMPV são altamente sugestivos de possuir um papel importante em complicações reprodutivas nos machos e devem ser considerados sempre como agentes etiológicos neste tipo de alterações. Avaliações dos programas vacinais utilizados, assim como manejo e outros possíveis agentes devem estar sob constante monitoramento na granja.
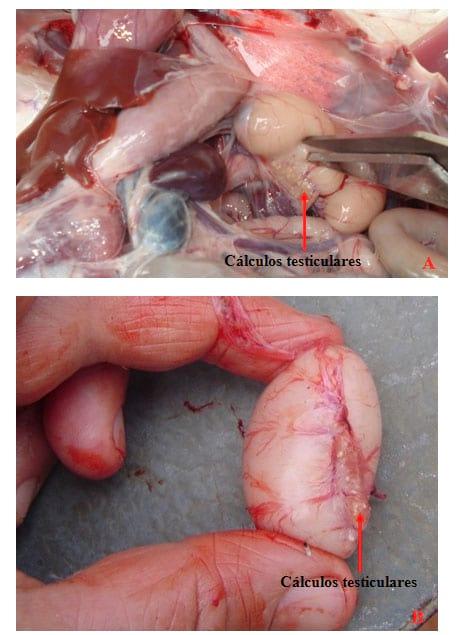
Figura 1: A e B. Calculos testiculares na região dos ductos deferentes, evidenciados em machos apresentando queda acentuada da fertilidade.
Neste sentido, apresentaremos algumas teorias e dados que sugerem a relação do vírus da bronquite infecciosa das galinhas (VBIG) e do pneumovírus aviário (aMPV) com os problemas descritos anteriormente. É importante considerar que, embora estejamos apresentando a relação direta destes vírus com esta sintomatologia, os mesmos são apenas uma das causas deste tipo de patologias, não se podendo, portanto, descartar outras etiologias (sejam infecciosa ou não).
O vírus da Bronquite infecciosa (VBIG) é um vírus epiteliotrópico que causa doença aguda e, em alguns casos, severa nos tratos respiratório, renal, reprodutivo e entérico de galinhas (6, 8, 12). A replicação no oviduto resulta em declínio da produção e da qualidade dos ovos (13, 14, 21). Este VBIG (um coronavírus) causa, portanto, consideráveis perdas econômicas à indústria avícola.
Por sua vez, o pneumovírus aviário (Metapneumovírus aviário, aMPV) pertence à família Paramyxoviridae. Com base em padrões de neutralização utilizando anticorpos monoclonais e análise molecular, os pneumovírus são subdivididos em quatro subtipos diferentes (A, B, C e D) (3, 15, 17). Em poedeiras comerciais, a infecção por aMPV pode afetar a qualidade dos ovos (11) e causar uma ampla gama de anormalidades reprodutivas incluindo peritonite por ovos, queda de produção, ovos com alteração no formato da casca e regressão do ovário e do oviduto (15). As infecções por aMPV também são associadas com a síndrome da cabeça inchada em galinhas.
Em estudos anteriores em machos, demonstrou-se que vários fatores podem alterar a produção de esperma fértil, o que pode levar à presença de cálculos na região epididimária, mais especificamente nos ductos deferentes (21). Alguns autores demonstraram que galos com cálculos podem ter testículos com tamanho e peso menor e diminuição da produção diária de esperma (4). Embora o VBIG e o aMPV já tenham sido sugeridos como possíveis causas de formação de pedras de cálcio no epidídimo, uma associação definitiva ainda não foi estabelecida (Villarreal, et al 2007).
Um fato interessante é que a vacinação com vacina viva atenuada de bronquite infecciosa já foi associada com o desenvolvimento de pedras testiculares e, portanto, com problemas de redução da fertilidade (4). No entanto, Mahecha et al. (2002) demonstrou que não existe uma relação definitiva entre a vacinação com vacina viva de VBIG e a ocorrência de cálculos, uma vez que lotes que não receberam nenhum tipo de vacinação de BIG também apresentaram tal lesão.
É importante que lembremos que o papel do VBIG e o aMPV na patogenia reprodutiva da fêmea se deriva da replicação destes vírus no epitélio ciliado do trato reprodutivo, resultando em perda de cílios, degeneração e necrose das células epiteliais e glandulares (Pradhan et al, 1982; Wilding et al, 1986). Da mesma forma, o epitélio dos ductos eferentes dos testículos dos machos também consiste de células ciliadas e não ciliadas, sendo estas, portanto, bastante susceptíveis à replicação destes dois vírus.
A região epididimária dos galos consiste de uma rede testicular, ductos eferentes, ductos conectores e o ducto epididimário. Uma das principais estruturas dos testículos são exatamente os ductos eferentes e a sua função primária inclui reabsorção de fluidos, transporte e concentração de esperma, fagocitose do esperma e secreção de proteínas (21).
Já é bem estabelecido que uma das anormalidades que podem levar à baixa de fertilidade em galos é a formação de pedras de cálcio nos ductos deferentes. Uma vez que os cálculos são formados nos ductos deferentes na região epididimária, a produção e a viabilidade do esperma são seriamente comprometidas, uma vez que os ductos deferentes são responsáveis pela reabsorção de fluido dos testículos e qualquer dano desta função leva a acúmulo e refluxo de fluidos, atrofia testicular e infertilidade.
A associação entre infecção por IBV e aMPV em testículos de galos com lesões epididimárias microscópicas associadas com baixa fertilidade e problemas respiratórios em lotes de reprodutores com baixa performance reprodutiva é um fato conhecido. A relação entre a replicação do VBIG e a queda de fertilidade é explicada pela capacidade deste vírus em destruir os ductos eferentes, o epidídimo, os túbulos seminíferos e por ser uma das causas que levam ao aparecimento de cálculos epididimários (Figura 1) Boltz et al. (2004) e Villarreal et al (2007).
Como exposto anteriormente, o aMPV tem tropismo por células epiteliais ciliadas do trato reprodutivo das fêmeas, e é, portanto, bastante provável que este vírus tenha um papel principal na patogenia reprodutiva em machos.
Outras infecções (bactérias como Chlamydophila) e agentes tóxicos (aflatoxinas) não devem ser descartados, uma vez que estes também podem suprimir a espermatogênese, levando a anormalidades dos espermatozoides e atrofia dos testiculos e, além disso, tais eventos já foram também associados com calcificação, urolitíase e cálculos.
Falhas de manejo, incluindo estimulo de luz e alimentação, são também fatores diretamente responsáveis por alteração na multiplicação das células de Sertoli, as quais determinam o potencial de fertilidade dos machos, fatores este que devem também ser levados em conta.
Concluindo-se, o VBIG e o aMPV são altamente sugestivos de possuir um papel importante em complicações reprodutivas nos machos e devem ser considerados sempre como agentes etiológicos neste tipo de alterações. Avaliações dos programas vacinais utilizados, assim como manejo e outros possíveis agentes devem estar sob constante monitoramento na granja.

Figura 1: A e B. Calculos testiculares na região dos ductos deferentes, evidenciados em machos apresentando queda acentuada da fertilidade.

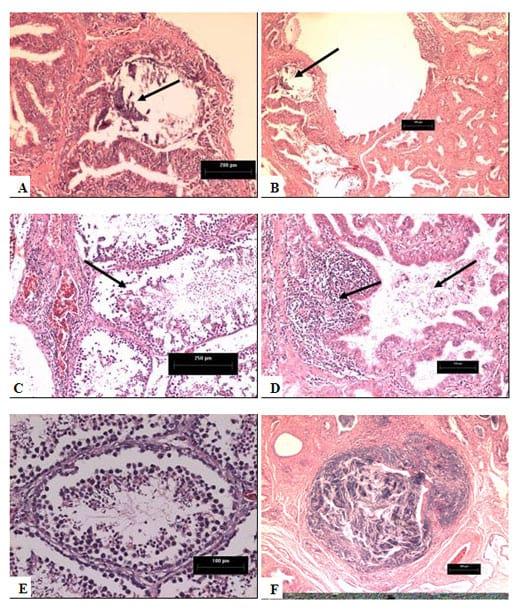
Figura 2 – Achados histopatológicos nos testiculos de galos com diminuição da fertilidade em que foram detectados VBIG e aMPV. Figura A e B: Presença de resquícios de um cálculo (seta). Figuras C e D: infiltrado inflamatório (linfócitos) e debris celulares (setas). Figura E: ductos seminíferos com baixa concentração de espermatozóides viáveis, debris celulares e infiltrado inflamatório. Figura F: testículos normais com quantidade normal de espermatozóides. Coloração HE, aumento 100x. (Villarreal, et al. 2007)
REFERENCIAS
- Bäyon-Auboyer, M. H., C. Arnauld, D. Toquin and N. Eteradossi. Nucleotide sequences of the F, L and G protein genes of two non-A / non-B avian pneumoviruses (APV) reveal a novel APV subgroup. Journal of General Virology, 81: 2723-2733. 2000.
- Boltz, A. D., M. Nakai, J. M. Bahr. Avian infectious bronchitis virus: A possible cause of reduced fertility in the rooster. Avian Diseases, 48: 909-915. 2004.
- Cavanagh, D. and S. A. Naqi. 2003. Infectious Bronchitis, p. 101-119. In: Y.M., Saif; Barnes, H.J.; Glisson, J.R.; Fadly, A.M.; McDougald, L.R. and Swayne, D.E. (ed). Diseases of Poultry, 11th ed. Iowa State University Press, Ames.
- Cook, J. A. K. Avian pneumovirus infections in turkeys and chickens. Review. The Veterinary Journal, 160: 118-125. 2000.
- Crinion, R. A. P., R. A. Ball and M. S. Hofstad. Pathogenesis of oviduct lesions in immature chickens following exposure to infectious bronchitis virus at one day old. Avian Diseases, 15(1):32-41. 1971.
- Dhinakar, G and R. C. Jones. Growth of infectious bronchitis virus vaccines in oviducts derived from oestrogen-treated chicks and embryos. Vaccine, 15(2), 163-168. 1997.
- Gough, R.E. Avian pneumoviruses. In: Diseases of Poultry, 11th ed. Saif, Y. M., H. J. Barnes, J. R. Glisson, A. M. Fadly, L. R. McDougald and D. E. Swayne. Iowa State University Press, Ames, IA. pp. 308-317. 2003.
- Hess, M., M. B. Huggins, R. Mudzamiri and V. Heinez. Avian pneumovirus excretion in vaccinated and non-vaccinated specific pathogen free laying chickens. Avian Pathology, 33(1): 35-40. 2004.
- Ilio, K. Y and R.A. Hess. Structure and function of the ductuli efferentes: A review. Microscopy Research and Technique. 29: 432-467. 1994.
- Janssen, S. J., J. D. Kirby, R. A. Hess, M. Rhoads, D. Bunick, K. L. Bailey, C. M. Parsons, H. Wang, J. M. Bahr. Reduced fertility in roosters with epididymal calcium stones. Poultry Science, 79: 568-574. 2000.
- Jones, R. C., and F. T. W. J. Jordan. The site of replication of IBV in the oviduct of experimentally infected hens. Veterinary Record. 91: 317, 1972.
- Jones, R. C., C. J. Naylor, J. M. Bradbury, C. E. Savage, K. Worthington and R. A. Williams. Isolation of turkey rhinotracheitis-like virus from broiler breeders in England. Veterinary Record, 129: 509-510. 1991.
- Kwon, S., R. A. Hess, D. Bunick, H. Nitta, L. Janulis, Y. Osawa and J. Bahr. Rooster testicular germ cells and epididymal sperm contain p450 aromatase. Biology of Reproduction, 53: 1259-1264. 1995.
- Mahecha, G. A. B., C. A. Oliveira, K. Balzuweit and R. A. Hess. Epididymal lithiasis in roosters and efferent ductule and testicular damage. Reproduction, 124: 821-834. 2002.
- Ortatatli, M., M. K. Ciftci, M. Tuzcu, A. Kaya. The effects of aflatoxin on the reproductive system of roosters. Research in Veterinary Science, 72: 29-36. 2002.
- Pradhan, H. K., G. C. Mohanty and Rajya. Comparative sensitivities of oviduct and tracheal organ cultures and chicken embryo kidney cell cultures to Infectious bronchitis virus. Avian diseases, 27(3): 594-601. 1982
- Pringle, C.R. Virus taxonomy. Archives of Virology, 143: 1449-1459. 1998
- Uenaka, T. and I. Kishimoto. Intracloacal infection with avian infectious bronchitis virus. Avian Pathology, 27: 309-312. 1998.
- Villarreal, L.Y.B.; Brandão, P.E.B; Chacón, J.L.V; Assayag, M.S; Maiorka, P.C; Raffi, P; Saidenberg, A.B.S; Jones, R.C ; Ferreira, A.J.P. Orchitis in roosters with reduced fertility associated with avian infectious bronchitis virus and avian pneumovirus infections. Avian Diseases, 51(4): 900-904. 2007.
- Wilding, G. P., C. Baxter-Jones and M. Grant. Ciliostatic agent found in rhinotracheitis. Veterinary Record, 118: 735. 1986.
Tópicos relacionados
Autores:
Junte-se para comentar.
Uma vez que se junte ao Engormix, você poderá participar de todos os conteúdos e fóruns.
* Dados obrigatórios
Quer comentar sobre outro tema? Crie uma nova publicação para dialogar com especialistas da comunidade.
Criar uma publicação




